KEYNOTE-189是免疫检查点抑制剂联合化疗用于晚期NSCLC一线治疗的第一个III期研究。4月16日,KEYNOTE-189在2018AACR会议和新英格兰杂志上同步公布结果,下面跟随小编一起看一下这振奋人心的结果!
PD-1及其配体PD-L1抑制剂是EGFR或ALK突变敏感阴性转移性NSCLC患者的有效治疗药物。目前FDA已批准帕博利珠单抗(pembrolizumab,Merck公司,商品名Keytruda,俗称K药)、nivolumab(BMS公司,商品名Opdivo,俗称O药)以及 atezolizumab(Genentech公司,商品名Tecentriq,俗称T药)用于治疗二线治疗NSCLC。
TPS(tumor proportion score)指肿瘤细胞中染色阳性的细胞比例。对于PD-L1染色TPS为50%或更高的NSCLC患者,pembrolizumab取代化疗作为一线治疗的首选。然而,TPS为50%及以上的患者只占NSCLC患者的一小部分。由于NSCLC患者在疾病进展过程中可以迅速恶化,只有不到一半的晚期NSCLC患者能够接受到二线免疫治疗。
一线化疗方案中加入PD-1或PD-L1抑制剂组合方案,可以提高患者治疗响应率,延长生存。究其根源可能是细胞毒性化疗药物潜在的免疫原性作用(如肿瘤细胞破坏后增加抗原呈递树突状细胞的潜力、降低骨髓来源的抑制免疫应答细胞活性、细胞毒性淋巴细胞与调节性T细胞的比例、阻断STAT6信号通路增强树突状细胞活性),通过PD-1抑制剂的调节,使免疫响应得以增强。
一项早期的II期临床试验(KEYNOTE-021)结果显示在卡铂+培美曲塞为基准化疗方案上加载帕博利珠单抗,能够显著提高患者的缓解率率和无进展生存PFS。KEYNOTE-189是在此基础上开展的一项国际多中心双盲、安慰剂对照III期临床试验,目的是比较在以培美曲塞+铂类为基准化疗方案的基础上,是否增加帕博利珠单抗对于治疗任意PD-L1表达水平的非鳞NSCLC患者的疗效和安全性。
年满18周岁以上,经病理确认的转移性非鳞NSCLC,且EGFR或ALK突变敏感阴性;之前未针对转移性疾病接受过系统化疗;ECOG评分0分或1分;至少存在1处可以通过RECIST1.1标准判定的病变;并可以提供用于检测PD-L1状态的标本。排除有中枢神经系统转移症状;有需要使用糖皮质激素治疗的非感染性肺炎史;有自身免疫性疾病,或接受过全身免疫抑制治疗的患者。由发生肺炎的危险性增加,在过去6个月接受肺部放疗超过30 Gy的病人也被排除在外。
入组患者按照2:1的比例被随机分配到加载帕博利珠单抗或生理盐水组,剂量和用法为固定200mg剂量每三周静脉注射方案,最多可治疗35个疗程。随机化通过基于语音或Web的中央随机化系统实施。分层控制因素包括PD-L1状态(TPS≥1% vs <1%)、铂类药物(顺铂vs.卡铂)和吸烟状态(从不 vs 吸烟或有吸烟史)。
根据主治医生的选择,两组患者需接受4个疗程的卡铂(AUC每分钟5毫克)或顺铂75 mg /m2,同时联合培美曲塞500 mg / m2,每3周一个疗程。随后两组接受培美曲塞的维持治疗。
两个主要评价指标为OS和PFS。次要评价指标包括缓解率(CR+PR)、缓解时间(自PR或CR起,至下一次进展或死亡的时间),及安全性指标。缓解率和缓解持续时间由独立的盲态放射学评审委员会进行评价。探索性分析包括PD-L1表达对于患者疗效和患者自己报告的结局的影响。
预计入组570人,进行2次期中分析和一次最终分析。首次期中分析计划在入组完成时进行,此时预计约有370例PFS事件数,预计约有242例OS事件数。
截止2017年11月8日入组完成时,实际共发生PFS事件数410例,OS事件数235例。基于这些观察到的事件数,多重调整的单侧一类检验水准α在首次期中分析中对PFS和OS分别设定为0.00559和0.00128。结果于2018年1月10经外部独立的数据监察委员会审核后,宣布在首次期中分析时就已满足设定的标准。本论文主要报道首次期中分析的结果。但本研究目前仍在进行中,以期得到更长时间随访的结果。
来自16个国家126个中心的965名患者进行筛选入组。在2016年2月26日至2017年3月6期间,共计有来自118个中心的616例患者满足条件入组并进行随机化,其中帕博利珠单抗 +化疗(“pemb组”)410例;安慰剂+化疗(“安慰剂组”)206例。pemb组中有405人接受了至少一次联合治疗,82.5%的患者接受了计划的4个周期的治疗,76.5%的治疗患者接受5个周期以上的治疗;安慰剂组中有202人接受了至少一次联合治疗,74.3%的患者接受了计划的4个周期的治疗,66.8%的患者接受了5个周期以上的培美曲塞治疗。88.1%的患者具有烟者史,72.2%患者使用卡铂,63.0%的患者TPS≥1%。
截至2017年11月8日,中位随访时间10.5个月时(Range: 0.2-20.4),pemb组和安慰剂组分别有33.8%和17.8%仍在进行治疗。安慰剂组中,有67名患者在研究期间使用了帕博利珠单抗,18名患者在研究之外接受了抗PD-1/PD-L1治疗(交叉比例ITT集中为41.3%,排除仍在接受治疗的患者后比例为50.0%)。
ITT分析中,共有235名患者死亡,pemb组与安慰剂组患者预计12个月的生存率分别为69.2%(95% CI,64.1~73.8)和49.4%(95% CI,42.1~ 56.2)。pemb组患者的中位生存时间还未观察到,而安慰剂组患者的中位生存时间为11.3月(95% CI,8.7~ 15.1),HR =0.49(95% CI 0.38-0.64; P <.00001>
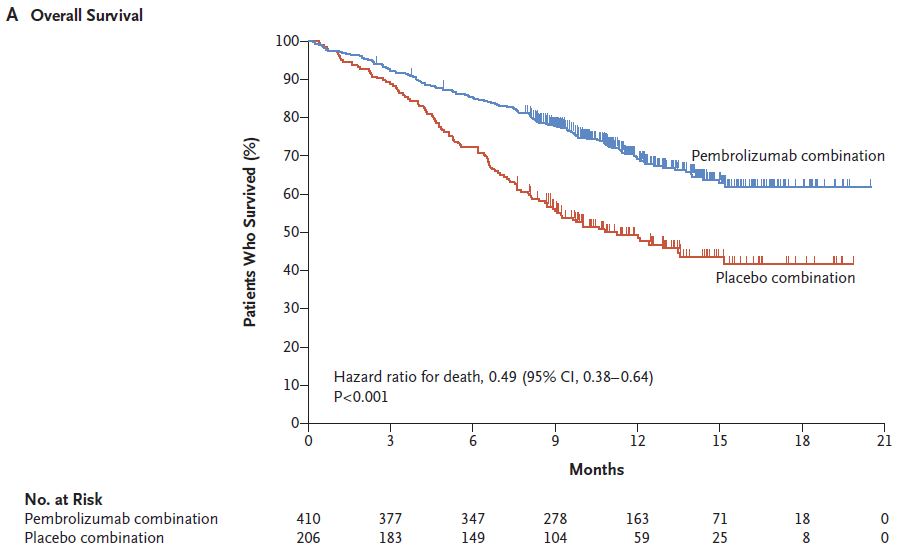
图1A 两组患者OS的比较
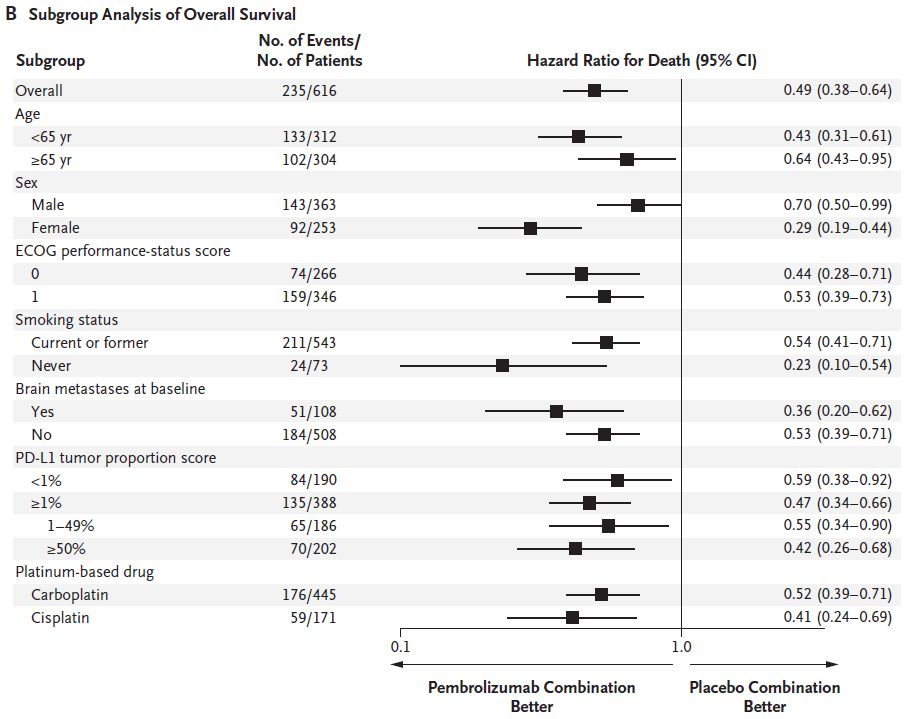
图1B 两组患者OS的亚组分析
截止分析时,发生PFS事件数410例,pembrolizumab组与安慰剂组患者中位PFS分别为8.8月(95% CI,7.6~ 9.2)和4.9月(95% CI,4.7~ 5.5),HR=0.52(95%CI 0.43~0.64; P <.001 ci>
pemb组和安慰剂组的缓解率分别为47.6%和18.9%(P <0.001);缓解持续时间分别为11.2月 vs 7.8月,并且无论PD-L1表达水平的高低,pembrolizumab组均显示出较高的缓解率。
pemb组与安慰剂组发生3级以上AE的患者分别为67.2%和65.8%。两组AE导致的任何治疗终止分别为27.7%(pembrolizumab组)和14.9%(安慰剂组);所有治疗终止分别为13.8%(pemb组)和7.9%(安慰剂组)、导致的死亡分别为6.7%(pemb组)和5.9%(安慰剂组)。
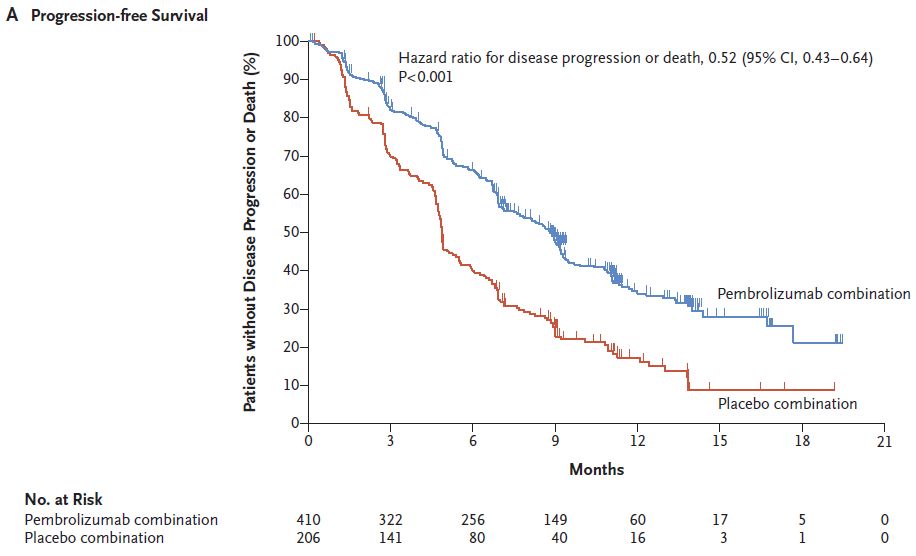
图2A 两组患者PFS的比较
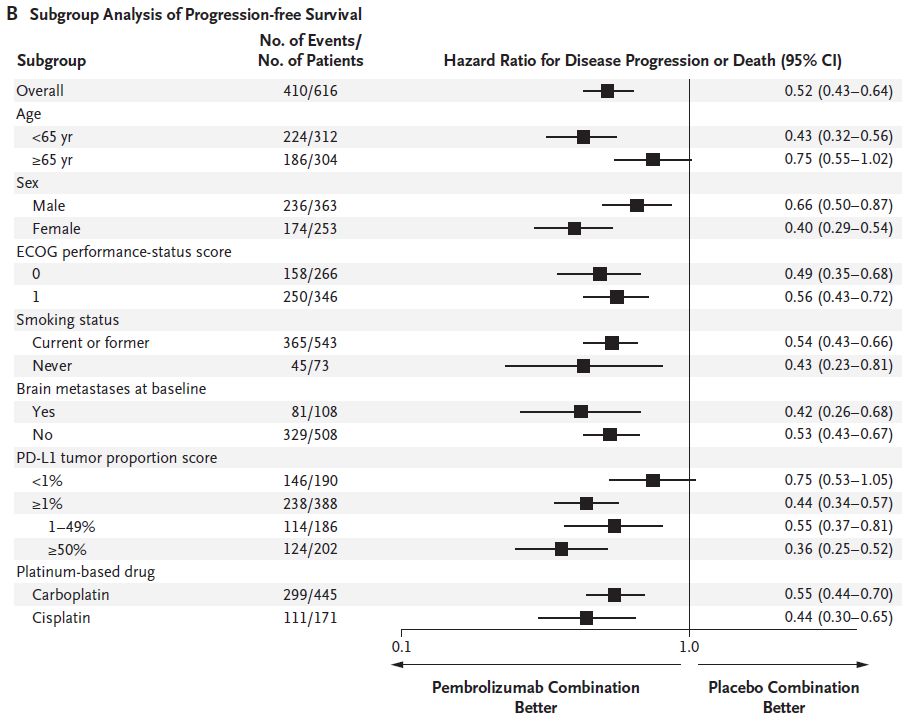
图2B 两组患者PFS的亚组分析
对于转移性非鳞NSCLC患者,若EGFR或ALK突变敏感阴性,加载帕博利珠单抗与培美曲塞和铂类药物的诱导治疗或培美曲塞维持治疗相比,具有显著延长的OS和PFS,以及显著提高的缓解率。而付出的代价仅仅是较低的肾功能损伤发生率。并且帕博利珠单抗治疗后在各个PD-L1表达的亚组中均显示了生存获益。
上述结果表明,帕博利珠单抗联合培美曲塞和铂类化疗方案可能成为非鳞NSCLC患者一线治疗新标准。
Pembrolizumab plus Chemotherapy in Metastatic Non–Small-Cell Lung Cancer. N Engl J Med, April 16, 2018. DOI: 10.1056/NEJMoa1801005
目前PD-1及PD-L1相关的肺癌试验在我国招募中,非小细胞肺癌及小细胞肺癌都可以报名,该系列试验要求患者既往未曾接受过一线治疗,不携带EGFR和ALK突变。如果您的身边有符合以上条件,且有意愿参加PD-1/PD-L1临床试验的患者,可点击“阅读原文”即可进行报名:我们会尽快安排医学人员与您取得联系!

















