
在看文章的时候,我们总能第一眼看到所解析的结构是几埃,几埃,这真的很重要的吗?
我们所看到的结构细节究竟有多靠谱那?
我们还可以可以提高我们结构的精度吗?
冷冻电镜(cryo-EM) - 能够在分子水平上显示病毒,蛋白质和其他生物结构。
最近,已经以分辨率高于
4
埃的方式报告了具有相关原子坐标的冷冻电镜结构。然而,很少有人严格评估观测到的特征的可靠性或实验数据与其对应的残差水平和模型之间的相关性。通常,这种相关性以被称为
FSC
的曲线来报告,
FSC
是空间频率的函数。虽然包含丰富的信息,但并不保证本地特征的真实性,也不表明模型中的哪些特征与观察到的密度一致或不同意。
理想情况下,可以使用分子模型来生成在其大部分或全部冷冻电镜图像中的细节中,从而构成了报告分辨率下样本结构的可信赖且信息丰富的模型。这项工作则调研了在近原子分辨率下确定的模型与结构密度之间的一致或不一致。这些努力为冷冻电镜的定量评估奠定了基础。
现在研究人员通过新的计算算法,首次在构建噬菌体P22的3-D原子尺度模型,并且鉴定了其稳定性至关重要的蛋白质相互作用,进一步扩大了cryo-EM的影响。
来自贝勒医学院的20000多个二维冷冻电镜图片最终汇成高精度噬菌体P22(也称为感染普通细菌沙门氏菌的P22病毒)的结构,结果已经由结果由巴勒医学院,麻省理工学院,普渡大学和伯克利实验室的研究人员在3月初在国家科学院院刊上发表。

伯克利实验室的分子生物物理与综合生物成像部门主管和本文的合作者Paul Adams说:“
这是一个如何利用电子显微技术并将其与新的计算方法相结合以确定噬菌体结构的绝佳例子
。 “我们开发了算法来优化原子模型,使其最匹配实验数据。
伯克利实验室计算研究科学家和论文合作者Pavel Afonine基于 Phenix开发算法,该软件是传统上用于X射线晶体学测定大分子结构的软件套件。
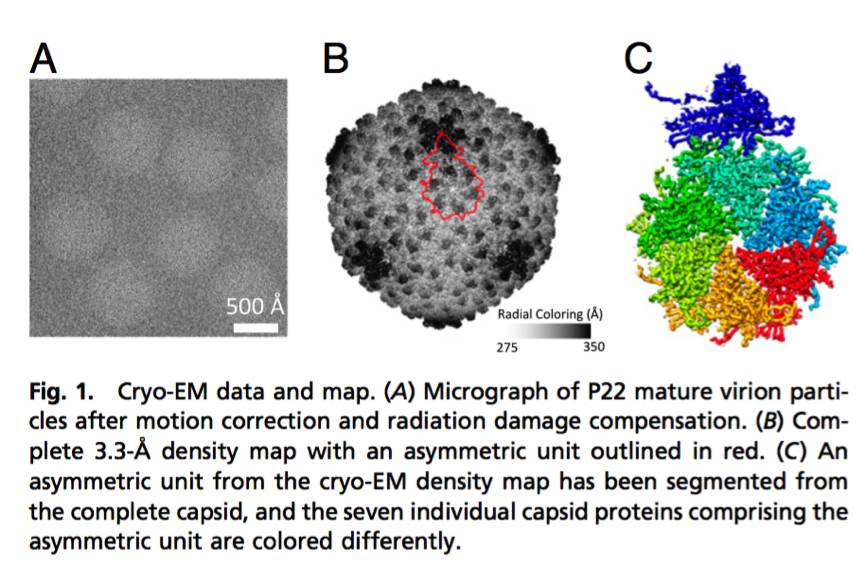
噬菌体P22的3-D原子尺度模型的成功呈现允许研究人员在高分辨率下窥视病毒蛋白质外壳。 Bayle生物化学教授Wah Chiu的研究生Corey Hryc认为,以前的结果使贝勒大学研究人员能够了解大部分蛋白质骨架,而不是精细细节,这是多年的工作的顶点。

“由于这个精致的结构细节,我们已经确定了P22病毒的蛋白质化学,”邱说。 “我认为,重要的是我们提供详细的注释结构,以便其他研究人员可以将其用于未来的实验。”他补充说。 Chiu的实验室已经使用cryo-EM和计算机重构技术来构建3-D分子结构接近三十年。
研究结果也可能具有宝贵的生物学意义。
由于三维原子尺度模型,现在“可以看到构成P22病毒的部分之间的相互作用,这对于使其稳定至关重要,”亚当斯说。这有助于研究人员弄清楚如何制备可以结合某些蛋白质的化学物质。亚当斯强调,了解分子空间中原子配置的能力可用于对药物设计和开发的新见解。
参考文献:
1.
Corey F. Hryc, Dong-Hua Chen, Pavel V. Afonine, Joanita Jakana, Zhao Wang, Cameron Haase-Pettingell, Wen Jiang, Paul D. Adams, Jonathan A. King, Michael F. Schmid, Wah Chiu. Accurate model annotation of a near-atomic resolution cryo-EM map. Proceedings of the National Academy of Sciences, 2017; 114 (12): 3103 DOI: 10.1073/pnas.1621152114





