

近年来,中西药联合应用越来越被广泛地应用于肿瘤、心血管疾病和神经系统疾病的治疗中,虽然中西药联合应用可提高疗效,但也常常会发生很多不良反应,进而引起了研究人员对中药
-
化学药相互作用的密切关注。本文从
P-
糖蛋白
P-glycoprotein
,
P-gp
)介导的中药
-
西药相互作用方面阐述中西药联合用药的合理性与重要性。
1
P-gp
简介
P-gp
是一种能量依赖型膜蛋白,主要通过水解
ATP
酶,将细胞内药物(或细胞毒物)逆浓度梯度转运至细胞外,从而降低细胞内的药物(或细胞毒物)浓度,在体内发挥外排泵作用
[1]
。随着分子生物学的快速发展,大量研究发现,
P-gp
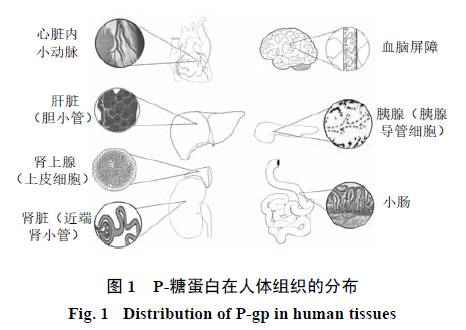
广泛分布于体内各组织细胞中,除在肿瘤细胞高度表达外,在正常组织如肝脏(胆小管)、肾脏(近端肾小管)、肠道(小肠、结肠柱状黏膜细胞)、胰腺(胰腺导管细胞)、肾上腺(上皮细胞)、胎盘、卵巢、血脑屏障(
BBB
)、淋巴细胞和心脏内小动脉等部位均有较高水平的表达
[2]
,见图
1
。在正常生理状态下,
P-gp
的主要作用是调节机体对内源性、外源性药物
和毒素的吸收、分布和排泄,从而防御保护机体组织和器官。在胎盘滋养层细胞中的
P-gp
可阻止有毒物质进入,使胎盘对有毒物质外排,起到保护作用,从而减少有毒物质对胎儿的损害。然而,在病理状态下,
P-gp
在相应组织中过度表达会导致药物耐药性的产生。因此,
P-gp
与药物相互作用关系着药物临床使用的安全性和有效性,其对药物透过血脑屏障研究、解决肿瘤细胞耐药问题,具有非常重要的临床意义。
2
P-gp
介导的中药
-
化学药的相互作用
中药与化学药联合使用的情况越来越多,中药与化学药之间的相互作用也越来越被关注。随着人们对
P-gp
的研究越来越深入,已有大量研究发现抗肿瘤药物、抗生素、免疫抑制剂、
HIV
蛋白酶抑制剂、钙通道阻滞剂、类固醇激素、抗心律失常药、抗真菌药、消化道用药、抗惊厥药等均可受到
P-gp
的调节,影响其生物利用度。近年来关于中药对
P-gp
影响的报道日渐增多,很多中药及其有效成分对
P-gp
产生抑制或诱导作用,从而对与其联用的化学药产生影响。本文将对
P-gp
有影响的化学药、中药及其有效成分进行综述。
2.1
化学药对
P-gp
的诱导作用
2.1.1
阿司匹林(
Aspirin
)
阿司匹林用于治疗急性心肌梗死、急性缺血性脑卒中、动脉粥样硬化,还可用于预防心血管疾病
[3]
。氯吡格雷是一种抗血小板药物,可用于降低高危患者的心肌梗死和脑卒中风险,与阿司匹林联用抗血小板治疗心肌梗死或
不稳定型心绞痛引起的急性冠状动脉综合征。研究报道氯吡格雷的药动学变化受转运蛋白的影响,是
P-gp
底物之一
[4-5]
。
75 mg
氯吡格雷与每日
1
次
100 mg
阿司匹林合用
2
周和
4
周后,氯吡格雷
AUC
0
~
2 h
几何均值比(
geometric mean ratio
,
GMR
)均为
0.86
,
AUC
0
~
24 h
GMR
分别为
0.83
、
0.82
,峰浓度(
C
max
)
GMR
分别为
0.82
、
0.81
,
P-gp
的
microRNAmiR-27a
增加了
7.67
倍(
P
=
0.004
)。对于阿司匹林与氯吡格雷的药物相互作用(
drug-druginteraction
,
DDI
)机制研究发现阿司匹林诱导
P-gp
表达,促进氯吡格雷的外排,但氯吡格雷及其活性代谢产物的
AUC
无显著差异,相关的血小板抑制作用指数(
RPI
)增加
15%
(
P
=
0.002
),表明氯吡格雷与小剂量阿司匹林合用可降低生物利用度而不降低其疗效
[5]
。此外,阿司匹林能够以时间依赖性和浓度依赖性降低大鼠和人胎盘细胞中罗丹明
123
(
R123
)和钙黄绿素累积,增加
P-gp
活性
[6]
。
2.1.2
卡马西平(
Carbamazepine
)
卡马西平是治疗三叉神经痛的一线药物,还可用于治疗惊厥、神经痛等疾病,但卡马西平有很多副作用,包括恶心、头晕和过敏性皮疹,恰当的剂量是平衡卡马西平疗效与副作用的关键
[7]
。剂量为
10
、
30
、
50
、
100 μmol/L
的卡马西平均可显著降低
RBE4
细胞和
hCMEC/D3
细胞中
R123
的摄入,但相同剂量的卡马西平在
RBE4
细胞中作用效果强于
hCMEC/D3
细胞,对于卡马西平诱导的
DDI
机制研究表明,卡马西平可诱导
P-gp
的表达而增强其外排作用,从而降低
P-gp
底物的摄入
[8]
。此外,给癫痫模型大鼠
ig
卡马西平后,其
P-gp
表达与癫痫模型大鼠
P-gp
表达规律相似,但给药
7 d
后,其
P-gp
表达水平较癫痫模型大鼠更显著,推测在癫痫的治疗中卡马西平诱导
P-gp
表达是其作用机制之一
[9]
。
2.1.3
其他
诱导
P-gp
的其他化学药见表
1
。联合用药时,
P-gp
是许多药物之间产生相互作用的重要原因。某些化学药可以通过抑制
P-gp
与合用的药物产生
DDI
,进而提高疗效或降低毒性,但盲目联用有可能起到相反的作用,因此合理利用
P-gp
介导的
DDI
,是临床合理用药的关键之一。
 化学药对
P-gp
的抑制作用
化学药对
P-gp
的抑制作用
2.2
化学药对
P-gp
的抑制作用
2.2.1
塞来昔布(
celecoxib
)
塞来昔布属于非甾体类抗炎药,是一种选择性环氧合酶
-2
抑制剂,研究发现塞来昔布还具有抗肿瘤活性,能
够抑
制
慢性粒细胞白血病细胞
的生长与增殖,作为抗肿瘤药物的增敏剂用于治疗肾癌和
黑色素瘤
[13]
。剂量为
0.05 μg/mL
阿霉素单用
MCF-7
细胞内
R123
蓄积显著下降(
P
<
0.01
),而与
10 μmol/L
塞来昔布合用后细胞内
R123
蓄积显著增加(
P
<
0.01
),对塞来昔布与阿霉素的
DDI
机制研究表明,阿霉素和塞来昔布合用后,对
P-gp
的表达具有显著的抑制作用;
0.05
、
0.1
、
0.2
、
0.4
、
0.8
、
1.6 μg/mL
阿霉素与
10 μmol/L
塞来昔布合用,抑制
MCF-7
细胞生长的效果显著增加,
IC
50
为(
0.38
±
0.04
)
μg/mL
,与单用相比下降
43%
,推测塞来昔布和阿霉素具有协同作用
[14]
。
2.2.2
洛伐他汀(
lovastatin
)
洛伐他汀是来自真菌的代谢物,广泛用于治疗高胆固醇血症、骨质疏松症、神经退行性疾病、类风湿性关节炎等症,此外还具有抗真菌、抑制癌细胞增殖等作用
[15-16]
。尼卡地平是一种二氢吡啶类钙通道拮抗剂,用于治疗高血压、心肌缺血、冠状动脉血管痉挛和外周血管痉挛,研究报道尼卡地平属于
P-gp
底物,常作为探针用于研究心血管疾病发展风险中交感神经系统活动中钙通道拮抗剂的作用
[17]
。剂量为
1 mg/kg
洛伐他汀与
4 mg/kg
尼卡地平合用后,尼卡地平
C
max
和
AUC
值分别升高
42.9%
、
67.4%
(
P
<
0.05
),对洛
伐他汀与尼卡地平的
DDI
机制研究表明,洛伐他汀能够抑制肠道
P-gp
功能,从而增加尼卡地平的吸收
[17]
。此外,洛伐他汀以剂量依赖性和时间依赖性诱导人卵巢癌细胞
A2780/ADR
凋亡,且与阿霉素合用诱导细胞凋亡增加
10
倍,洛伐他汀能够以剂量依赖性增加阿霉素细胞内累积,抑制阿霉素的外排,对
P-gp
具有显著的抑制作用
[18]
。
2.2.3
其他
肿瘤细胞对抗肿瘤药的多药耐药性是化疗失败的重要原因,而肿瘤多药耐药的主要原因是肿瘤细胞
P-gp
过表达,研究发现某些化学药对
P-gp
具有抑制作用,与
P-gp
底物产生
DDI
,抑制
P-gp
活性,从而逆转抗肿瘤药的多药耐药性。磷脂酰肌醇
3-
激酶抑制剂
ZSTK474
以剂量依赖性的方式抑制
HL60/ADR
细胞增殖,
IC
50
为
23.1 μmol/L
,剂量为
0.1
、
0.5
、
1
、
2 μmol/L
的
ZSTK474
与阿霉素合用后,逆转倍数分别为
1.34
、
5.31
、
29.9
、
30.4
,且
ZSTK474
可剂量依赖性地增加阿霉素和
R123
的细胞内累积,表明
ZSTK474
通过抑制
P-gp
的外排作用进而促进阿霉素逆转多药耐药
[19]
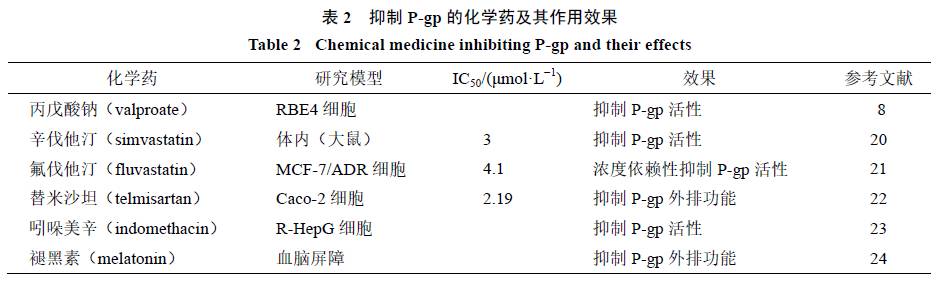
。此外,有研究报道辛伐他汀、氟伐他汀、丙戊酸、替米沙坦、吲哚美辛、褪黑素等药物均能抑制
P-gp
活性和表达,从而增加与其联合使用的口服药物的生物利用度和血药浓度,见表
2
。
2.3
中药及其有效成分对
P-gp
的诱导作用
2.3.1
甘草
Glycyrrhizae Radix
甘草是应用最广泛的中药之一,据统计
60%
的中成药处方中都含有甘草,主要用于减少或缓解方中其他中药的毒性或剧烈药性,也可用于治疗肝炎、肿瘤和心血管系统疾病
[25]
。免疫抑制剂环孢霉素被广泛用于移植患者的抗排异反应中,作为
P-gp
底物的典型代表,由于本身治疗窗狭窄在临床应用中存在多种药物间的相互作用。甘草提取物及其有效组分甘草酸与环孢霉素合用后,甘草提取物组环孢霉素的
C
max
和
AUC
值分别下降
81.3%
、
78.2%
,甘草酸组环孢霉素的
C
max
和
AUC
值分别下降
49.0%
、
45.6%
,对于甘草与环孢霉素的
DDI
机制研究表明,甘草酸、甘草次酸能够增强
P-gp
功能,从而增加环孢霉素的外排
[26]
。此外,颜苗等
[27]
研究发现甘草酸
C-18
位差向异构体的水解产物
18α-
甘草次酸、
18β-
甘草次酸高剂量(
10 μg/mL
)时均对
P-gp
功能表现出一定的诱导作用。甘草黄酮类成分甘草苷、异甘草苷、甘草素、异甘草素、季糖基甘草苷、芹糖基异甘草苷剂量为
10
~
400 μmol/mL
均使
Caco-2
细胞模型上的
P-gp
的表达显著增加(
P
<
0.01
),增强
P-gp
功能
[28]
。
2.3.2
贯叶连翘
Hypericum
perforatum
L.
贯叶连翘又名贯叶金丝桃,是用于治疗抑郁的最普遍中药之一。其主要药理活性成分包括苯并二蒽酮类(金丝桃素和伪金丝桃素)、黄酮类(芦丁、槲皮素、金丝桃苷、异槲皮苷和槲皮苷)、间苯三酚类(贯叶金丝桃素和加贯叶金丝桃素)、异黄酮类(双芹菜素和穗花杉双黄酮),其中金丝桃素是其发挥抗抑郁作用的主要成分
[29]
。贯叶连翘与多种
P-gp
底物如他林洛尔、地高辛联合应用时能够显著降低上述药物的血药浓度,对于贯叶连翘诱导的
DDI
机制研究表明,贯叶连翘可诱导
P-gp
的表达而增强其外排作用,从而降低合用药物的血药浓度
[30-31]
。
30
日龄
C57BL/6J-APP/PS1 (+/−)
雄性小鼠连续饲喂贯叶连
翘提取物(槲皮素质量分数为
5%
)
60
、
120 d
后发现,脑血管内皮细胞中的
P-gp
的表达量显著增加(
P
=
0.000 6
、
0.000 1
)
[32]
。贯叶连翘提取物作为第
2
代抗抑郁药已经用于缓解癌症患者的沮丧情绪,但由于贯叶连翘能够诱导
P-gp
的表达而降低多种抗肿瘤药物如伊马替尔、伊立替康和紫杉醇的体内血药浓度,临床疗效降低,因此在肿瘤患者的抗抑郁治疗中应避免使用贯叶连翘提取物
[33]
。
2.3.3
其他
P-gp
介导多种生理过程,影响药物的吸收、分布、排泄、代谢等过程,改变药物在体内的浓度,从而引起
DDI
,影响药物的药效或毒性。临床研究报道,部分中西药联合使用后出现了疗效降低、毒副作用增加等现象。因此,临床上当与对
P-gp
有诱导作用的中药、中成药与化学药联用时,应该注意避免由于诱导
P-gp
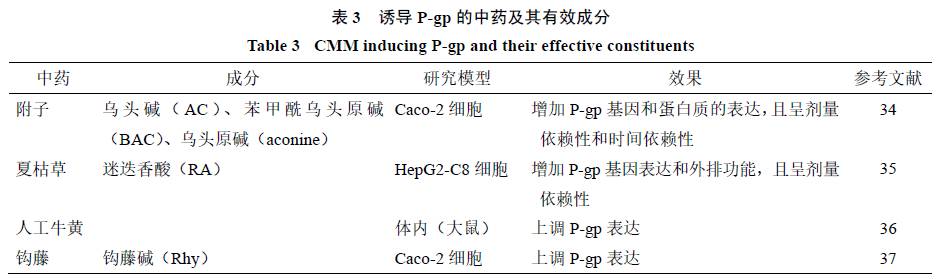
表达致使化学药的疗效降低进而导致治疗的失败,如果确实有必要两药联合使用,应当考虑适当增加化学药的剂量。诱导
P-gp
的其他中药见表
3
。
2.4
中药及其有效成分对
P-gp
的抑制作用
2.4.1
银杏
Ginkgo biloba
L.
银杏叶片剂或银杏叶注射剂临床上常用于治疗心血管疾病及老年痴呆等疾病,临床报道银杏制剂常与其他心血管药物、老年痴呆药物、抗血小板药物、镇静药物、降压和调脂药物联合使用,临床疗效显著提高。其主要活性成分包括黄酮类(槲皮素和山柰酚)、萜类化合物(银杏内酯)
[38-39]
。癫痫是一种常见的神经系统疾病,有研究表明
P-gp
的过度表达可能介导某些抗癫痫药物的外排,因此抑制
P-gp
,可以逆转常见抗癫痫药物的耐药性
[40]
。苯巴妥钠与维拉帕米、银杏叶提取物联合给药后均能够显著降低戊四唑诱导型癫痫大鼠的发病程度(
P
=
0.000 1
),且维拉帕米组发病程度大于银杏叶提取物组(
P
=
0.048
),对于银杏与苯巴妥钠的
DDI
机制研究发现,银杏提取物组和维拉帕米组
P-gp
表达无明显差异(
P
=
0.216
),即银杏叶可抑制
P-gp
的表达,因此银杏叶可能通过减少脑内
P-gp
的表达量而降低癫痫发作的严重程度
[40]
。此外,
Fan
等
[41]
研究发现银杏叶提取物与治疗高血压和冠心病的他林洛尔合用后,银杏叶提取物组他林洛尔的
C
max
、
AUC
0
~
24 h
、
AUC
0
~
∞
值分别增加
36%
、
26%
、
22%
,表明银杏叶提取物能够抑制
P-gp
的表达而增加他林洛尔的血药浓度。
2.4.2
葛根
Puerariae Radix
葛根是用于治疗头痛的传统中药,也可用于治疗发烧和心血管疾病,其主要活性成分为葛根素,葛根素能够促进脑血流量、降低缺血再灌注损伤、减轻脑缺血损伤,临床报道葛根素注射液已广泛用于治疗缺血性脑卒中
[42]
。据报道
P-gp
参与了激素的摄取、代谢和排泄,是影响激素药动学的重要因素,是导致多种激素治疗失败
和预后不良的重要原因之一,因此降低
P-gp
介导的耐药作用可能是提高激素疗效的关键靶点
[43]
。葛根素与激素甲基泼尼松龙联合应用时甲基泼尼松龙对
细胞的
IC
50
由(
272.75
±
38.80
)
μg/mL
降低至(
178.48
±
28.96
)
μg/mL
(
P
<
0.05
),对激素耐药的逆转倍数为
1.55
±
0.30
,对其
DDI
机制研究发现葛根素使淋巴细胞
P-gp
表达由(
9.74
±
2.19
)
%
降低至(
8.10
±
2.53
)
%
(
P
<
0.05
),即葛根素可抑制
P-gp
的表达
[43]
。此外,葛根素能显著下调大鼠体外血脑屏障模型上的
mdrla mRNA
表达(
P
<
0.01
),在一定程度上抑制血脑屏障
P-gp
表达水平,逆转
P-gp
对药物的外排作用,增强其对血脑屏障损伤的保护作用
[44]
。
2.4.3
苦参
Sophora flavescens
Ait.
现代研究证明苦参主要活性成分是生物碱类成分,包括苦参碱和氧化苦参碱。苦参碱可用于治疗心脏疾病、炎症、肿瘤及睡眠障碍等疾病
[45]
。氧化苦参碱高剂量时(
20
或
30 mg/kg
)可显著逆转吗啡的耐药性,其作用效果与
N
-
甲基
-
D
-
天冬氨酸(
NMDA
)受体拮抗剂美金刚胺(
7.5 mg/kg
)作用相当,且氧化苦参碱能增加吗啡的镇痛作用,对
P-gp
功能表现出显著的抑制作用
[46]
。临床研究证明,复方苦参注射液与抗肿瘤药物联合使用,在改善生活质量特别是控制癌痛方面具有明显优势,提高患者生活质量。剂量为
0.5 μg/mL
的奥沙利铂(
Oxaliplatin
,
OXA
)和
3.0 μg/mL
苦参碱联合应用对结肠癌耐药细胞
HT-29/OXA
的增殖具有显著的抑制作用,且能够通过改变细胞周期从而诱导肿瘤细胞凋亡(
P
<
0.05
),即有效逆转
HT-29/OXA
细胞对
OXA
的耐药性,对于苦参碱与
OXA
的
DDI
机制研究发现,联合用药后
P-gp mRNA
表达水平均显著降低(
P
<
0.01
),下调
P-gp
蛋白表达(
P
<
0.01
),增加
OXA
在
HT-29/OXA
细胞中蓄积水平,从而发挥对人结肠癌细胞株
HT-29/OXA
耐药性的逆转作用
[47]
。
2.4.4
其他
近年来,研究发现某些中药或中药的有效成分对
P-gp
具有抑制作用,与
P-gp
底物产生
DDI
,即通过抑制
P-gp
活性,减少
P-gp
底物的外排,进而使其生物利用度增加,从而增强药物的治疗作用,逆转抗肿瘤药的多药耐药性。
Sipholane
三萜类化合物在
KB-C2
细胞和
KB-V1
细胞中剂量依赖性降低秋水仙碱、长春新碱和紫杉醇
IC
50
值,时间和剂量依赖性增加阿霉素在
R-HepG2
细胞内累积,对
P-gp
具有显著的抑制作用,且抑制效果近似于维拉帕米,推测
sipholane
三萜类化合物是肿瘤药耐药性的潜在逆转剂
[48]
。栀子苷是栀子的主要活性成分,剂量为
25
、
50
、
100 μmol/L
的栀子苷与阿霉素合用后,栀子苷对
MG63/DOX
细胞的
IC
50
分别为(
4.527
±
0.003
)、(
1.475
±
0.003
)、(
0.640
±
0.004
)
μmol/L
,逆转倍数分别达到
4.48
、
13.76
、
31.7
,且栀子苷能显著增加阿霉素和
R123
的细胞内累积量,表明栀子苷通过抑制
P-gp
的外排作用进而促进阿霉素逆转多药耐药
[49]
。有研究报道直立百部非生物碱成分分别与阿霉素、紫杉醇和长春新碱合用后,对
MCF-7/ADR
细胞株的
IC
50
分别为(
47.30
±
0.12
)、(
5.43
±
0.05
)、(
12.40
±
0.12
)
μmol/L
,且显著抑制
P-gp
表达,对阿霉素、紫杉醇和长春新碱
3
种抗肿瘤药耐药性具有逆转作用
[50]
。中药泽泻的有效成分
24-
乙酰泽泻醇(
alisol F 24-acetate
,
ALI
)以时间依赖性和浓度依赖性诱导
MCF-7/DOX
细胞凋亡、浓度依赖性增加阿霉素细胞内的累积量,降低
Caco-2
细胞内阿霉素的外排,即
ALI
有效逆转
MCF-7/DOX
细胞对阿霉素的耐药性,且对
P-gp
具有显著的抑制作用
[51]
。姜黄的主要活性成分为姜黄素,剂量为
30 μmol/L
的姜黄素在
MNNG/HOS/MTX
细胞系中对甲氨蝶呤、顺铂、阿霉素、异环磷酰胺、表柔比星的
IC
50
分别为(
12.38
±
2.27
)、(
10.14
±
2.02
)、(
8.47
±
1.31
)、(
4.90
±
1.03
)、(
7.91
±
1.65
)
μg/mL
,且姜黄素能抑制
P-gp
的表达和功能,抑制
MNNG/HOS/MTX
细胞增殖,逆转甲氨蝶呤、顺铂、阿霉素、异环磷酰胺、表柔比星耐药性
[52]
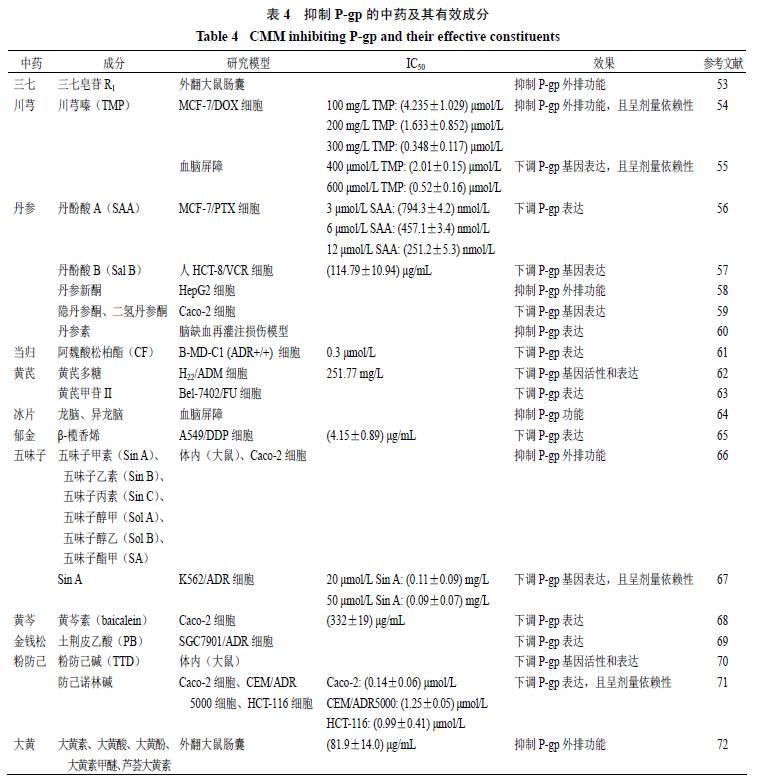
。除此之外,有研究报道三七、川芎、丹参、当归、黄芪、冰片、郁金、五味子、黄芩、金钱松、粉防己、大黄等中药的有效成分均能抑制
P-gp
活性和表达,从而增加与其联合使用的口服药物的生物利用度和血药浓度,见表
4
。
3
结语与展望
本文综述了
P-gp
介导的中药
-
化学药之间相互作用。根据已有的研究结果显示,很多中西药对
P-gp
均具有不同程度的影响,具体可表现为诱导或者抑制作用。
P-gp
被抑制或诱导均可影响药物的生物利用度、肾脑内药物的摄取、肝脏和胆汁的清除等,因此,当对
P-gp
有诱导或抑制作用的药物与
P-gp
底物药联合应用时,应注意可能产生的
P-gp
介导的中药
-
化学药相互作用。一方面,中西药联合
应用对
P-gp
的抑制作用,可增加
P-gp
底物药的疗
效,如与某些化疗药物合用时,可抑制肿瘤细胞对
化疗药物的外排,从而增加化疗药物的细胞内累积量,提高化疗药物疗效,对逆转肿瘤细胞耐药性具有极其重要临床意义。另一方面,对于某些治疗窗较窄的
P-gp
底物药,如强心药地高辛、化疗药物甲氨蝶呤、免疫抑制剂环孢素、抗癫痫药苯妥英等,中西药联合应用对
P-gp
的抑制作用,可使药物的体内蓄积量过高以致产生不良反应。因此,有必要加强
P-gp
介导的中药
-
化学物之间相互作用的研究,充分利用二者间的相互作用,达到增效减毒的效果,同时丰富科研资料,为临床联合用药提供参考。
参考文献(略)
来 源:杨珅珅,刘安丽,周 倩,单兰兰,范思邈,李遇伯. P-糖蛋白介导的中药-化学药相互作用研究进展 [J]. 中草药, 2017, 48(15):3189-3197.







