我国自2006 年起对疫苗和血液制品全面实施批签发制度。目前,我国纳入批签发管理的生物制品包括全部疫苗类制品、国产血液制品和进口人血白蛋白、血源筛查用体外诊断试剂(简称“血筛试剂”)。2016 年,经CFDA研判,决定对乙肝/丙肝/艾滋核酸检测血筛试剂实施批签发管理。
7月4日,CFDA官网发布了中国食品药品检定研究院编写的《2016年生物制品批签发年报》。这份报告也是了解国内疫苗、血液制品市场需求和供应情况的最权威的数据来源(
微信发送消息“2016批签发”,可获得下载链接
),今天就摘选部分数据和大家分享一下。
2016 年,在CFDA的领导下,中检院和7家授
权承担生物制品批签发的省级药品检验机构(北京、上海、广东、四川、湖北、甘肃和吉林)共同推进批签发工作。
2016 年,签发疫苗3949 批、约计
6.46 亿
人份;血液制品4025 批,约计
5927.80 万
瓶;
血筛试剂836 批,约计8.78 亿人份。目前,实施批签发的疫苗和血筛试剂以国产制品为主,
进口制品少于5%。血液制品因原料血浆不足,人血白蛋白临床供给存在50%以上缺口,依靠进口人血白蛋白补充。批签发制品的生产规范性较好、质量稳定可控,近年来不合格制品少,2016 年仅有1 批国产疫苗和2 批进口人血白蛋白不符合规定。
2016 年,疫苗签发51 个品种、共3950 批次,其中3949 批符合规定、1 批不符合规定(不合格率为0.25‰)。
拒签的1 批疫苗(210048 人份)为长春长生生物科技股份有限公司生产的吸附无细胞百白破联合疫苗
,不合格项目为无细胞百日咳疫苗效价测定。
分析2010 -2016 年的疫苗批签发数据可以发现,1)疫苗品
种稳定,历年疫苗品种数维持在50 种左右。2}批签发批次呈下降趋势。2010-2013 年每年5000 批左右,近3年每年4000 批左右。与2015 年比较,2016 年虽总批次略
有下降,但总体签发量并未减少,约计6.46 亿人份。
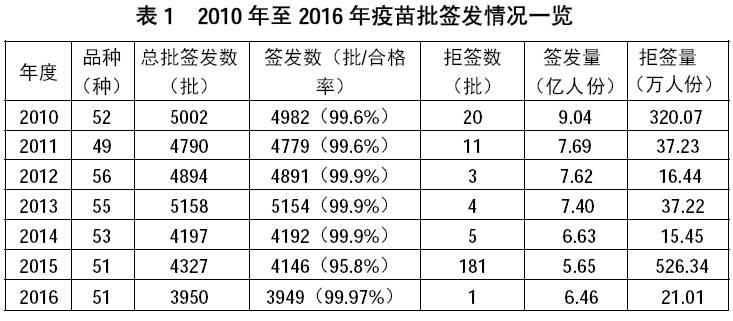
从疫苗来源来看,国产疫苗支撑了国家免疫规划的实施。2016 年,申请疫苗批签发的国内企业33 家。签发国产疫苗3808 批、计6.31 亿人份;进口疫苗141 批、计0.15 亿人份。历年进口疫苗量仅占上市疫苗的5%以下,近两年所占比例又有所减低,仅占上市疫苗的2.1-2.3%。
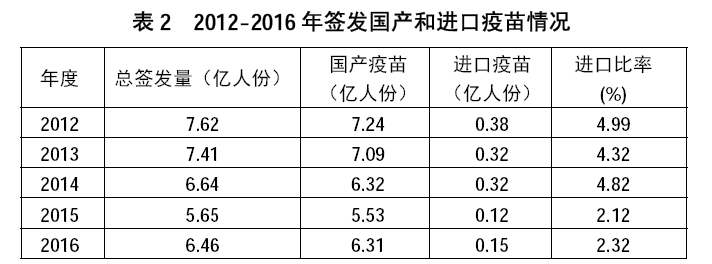
国有疫苗生产企业是一类疫苗的供应主体,民营企业主要供应二类疫苗。
2016 年签发上市的一类疫苗共2150 批,近5.12 亿人份,占上市疫苗的79.3%,其中国有企业生产的一类疫苗所占比例为90.3%。二类疫苗1799 批、1.34 亿人份。二类疫苗中,国产疫苗1658 批、计1.19 亿人份(88.7%);进口疫苗141 批、0.15 亿人份(11.3%)。
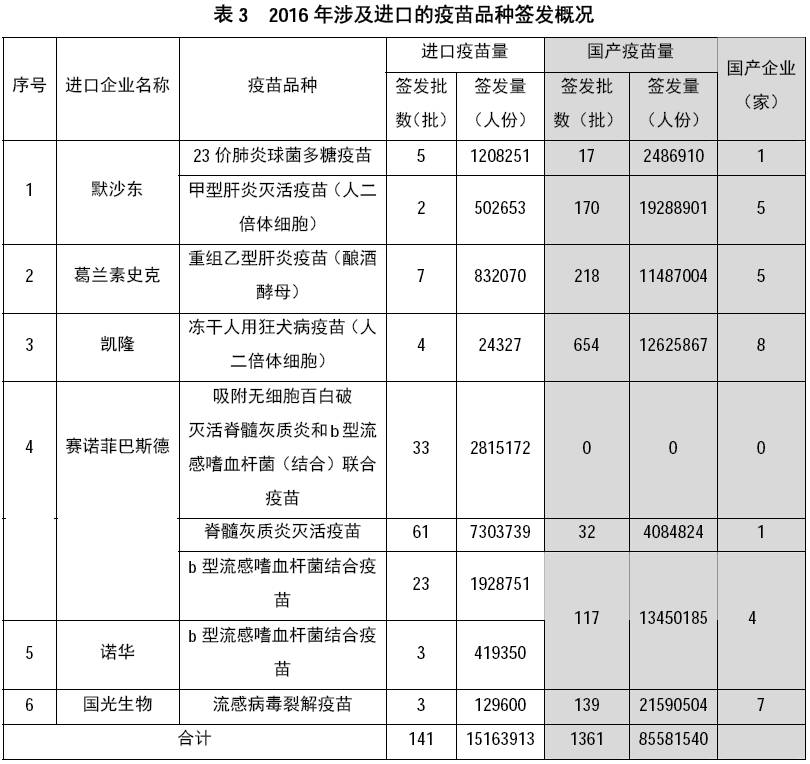
上述进口疫苗情况提示:我国
脊髓
灰质炎灭活疫苗
产能尚需提升,加强对联合疫苗的研发生产是疫苗产业的发展方向之一。
2016 年,全国共签发血液制品12 个品种,4025 批次计5927.8020 万瓶。其中
2 批不合格制品为奥地利Baxter AG 生产的人血白蛋白
,不合格项目为可见异物。
2016 年共39 家血液制品生产企业申报批签发,包括国内企业27 家和境外企业12 家。
目前,共有28 家国内血液制品企业,除新疆德源生物工程有限公司因未取得GMP 证书而未签发产品外,其它27 家血液制品生产企业均有产品签发。
2016 年共签发国产血液制品2564 批,计3878.8277 万瓶,其中,人血白蛋白1187 批计1593.5542 万瓶(按10 克/瓶折算)。签发进口血液制品均为人血白蛋白,共1457 批计2048.9743 万瓶(按10 克/瓶折算)。国产人血白蛋白与进口人血白蛋白比例分别为43.75%和56.25%,与2015 年相比基本持平。
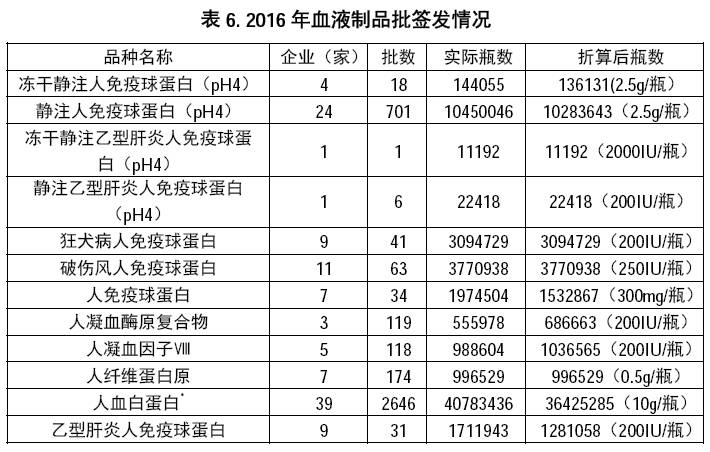
2016 年28 家国产血液制品生产企业,共有血浆站218 个,
全年投浆约6212 吨,远不能满足国内临床的需要,差额约8000 吨血浆















