
脊柱区域,包括椎骨、脊髓神经和脊髓管内的脊髓,对于个体的生存至关重要,因为它在身体运动和功能控制、感觉报告、反射管理和机械支持方面发挥着重要作用。脊柱的神经损伤会导致身体疼痛、无力甚至瘫痪,还可能伴有泌尿生殖系统、皮肤和呼吸问题。然而,目前的治疗方法在恢复脊髓损伤(SCI)导致的功能丧失方面的能力有限,无法达到使患者独立生活的程度。因此,迫切需要开发旨在恢复神经连接的创新疗法。腰椎穿刺是一种常见的医疗程序,通过将针插入下背部来收集脑脊液(CSF),用于诊断或治疗目的。通常在脊柱的腰椎区域进行,即第三和第四或第四和第五腰椎之间, 因为只有这部分有足够的空间进行穿刺,而不会损伤脊髓的重要结构。然而,由于脊柱跨度大(约60-70厘米)以及脑脊液空间狭窄且复杂,使得有效载荷向脊柱深处的被动扩散效率很低。例如,间充质干细胞可以通过腰椎穿刺注入脊柱;但由于脊柱长度较长,大量细胞可能被蛛网膜吸收。这大大阻碍了它们的迁移,因此需要使用更大剂量才能实现有效的鞘内注射。
来自深圳大学的王奔团队
展示了一种专为在脊髓复杂且脆弱的环境中进行靶向递送而设计的干细胞组装微机器人。传统的治疗脊髓神经障碍和损伤的方法,常常因治疗药物被动扩散效率低下而受限,这主要是由于脊髓管空间的广泛分布和复杂结构所致。本文的微机器人通过三维自组装过程制造而成,克服了这些限制,能够精确、微创地将干细胞递送至脊髓内的靶向部位。这些微机器人由外部磁场控制,并通过X射线成像进行追踪,不仅能在复杂的脊髓管环境中导航,还能释放可分化为类神经元细胞的干细胞,从而显著改善下肢瘫痪患者的功能恢复。相关工作以题为“
Long-span delivery of differentiable hybrid robots for restoration of neural connections”
的文章发表在2025年01月13日的期刊
《Matter》
。

1.创新型研究内容
本文开发了可分化的干细胞组装软机器人(SCASRs),它们在磁场驱动的干细胞治疗恢复神经连接方面显示出潜在的影响(图1)。这些微机器人是通过在液体弹珠(LMs)中使用掺杂了磁粒的干细胞的三维(3D)自组装过程制造的。本文发现,使用LMs制造的SCASRs比使用非粘性板的传统的3D培养方法具有更高的细胞活性,这可能是由于LMs的高透气性。从LMs生成的SCASRs的大小可以在从微米到亚毫米的范围广泛控制。制备的SCASRs显示出高度紧凑的细胞间交叉接触,并在体外形成组织,使机器人高度柔软、生物相容和可生物降解。更重要的是,SCASRs中的细胞表现出显著高于传统培养方法的细胞活性。SCASRs还可以分化为神经细胞。当SCASRs被驱动到目标位点时,可以实现干细胞的自发释放。得益于X射线成像工具和驱动系统的协同作用,通过磁场远程驱动和递送SCASRs在体内得到了高精度X射线跟踪的证明。重要的是,SCASRs的精确递送和积累促进了脊髓内神经连接的异常恢复,这已通过大鼠快速肢体瘫痪修复和相关的基因组学验证得到系统验证。所提出的策略提供了一种基于完整临床成像技术的治疗和干预系统,用于恢复神经连接,该系统能够进入迄今为止难以到达的脊髓管区域,并通过软微机器人以微创方式进行高效治疗。
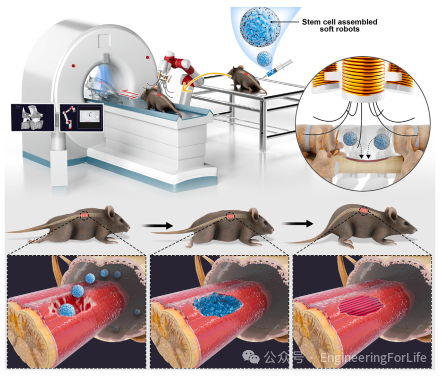
图1 在磁驱动单元和X射线成像单元的联合系统下,SCASRs的鞘内递送过程
【磁性SCASRs设计】
SCASRs 的制备是通过在含有干细胞和生物相容性聚多巴胺包覆的磁性铁颗粒的微液滴(LMs)中进行共培养来实现的,如图 2A-2C 所示。LMs 是通过在疏水二氧化硅纳米颗粒床之上滚动含有干细胞和磁性颗粒的介质微滴而形成的。受益于磁性颗粒上生物相容性的聚多巴胺外壳,干细胞和磁性颗粒通过一个简单的共培养过程自发地整合形成一个具有球形的生物混合微机器人,正如扫描电子显微镜(SEM)图像在图 2D 和 2E 中所显示的那样。SCASRs 内的细胞具有大约为 0 的磁饱和值。含有磁性颗粒的 SCASRs 表现出磁饱和值的大幅增加。在冷冻干燥后,使用振动样品磁力计测量这些 SCASRs 的磁饱和强度,达到大约 139.5 emu/g。单个 500-μm SCASR 的磁化强度被测量为 0.8 emu。SCASRs 的储能模量从大约 0.5 到 2.2 kPa 不等。这个范围与人类软组织的范围相当。由于成分原子序数的差异,微计算机断层扫描(micro-CT)可以清楚地观察到 SCASRs 内磁性颗粒的分布情况。如图 2F 所示,磁性颗粒在 SCASRs 内均匀分布。这种均匀分布表明 SCASRs 表现出各向同性的特性,这对于确保可靠和有效的磁性控制性能至关重要。在对典型 SCASR 进行切割处理后,可以观察到所制备的 SCASRs 显示出高度紧密的细胞间交叉接触,并且有很多纤维状的连环蛋白将细胞连接在一起,如图2E所示。连环蛋白在细胞-细胞粘附中起着关键作用,它通过其细胞外结构域与相邻细胞上的钙粘蛋白分子相互作用,形成稳定的细胞间连接(图 2G)。该制备过程没有涉及任何昂贵的洁净室仪器或复杂的程序。SCASRs 的构建单元是干细胞,这使得机器人具有高度的生物相容性和可生物降解性。图 2H 展示了 SCASR 从在 LM 中的离散干细胞和磁性颗粒演变而来的过程。得益于 LM 的球形结构和外部的疏水二氧化硅纳米颗粒,微升细胞容器可以通过使用各种不同的物种(如小鼠、大鼠和人类)来生成 SCASRs(图 2I)。
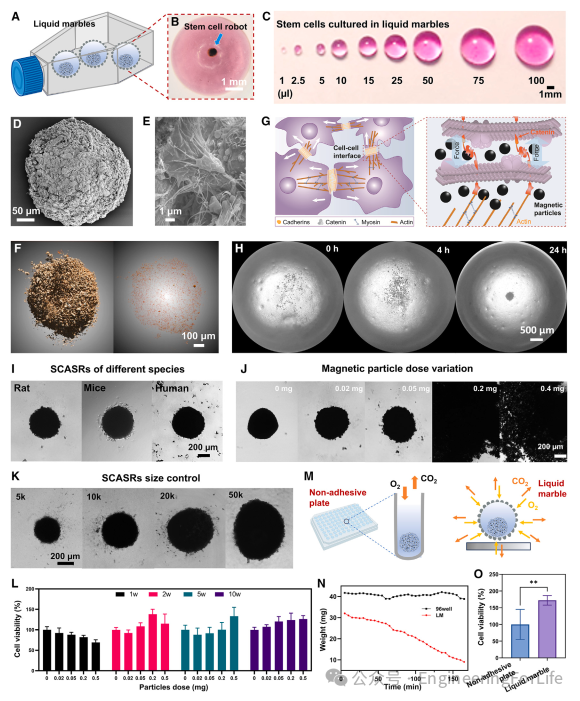
图2 SCASRs的制备、表征和细胞活力评估
【SCASRs 的运动控制】
为实现对SCASRs的远程靶向治疗,本文对其输送和释放机制进行了全面研究,如图3A-3F所示。输送过程依赖于磁推进机制,并通过医学成像的实时反馈进行精确控制。如图3A-3C所示,在不同介质(血液、PBS和人工CSF)中,SCASRs的平移速度随磁场强度的增加而显著提高(在固定频率11 Hz下)。当磁场达到某一特定强度时,这些微机器人的速度变得稳定,不再随磁场强度的增加而变化。这一观察结果表明,在一定范围内,增强磁场强度可以有效提高微机器人在液体介质中的移动性,从而增强其在生物医学应用中的实用性和适应性。此外,如图3C所示,结果表明在同一介质中,SCASRs的平移速度随外部磁场频率的增加而增加,达到峰值后,其运动速度随频率的进一步增加而开始下降(磁场强度为15 mT)。与血液和人工CSF相比,这些微机器人在PBS中的最大速度达到了每秒0.75毫米。
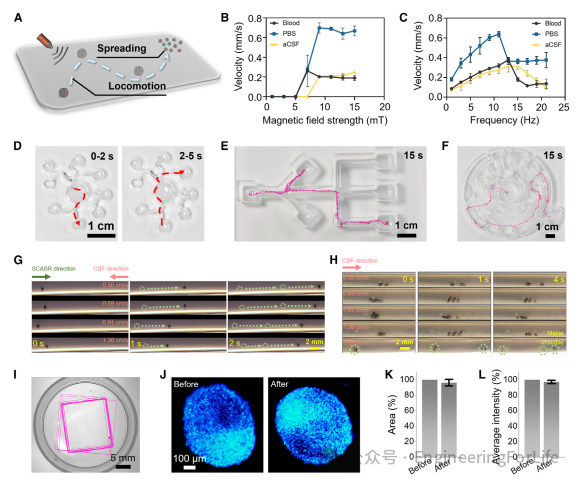
图3 SCASRs的运动控制
【SCASRs 的 X 射线成像和跟踪】
为了研究在体内精确治疗神经损伤过程中磁性干细胞球形自组装机器人(SCASRs)的位置跟踪能力,本文使用了 X 射线成像技术来验证这些微机器人在体外猪脊柱模型内磁性引导运动时的跟踪能力。SCASRs 在 X 射线成像下的可见度受到它们的数量、聚集状态和磁性颗粒浓度的显著影响。图 4A-4D 展示了使用 X 射线计算机断层扫描(CT)进行的成像;SCASR 数量、颗粒剂量和 CT 成像对比度之间存在直接相关性。较高的颗粒剂量和 SCASR 数量由于铁相对于周围组织的较高原子序数而增强了成像对比度。还评估了不同颗粒剂量的 SCASRs 在猪脊柱中的对比度。图 4E 表明,含有 100-300 μg 磁性颗粒的 SCASRs 在猪脊柱内可以清晰地看到并可追踪。这些发现证实了即使在矿物质密集的脊柱区域,也可以使用 CT 以高空间分辨率有效地可视化微机器人。
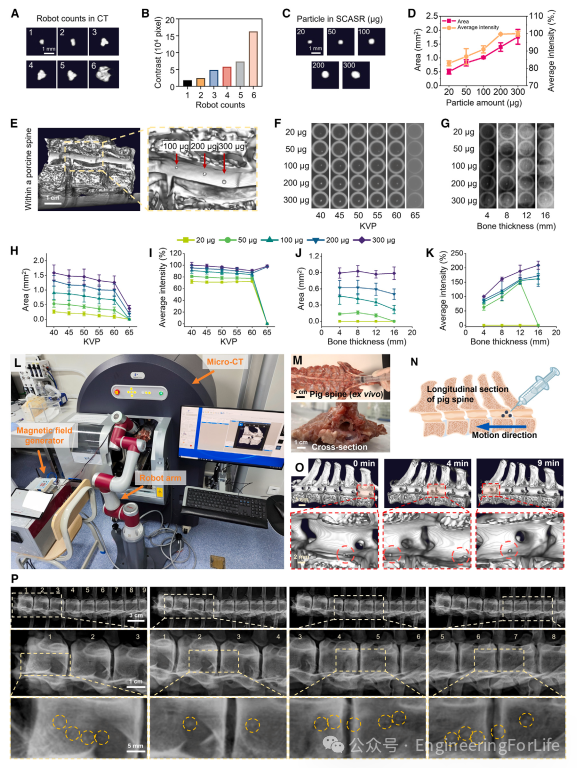
图4 SCASRs的成像和追踪
本文使用了人骨髓间充质干细胞(hBMSCs)和人源性类神经细胞系 SH-SY5Y 来研究 BMSCs 的旁分泌效应。hBMSCs 产生的条件培养基(CM)增强了 SH-SY5Y 的粘附、增殖、迁移以及神经发生分化(图 5A-5G),这充分证明了干细胞对类神经元细胞的积极旁分泌效应。在接种细胞 24 小时后,观察到 SH-SY5Y 对照组中有弱附着的圆形细胞,而 CM 加速了细胞与基底的粘附,呈现出多边形和更大的细胞形态(图 5A)。在接种细胞三天后,CM 组的光学图像中显示出明显更多的增殖细胞,通过细胞活力检测证实了这一点,与对照组相比,细胞活力增加了约 40%(图 5B)。为了评估 CM 对 SH-SY5Y 细胞迁移的影响,进行了为期 7 天的体外划痕伤口愈合实验,如图 5C 所示,图 5D 进行了统计分析。CM 处理后 SH-SY5Y 细胞迁移的增加导致伤口愈合率与正常培养基处理相比显著加快。然后,hBMSCs 以间接方式(SH-SY5Y CM 组)或直接方式(SH-SY5Y MSC 组)与 SH-SY5Y 细胞共培养,以功能上评估神经突生长。分别使用肌动蛋白和微管蛋白的免疫荧光染色来观察所有细胞和神经突,以便估算神经突的长度和数量(图 5E)。与对照组相比,CM 已经显著促进了神经突的形成。当 SH-SY5Y 细胞与 hBMSCs 直接共培养时,观察到并计算了最多的神经突分支数量和延伸长度(图 5F 和 5G)。
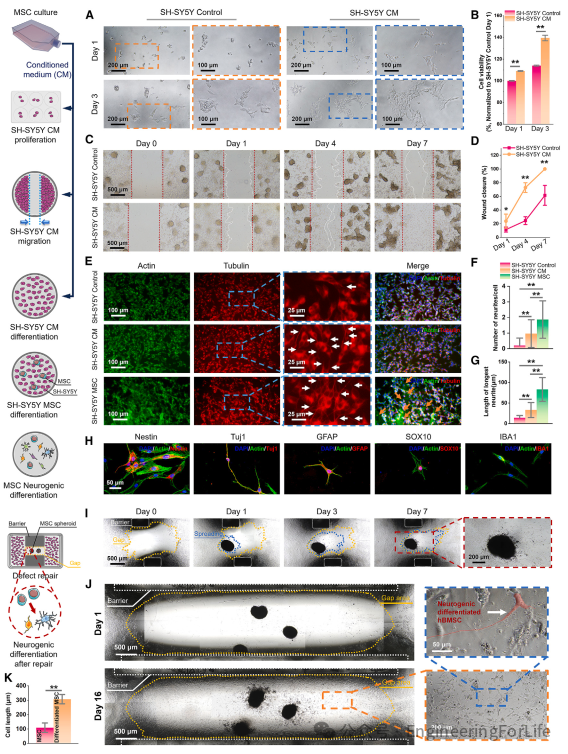
图5 用于神经修复的hBMSCs和SCASRs的体外表征
【用SCASRs进行体内脊髓神经连接的修复】
本文使用气动动力和电子控制的精确冲击器来建立大鼠创伤性脊髓损伤(SCI)模型(图6A)。为了评估损伤后的功能恢复情况,首先在手术后3周评估了足趾伸展评分。SCASRs组的足趾伸展功能得到增强,足趾几乎完全外展,而SCI组和MSC组则表现出严重的收缩,与SCASRs组的3.83 ± 0.41相比,其评分分别为1.00 ± 0.89和1.83 ± 1.17,显著较低(图6C)。随后进行了行为测试,以评估MSC和SCASRs对创伤性SCI恢复的影响(图6D-6H)。大鼠的足迹显示,手术后1周,所有组均未显示出功能恢复(图6F)。手术后2周及以后,与其他组相比,SCASRs组显示出显著且渐进的行为改善。手术后3周,在定量分析中观察到,与另外两组相比,接受SCASRs治疗的大鼠步幅宽度和长度显著增加(图6E)。与足迹分析结果相似,为期3周的Basso、Beattie和Bresnahan(BBB)评分评估也表明,SCASRs治疗增强了后肢力量的恢复,并增加了损伤后的爬行能力(图6G和6H)。手术后2周,SCASRs组的大鼠显示出足底踏步和肢体协调,BBB评分为13.00 ± 2.19,而SCI组和MSC组分别观察到无后肢运动(0.67 ± 0.52)和轻微的关节运动(1.00 ± 0.00)。在体内评估的终点时,只有SCASRs组的大鼠行走时没有躯干不稳定,显示出了优越的运动功能恢复。
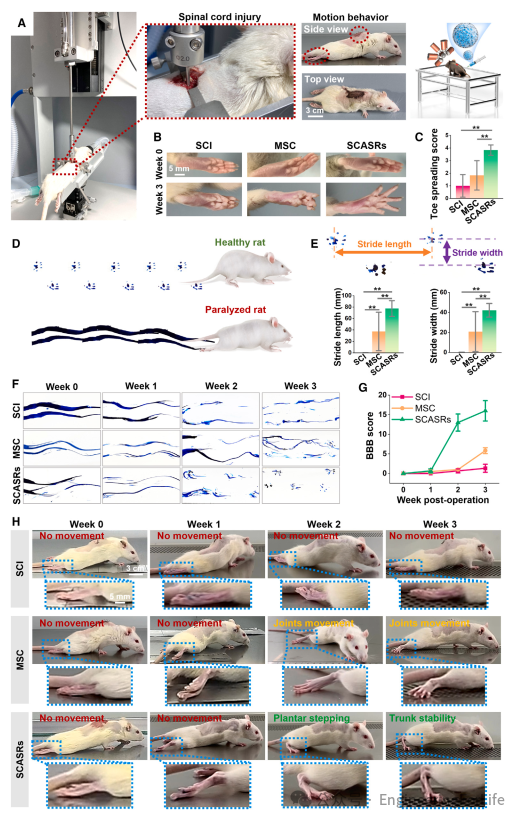
图6 使用SCASRs进行的体内SCI治疗
行为研究后,牺牲大鼠以获取脊髓组织。组织学和转录组分析用于进一步研究神经损伤的治疗效果及其潜在机制(图7)。通过组织学观察五种主要器官来评估SCASRs的生物安全性。对心脏、肝脏、脾脏、肺和肾脏组织的苏木精和伊红(H&E)染色显示,SCASRs没有导致主要器官损伤和异常,表明软机器人在体内的生物安全性和生物相容性。在第三周评估了MSC和SCASRs的修复效果,以揭示运动功能恢复的组织基础。从纵向全视图来看,SCI组中观察到双侧组织从损伤部位的尾侧和嘴侧丢失(图7B、7C)。在SCI脊髓的损伤部位和尾侧区域,观察到囊肿、纤维化以及神经元死亡。LFB染色组织还显示,SCASR植入增加了髓鞘,保护了神经元,并减少了病变腔。与SCI(2.92 ± 0.40 mm²)和MSC(2.70 ± 0.80 mm²)组相比,SCASRs组的病变面积显著更小(1.27 ± 0.40 mm²)(图7C)。S100β阳性星形胶质细胞和神经丝蛋白(NF)的相关分布,即胶质瘢痕和神经元细胞骨架的指标,可能揭示了神经再生的程度。免疫荧光染色(图7D)和定量分析(图7E-7G)显示,SCI组在损伤部位有严重的神经炎症、胶质瘢痕形成和几乎无神经元再生,其S100β、NF和巢蛋白阳性区域分别为14.78 ± 2.35%、1.51 ± 0.61%和2.91 ± 1.23%。尽管MSC组的NF阳性面积与SCI组相似,但其S100β阳性面积显著较低(10.98 ± 1.74%),且巢蛋白面积较高(5.00 ± 1.73%)。经过SCASR治疗后,与SCI和MSC组相比,S100β、NF和巢蛋白的密度比显著逆转。由SCASRs修复的组织表现出较少的星形胶质细胞,这些细胞分布更为规律,同时在各个节段中有更大的NF和巢蛋白区域。这一结果表明,软机器人抑制了损伤部位的胶质瘢痕形成,并有效促进了神经纤维再生。

图7 SCASRs涉及神经发生的组织学和定量转录组学分析
2.总结与展望
腰穿是一种将药物输送到脑脊液(CSF)中的微创技术。然而,其有效性受到脊柱长度过长以及狭窄复杂的CSF空间的限制,这些因素阻碍了治疗药物的高效被动扩散。在这里,本文通过在液体弹珠中采用三维自组装过程,设计了一种可分化的干细胞组装软机器人(SCASR)。这些具有生物相容性的机器人能够与CSF内的组织相互作用,在导航时适应复杂的环境。借助X射线成像和磁性驱动,SCASR可以被引导至目标区域。SCASR能够自主分解成单个细胞,这些细胞随后分化为神经细胞,以促进神经连接的恢复,从而帮助瘫痪下肢的恢复。所提出的策略为神经损伤提供了一种基于成像的治疗系统,使得难以到达的脊髓区域变得可及,并通过软微机器人以微创方式实现高效治疗。
参考资料:
https://doi.org/10.1016/j.matt.2024.101942
来源:
EngineeringForLife
声明:仅代表作者个人观点,用于研究用途,作者水平有限,如有不科学之处,请在下方留言指正!






