FDA公布kite公司的CAR-T疗法
无需再经过专家委员会评审

2017年8月9日,鉴于刚刚完成对Kite Pharma公司的CAR-T疗法axicabtageneciloleucel(axi-cel,KTE-C19)的制造基地以及治疗中心的严格审查,FDA表示其公司的重磅CAR-T疗法不需要再经过专家委员会评审了。
显然,FDA对Kite公司的这款疗法并没有不满意的地方。另外,监管机构的此番信赖有望让axi-cel提前获批上市,或许并不比诺华的CTL019要晚,同时也并非不可能!
基于此,Kite公司的高层领导也表示他们已经为axi-cel提前上市做好了充分的准备,其CAR-T疗法的制造与物流管理工作在9月份将完全准备好,随时待命。一旦获批上市,将以最快的速度将其CAR-T疗法带给患者。业内的分析师也都纷纷看好,9日该公司的股价也上涨了7%。
靶向Claudin18.2的CAR-T细胞疗法
针对晚期胃腺癌和胰腺癌真正进行一期临床试验
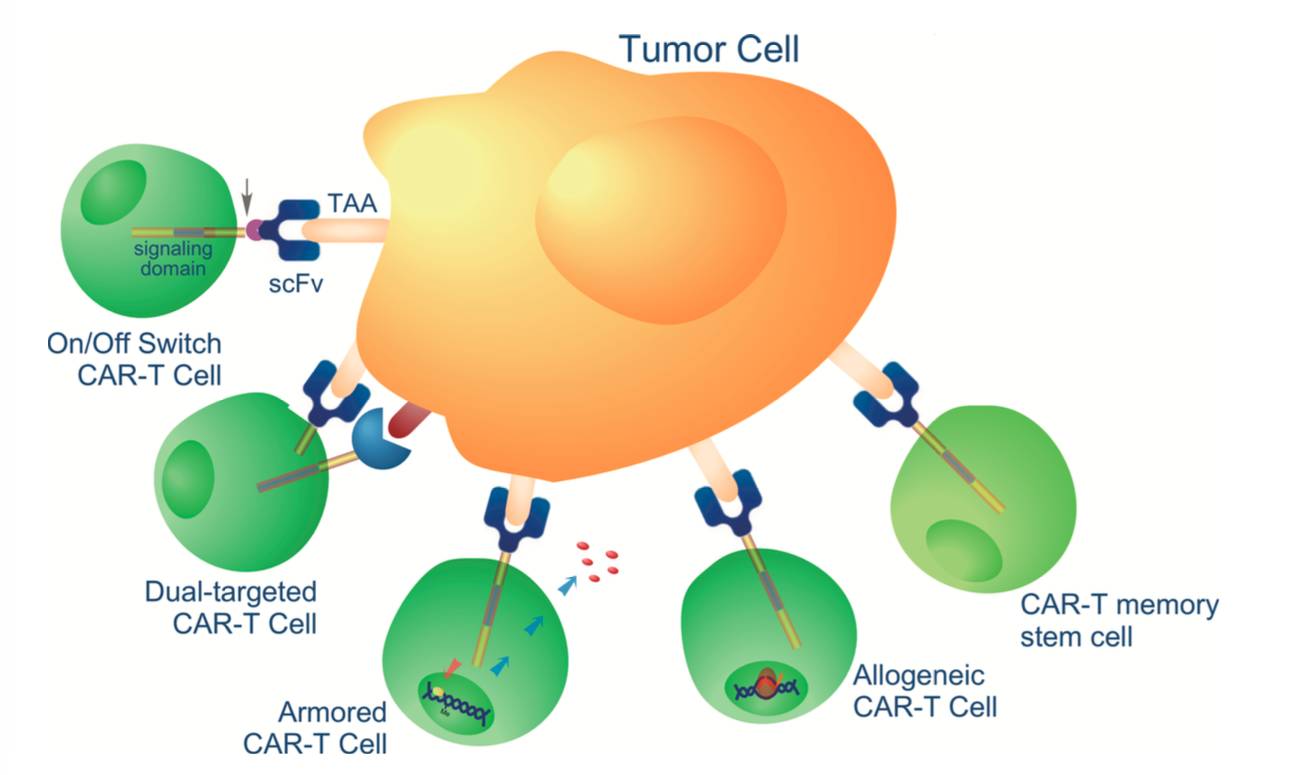
2017年8月10日,上海长海医院肿瘤科针对晚期胃腺癌和胰腺癌的一项靶向Claudin18.2的CAR-T细胞疗法临床试验正在进行临床招募(NCT03159819)。所使用的CAR-T疗法正是科济公司成功研发的CAR-Claudin18.2 T细胞疗法(CAR-CLD18 T)。
在胃癌患者中,Claudin18.2只表达于分化型胃壁细胞,在正常组织中无表达。而且最新研究表明,Claudin 18.2在77%以上的胃癌患者以及80%以上的胰腺癌患者中都过表达,此外还在肺癌,食管癌以及卵巢癌等实体瘤中过表达。
该研究是一项单臂、开放标签的临床试验,旨在确定CAR-CLD18 T细胞疗法治疗晚期胃腺癌和胰腺癌患者的安全性以及耐受性。临床研究由王斌博士主导,在上海长海医院进行。
使用iPSC为来源的通用型CAR-T细胞有望解决
自体T细胞疗法难以广泛应用的难题

研究人员对细胞重新编程(图片来源:well.ox.ac.uk)
2017年8月11日,CARIPSCTCELLS项目已经开发出了用于治疗多发性骨髓瘤(MM)的即用型CAR-T疗法(off the shelf),这种CAR-T细胞能够安全的在体外无限制的生产,对于患者具有广泛的适用性。
目前,CARIPSCTCELLS(生成安全有效的、即用型的CAR- T细胞)项目已经开发出了用于治疗MM的即用型CAR-T疗法(off the shelf),这种CAR-T细胞能够安全的在体外无限制的生产,并且具有广泛的适用性。Maria Themeli博士为该项目的协调员,VU University Medical Center的Tuna Mutis博士作为该项目的领导者。
然后通过CRISPR/ Cas9技术靶向敲除诱导多能干细胞来源的T细胞(T-iPSC)上的HLA抗原,最后利用基因工程技术给T-iPSC细胞加入一个能识别肿瘤细胞,并且同时激活T-iPSC细胞杀死肿瘤细胞的嵌合抗体CAR,使其成为具有癌症抗原特异性的CAR-T-iPSC细胞,而这种CAR-T-iPSC疗法就具有off the shelf的普遍适用性。
基于该技术,研究人员正在进一步研究新型干细胞的基因工程策略,以获得可以治疗多发性骨髓瘤(MM)的广泛适用的CAR-T细胞。研究人员设计了靶向CD38的CAR结构(CD38CAR),但由于CD38不是MM的特异性靶标,所以研究人员通过引入调节CD38-CAR表达的药物来解决on-target/off-tumor毒性。

2017年8月12日,临床和经济审查研究所(ICER)发布了一项用于治疗B细胞恶性肿瘤的CAR-T疗法的范围界定文件草案(Draft Scoping Document)。截止到(美)东部时间2017年8月29日下午5点之前,ICER将进行为期三周的公开征询公众意见。
在此次的临床效益评估中,对于治疗发性或难治性B细胞急性淋巴细胞白血病,CAR-T疗法将与NCCN(National Comprehensive Cancer Network)指南推荐的clofarabine、基于酪氨酸激酶抑制剂的化疗或blinatumomab相比较。对于B细胞非霍奇金氏淋巴瘤,CAR-T疗法将与挽救性化疗或NCCN指南推荐二线治疗药物(gemcitabine、dexamethasone、cisplatin)进行比较,最主要的评估结果是总体生存率(OS)。
ICER将与患者、临床医生、药物制造商以及其他利益相关者共同探讨,从临床试验中获得更多可用的证据以评估得出适合的结果。
除此之外,ICER鼓励所有利益相关方提交不同意见,对此项草案提出改进范围,以确保ICER能够充分考虑所有观点。在公众意见征询期过后,ICER将于2017年9月7日左右公布修订后的范围界定文件。
在2018年3月的公开会议上,CTAF小组将对报告中提出的关键问题进行投票,患者代表、临床专家、药物制造商和付款人的政策圆桌会议将讨论如何最佳地将评估结果应用于政策和实践方面。审查小组也将根据医学证据为临床实践和付款人政策决定(payer policy decisions)提供客观、独立的指导建议。
(注:加州技术评估论坛CTAF,是临床和经济审查研究所的一项核心项目 (ICER),通过回顾客观证据、举办公开会议,以期为患者、临床医生、保险公司和决策者对如何提高医疗保健的质量和价值方面提供推荐意见)
















