▎药明
康德/报道
编者按:
用基因工程对T淋巴细胞进行改造可以将它们转变为强有力的创新抗癌药物。25年以来,基于细胞工程和工艺制造的进步,T细胞疗法极大地改善了难治性癌症患者的疗效。其中最引人注目的案例之一就是CD19 CAR-T疗法。CAR-T疗法是在T细胞表面表达嵌合抗原受体 (chimeric antigen receptor, CAR),改变淋巴细胞的特异性和功能。靶向CD19的CAR在治疗B细胞癌变导致的血癌方面已经表现出良好的疗效。Kite Pharma和诺华公司的CD19 CAR-T细胞疗法都有望在今年获得FDA的批准上市。
CD19 CAR-T治疗在一些白血病和淋巴瘤中的成功,有望将CAR-T细胞疗法应用到其他恶性肿瘤领域。一系列新型靶抗原和CAR设计正在开发当中,即将在血液和实体瘤中进行测试。此外,自体T细胞是目前基于细胞的癌症免疫治疗的重点,但同种异体细胞来源,包括干细胞衍生的“现成”T细胞,将在未来起到重要作用。
最近,《自然》杂志对工程T细胞疗法的近况和发展方向进行了盘点。我们在本文中带来详细解读。
工程T细胞原理
T细胞在胸腺中发育时会获得称为T细胞受体(T cell receptor, TCR)的抗原受体。在生理条件下T细胞对抗原的识别由TCR-CD3复合体完成。TCR由
α
和
β
链组成,它们的结构决定了TCR的抗原特异性。CD3包括
γ
、
δ
、
ε
和ζ四种亚基,它的作用是启动T细胞激活程序。
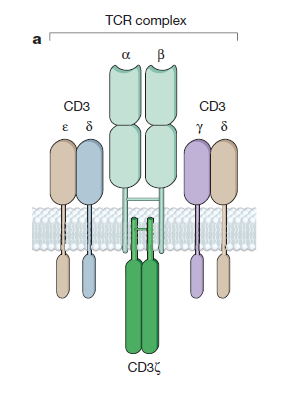
▲
T细胞受体(TCR)结构(图片来源:《自然》)
工程T细胞最自然的方式是利用基因工程在T细胞中
表达针对特定抗原的TCR
,它们与CD3形成复合体后,能够给予T细胞特定的抗原特异性。运用基因工程在T细胞中表达TCR可以产生大量在表型上与身体自然产生的T细胞相同的T细胞。对于那些自身无法产生足够免疫反应来对抗肿瘤或其它疾病的患者来说,这些抗癌或抗病毒的T细胞可以起到增强免疫反应的作用。
目前这一策略的实施重点在于分离出具有最好特异性和亲和力的TCR,设计分子机制来防止TCR的交叉反应性(cross-reactivity),和减少
α
和
β
链之间发生的错配。
TCR-T细胞疗法在治疗黑色素瘤 (melanoma) 和肉瘤 (sarcoma) 患者的小型临床试验中已经表现出显著的抗癌效果。
另外一种让T细胞识别新抗原的方法是通过
设计针对抗原的人工受体
。这种人工受体的细胞内片段通常需要CD3
ζ
链来保证该受体能够启动T细胞激活程序。第一代的CAR设计将CD3ζ链与能够识别抗原的抗体片段融合在一起,但是这种CAR设计在实验中不足以激发足够强大的免疫反应。
目前的第二代CAR设计在人工受体中结合了T细胞共刺激 (co-stimulating) 信号受体。
这种将T细胞激活片段(CD3
z
链) 和共刺激受体片段 (最常见的是CD28) 结合在同一CAR上的设计可以让T细胞不但能够识别特定抗原,而且可以分泌白介素-2 (interleukin-2) 并且在重复接触抗原后分裂增殖。
二代CAR设计是目前CAR-T疗法的主流。
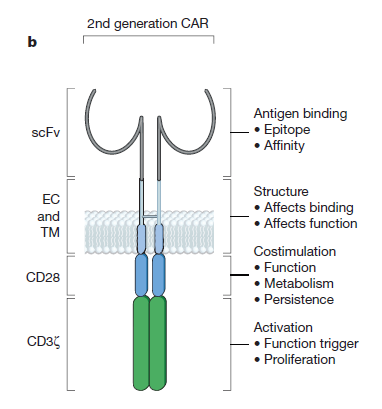
▲
嵌合抗原受体(CAR)结构(图片来源:《自然》)
二代CAR设计大多利用抗体单链可变片段(single chain variable fragments, scFv) 来识别抗原,目前已经有100多种特异性CARs,而且至少有8种共刺激信号受体片段被研究人员使用。其中
被研究得最清楚的二代CAR设计方案是利用CD28和4-1BB共刺激域的CARs。
这两类设计都已经在治疗复发性B细胞癌变的临床试验中取得了明显临床效果。基于CD-28的CARs能够促进活跃的T细胞增殖,但是T细胞持续性 (T cell persistence) 有限。而基于4-1BB的CARs 诱导效应T细胞(effector T cell) 的能力相对较低,但是支持更长的T细胞持续性。
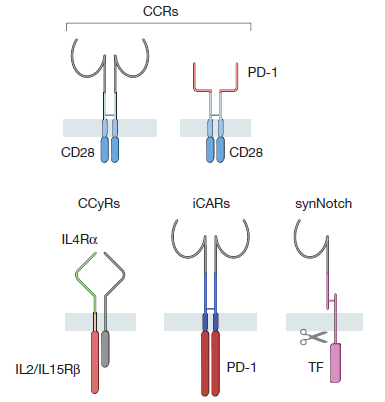
▲
CAR家族合成受体成员(图片来源:《自然》)
利用基因工程对T细胞的优化不只局限在表达不同的CAR或TCR来改变它们的抗原特异性上。
与CARs一起表达在T细胞中的其它人工合成受体可以达到提高T细胞效力或安全性的作用。
这些合成受体包括嵌合共刺激受体(chimeric co-stimulating receptors)、抗原特异性抑制受体(antigen-specific inhibitory receptors)和基于Notch的合成受体。这些合成受体给予研究人员更精准地调控T细胞激活的能力。
CAR-T细胞在临床应用上的典范:CD19 CAR-T疗法
CAR-T疗法在临床上的成功使用不但需要一个强有力的CAR,还需要一个合适的靶点。
这个靶点最好在所有肿瘤细胞表面表达,但是至少不在重要的正常细胞中表达。
CD19因为在大多白血病和淋巴瘤的肿瘤细胞表面表达而成为一个有潜力的靶点。靶向CD19虽然会造成B细胞发育不良,但是短期内患者可以耐受,而且清除B细胞可能阻止针对CAR的抗体的产生。
目前CD19 CAR-T疗法已经在治疗多种B细胞癌变的临床试验中获得了成功,其中包括急性淋巴性白血病(acute lymphoblastic leukemia, ALL)、慢性淋巴性白血病(chronic lymphocytic leukemia, CLL) 和弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma)。可喜的是虽然这些CAR-T疗法在CAR设计、转基因载体以及生产工序上有所不同,但是它们都获得了非常高的完全缓解率(complete response rate),对ALL的效果尤其出色。
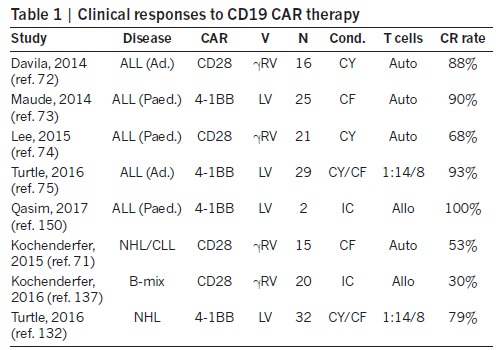
▲
CD19 CAR-T疗法的临床试验反应率(图片来源:《自然》)
值得注意的是同样的CARs在治疗ALL时获得的完全缓解率要高于CLL和淋巴瘤。目前关于T细胞在体内分布的临床数据还很少,
但是已有数据显示决定CAR-T细胞的疗效的原因更可能是肿瘤微环境中的抑制分子,而不是T细胞运输方面的障碍。
推广CAR-T疗法应用范围需要解决的问题
CAR-T细胞疗法与免疫检查点抑制剂 (immune checkpoint inhibitors) 是如今给癌症免疫疗法带来革命性变化的两类疗法。免疫检查点抑制剂在治疗携带高度体细胞突变的肿瘤患者时的疗效最佳,而患者的肿瘤如果突变率不高,则对免疫检查点抑制剂的反应不佳。值得一提的是CAR-T疗法疗效显著的ALL是一种突变率不高的癌症。这意味着
CAR-T疗法可能对那些突变率不高的癌症和免疫检查点抑制剂无效的癌症尤其重要。
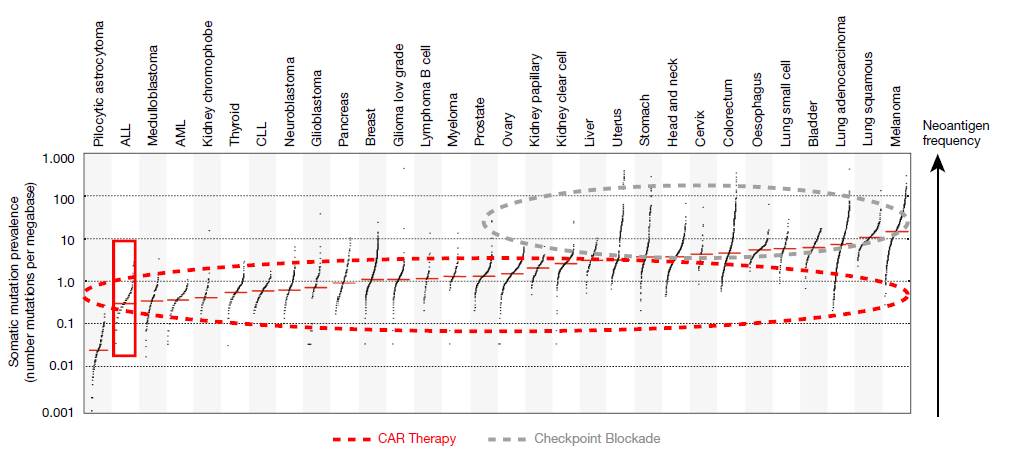
▲CAR-T疗法(红色虚线框)和免疫检查点抑制剂(灰色虚线框)应用的癌症类型(图片来源:《自然》)
虽然CAR-T疗法理论上可以适用于所有癌症并且可以与其它疗法联合使用,但是将CAR-T疗法推广到更多癌症种类中需要以下多个领域的进展:
1. 发现工程T细胞的新靶点
在CD19 CAR-T疗法取得成功后,在治疗血癌方面有两个新靶点最近接受了临床试验的检验。
它们分别是CD22和BCMA。
CD22是一种在癌变B细胞中表达的B细胞抑制受体。CD22 CAR-T疗法在治疗ALL儿童患者中表现出可喜的疗效,这些患者的肿瘤已经经过CD19 CAR-T疗法或blinatumomab治疗并且复发。BCMA是表达在骨髓瘤 (myeloma) 细胞、正常浆细胞和部分B细胞中的TNF受体家族中的一员。BCMA CAR-T细胞在治疗12名骨髓瘤患者的临床试验中获得两例显著反应。





