

今天为大家分享的是由湘南学院附属医院神经外科冯梦龙医师编译,《神外资讯》常务编辑、海军军医大学附属长征医院神经外科徐涛医师审校的:桥小脑角脑膜瘤手术策略与技巧,欢迎观看、阅读。

CP angle petrous meningioma

Bleeding in the CP angle
CP angle, tentorial meningioma
CP angle meningioma-Suprameatal approach
桥小脑角(cerebellopontine angle,CPA)肿瘤约占颅内肿瘤的10%,其中约6%-15%为脑膜瘤。CPA脑膜瘤一般起源于覆盖在岩锥后表面的硬膜,位于三叉神经的外侧。Cushing和Eisenhardt在1938年最早将这类肿瘤描述为“伪听神经瘤”。
CPA脑膜瘤被邻近的重要神经血管所缠绕,解剖结构复杂。由于大部分桥小脑角脑膜瘤起源于第Ⅴ、Ⅶ/Ⅷ、Ⅸ和Ⅹ颅神经的后方,这些神经被肿瘤推挤向前方且与肿瘤之间存在完整的蛛网膜分隔。但是,因为这些结构都在术者视野的盲区,需在分离的过程中逐渐显露,易在术中损伤。此外,肿瘤近中线侧还有丰富的血管结构,包括基底动脉、椎动脉、小脑前下动脉和小脑后下动脉。
CPA脑膜瘤定义稍广,不同位置的肿瘤临床表现、手术难度和预后不尽相同。因此,根据肿瘤与内听道的关系,可分为内听道前型、内听道后型和混合型CPA脑膜瘤。
内听道后型可根据肿瘤是否侵入内听道进一步分型;而内听道前型可分为向内上生长型(有或无侵犯Meckel’s腔、幕上或内听道)和向内下生长型(有或无侵犯颈静脉孔、内听道或枕骨大孔)。
上述分类对CPA脑膜瘤的手术难度和预后具有一定的参考性。越靠近中线的肿瘤以及侵犯Meckel’s腔、内听道、幕上、颈静脉孔或枕骨大孔的肿瘤预后较差,尤其是侵犯颈静脉孔,这类肿瘤手术并发症显著增加。所以,这些因素也是肿瘤次全切和复发率增加的预测因素。
诊断
CPA脑膜瘤的临床表现与其他CPA占位病变类似,常见的症状包括听力丧失、眩晕、头痛、面部疼痛/麻木以及平衡障碍;相对少见的症状有轻偏瘫、延髓压迫症状、偏身感觉障碍、声音嘶哑、吞咽困难以及并发梗阻性脑积水引起的颅高压症状。
内听道前型CPA脑膜瘤通常早期即可出现三叉神经受压症状(面部疼痛/麻木)、轻度面瘫和听力丧失;而内听道后型肿瘤则一般等到肿瘤生长较大时才出现临床症状,多表现为小脑功能受损的症状。
评估
向下方生长的巨大肿瘤需行耳鼻喉科检查,包括声带和吞咽功能的检查。
在MRI表现上,有些CPA脑膜瘤与听神经瘤难以鉴别,因为两者都可呈均匀强化。但是,脑膜瘤通常偏离内听道生长,并且与岩骨嵴后面的硬膜或天幕广基底相连。脑膜瘤很少起源于内听道内,但可继发性向内听道内生长,一般不会引起内听道扩大,而肿瘤与岩锥的夹角更大。
听神经瘤可使内听道扩大,与岩锥形成一个锐角,有时含囊性成分,囊后部可见脑脊液裂隙征(即T2上的蛛网膜界面。译者注)。
对于脑膜瘤患者,需仔细评估MRI T2相,因为它可以判断肿瘤是否侵犯软脑膜或包绕血管。若存在脑实质水肿,则提示肿瘤可能侵犯了软脑膜;此时,如果术者依旧追求全切,手术并发症会明显增加。
CT扫描对增生骨质的切除有指导意义。伴有钙化的肿瘤对术者而言是一种严峻的挑战,因为这种情况下肿瘤与周围组织粘连紧密,且术中瘤内减压困难、肿瘤牵拉受限。笔者不提倡术前栓塞,即使对大型肿瘤亦是如此。因为在术中可较早地将肿瘤贴着岩骨的基底的供血轻松阻断。
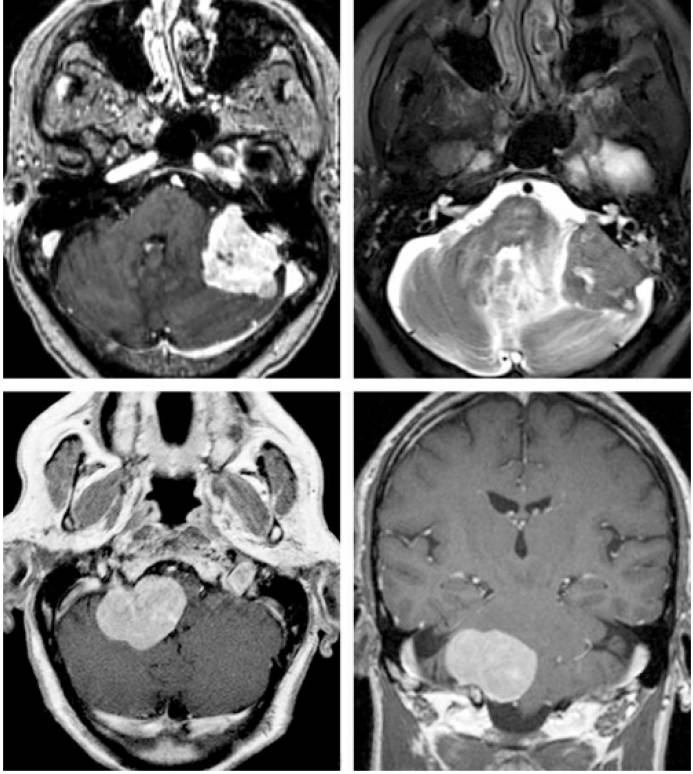
图1. 上图为一例左侧岩骨脑膜瘤或CPA脑膜瘤,肿瘤通常偏离内听道生长,且与岩骨后面的硬膜广基底相连。下图为一例右侧颈静脉孔脑膜瘤,肿瘤无明显向孔内生长。
手术指征
脑膜瘤的治疗方式包括定期影像学观察随访、手术切除、立体定向放射外科治疗(stereotactic radiosurgery,SRS)以及手术+SRS联合治疗。以下几种情况的患者可以选择定期影像学观察:
(1)肿瘤体积较小的无症状的患者;
(2)轻微症状的老年或伴有其他手术禁忌症的患者。一旦发现肿瘤增大,则需治疗;而体积较小的活动性生长的肿瘤如果没有引起占位效应,可选择SRS治疗。
若肿瘤占位效应明显并引起神经功能缺损,则应尽可能手术全切;但是,手术全切不应当以牺牲神经功能为代价。此时可选择次全切以保护神经功能,残余并呈进行性生长的肿瘤则行SRS治疗,这是治疗复杂颅底脑膜瘤的新理念。
所以,笔者的观点是,以全切为目标,根据术中情况可接受次全切以保护神经功能;然后通过影像学复查动态观察残余肿瘤,若肿瘤增大再选择SRS治疗。
术前注意事项
一旦决定手术治疗,则推荐进行术中脑干听觉诱发电位和体感诱发电位监测;若肿瘤侵犯内听道或颈静脉孔,则建议进行面神经肌电图监测或后组颅神经的监测。
笔者通常会在手术开始时留置腰大池引流管,适当释放脑脊液以减轻幕下的张力;这样可使术者能够较早且安全的推移肿瘤(未进行瘤内减压之前),便于彻底地阻断肿瘤依附于岩骨的供血。这一操作提高了术中肿瘤内减压和分离的效率。
依托于高分辨CT的术中导航对颅底结构的显示有助于指导切除受侵犯的颅骨。
手术解剖
术者必须详尽地理解后颅窝颅神经、小脑前下动脉和小脑后下动脉的相关解剖。
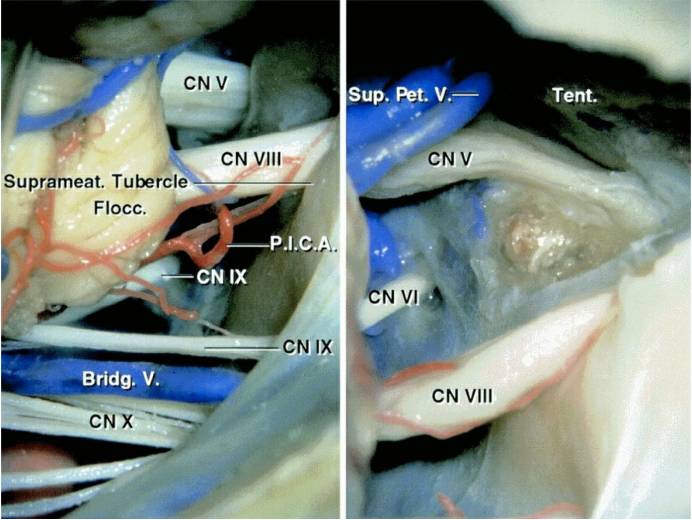
图2. 左侧乙状窦后入路暴露CPA内的颅神经(左图)。切开天幕后将内听道上结节部分磨除(右图)。经乙状窦后-内听道上结节入路有利于侵犯中颅窝和Meckel’s腔内脑膜瘤的切除(图片来自AL Rhoton,Jr)。了解更多信息,请阅读Petrous apex meninggiomas(岩尖脑膜瘤)章节。后组颅神经通常被肿瘤推挤向下方,V-VIII颅神经则在肿瘤前方。
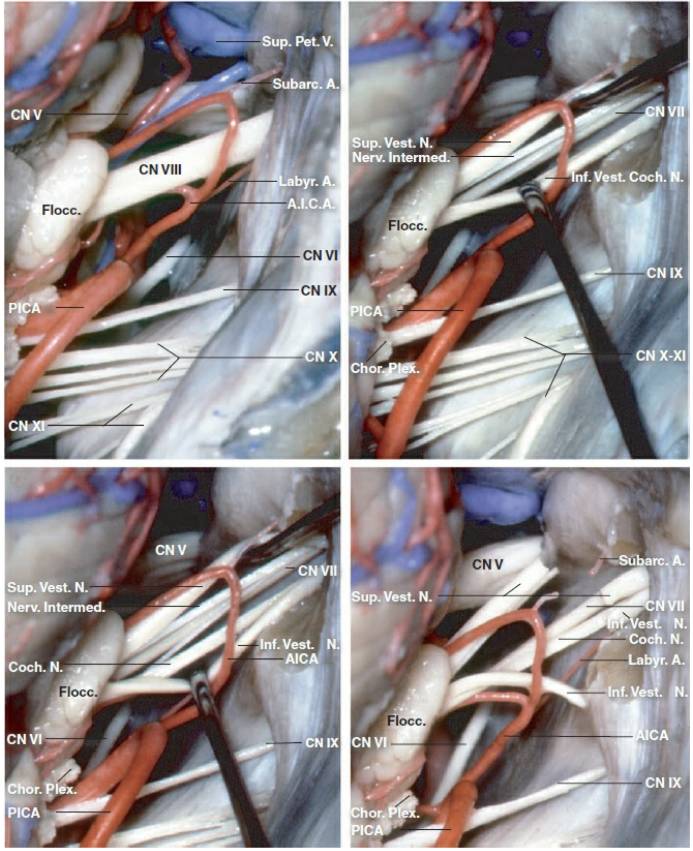
图3. 后颅窝颅神经的详细解剖。
切除桥小脑角脑膜瘤
切除桥小脑角脑膜瘤的手术入路有多种,包括乳突后入路、经迷路入路、迷路后入路、经岩骨入路、远外侧入路和中颅窝入路。最终手术入路的选择取决于肿瘤的特征,包括肿瘤的起源部位、肿瘤与神经血管尤其是颅神经的关系以及患者术前的神经功能状况。
对于大型肿瘤且丧失有用听力的患者,可以考虑经迷路入路或其改良入路。但是,目前有证据表明由脑膜瘤引起的前庭蜗神经功能障碍较听神经瘤引起的前庭蜗神经功能障碍更有可能得到改善。笔者认为这种入路对CPA脑膜瘤的切除意义甚微,而且常常导致不必要的手术暴露和冗长的手术步骤。
对于几乎所有的桥小脑角脑膜瘤,笔者青睐于扩大乳突后入路。相对其他需要去除更多颅底骨质的入路,这种入路提供了对CPA区良好的手术视野,并且其与入路相关的并发症发生率较低。桥小脑角脑膜瘤极少沿着脑干腹侧生长和包裹颅神经,这点尤其适用于内听道后型肿瘤。内听道前型肿瘤则需要术者在众多的颅神经之间进行手术,即使磨除更多的岩骨也无法改变这一手术空间的限制。
如果肿瘤向下侵犯枕骨大孔,可将乳突后入路向下扩展进行处理。同样,如果肿瘤明显向幕上生长,则可通过乳突后入路联合切开天幕的小脑上入路以获得进入中颅窝的手术空间(可见Transtentorial Approach for Parahippocampal Lesions(经天幕入路切除海马旁病变)章节)。
硬膜下操作
乳突后开颅后,打开并翻起硬膜,开始显微分离。接下来的操作,需严格按以下步骤进行,以提高脑膜瘤切除的安全性和效率(又名脑膜瘤的4D步骤):
(1)暴露肿瘤(Dedress);
(2)阻断肿瘤血供(Devascularize);
(3)瘤内减压(Debulk);
(4)分离肿瘤(Dissect)。
如前所述,瘤内减压前最大程度地阻断血供可避免过多的出血,同时也能达到更有效的减压,更重要的是,在分离与脑干和颅神经粘连的时候提供一个无血、清洁的手术视野。
下面总结内听道后型桥小脑角脑膜瘤切除的技术要点。
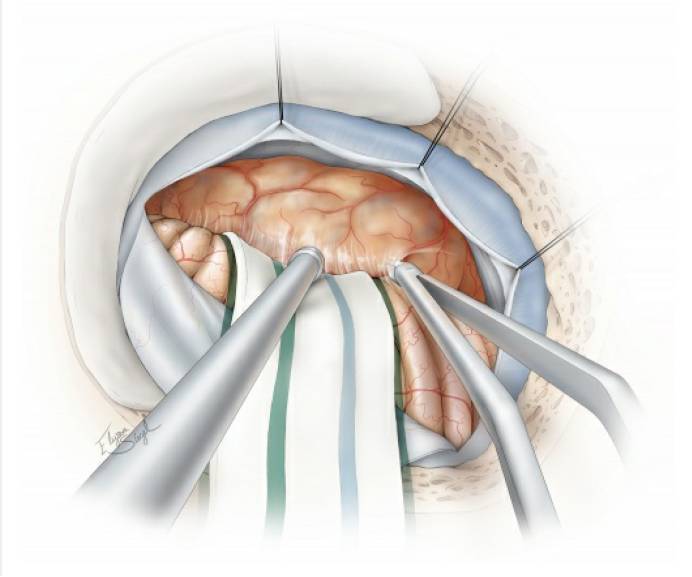
图4. 硬膜下初步暴露位于左侧的肿瘤。注意图中所示:去除乙状窦表面的骨质后,可以用缝线沿乙状窦边缘悬吊,将乙状窦牵开,获得更好的手术视野(扩大乙状窦后入路。译者注)。如果没有预置腰大池引流,则可通过打开后组颅神经周围的脑池释放脑脊液。随后,分离肿瘤后缘与小脑表面的蛛网膜粘连。
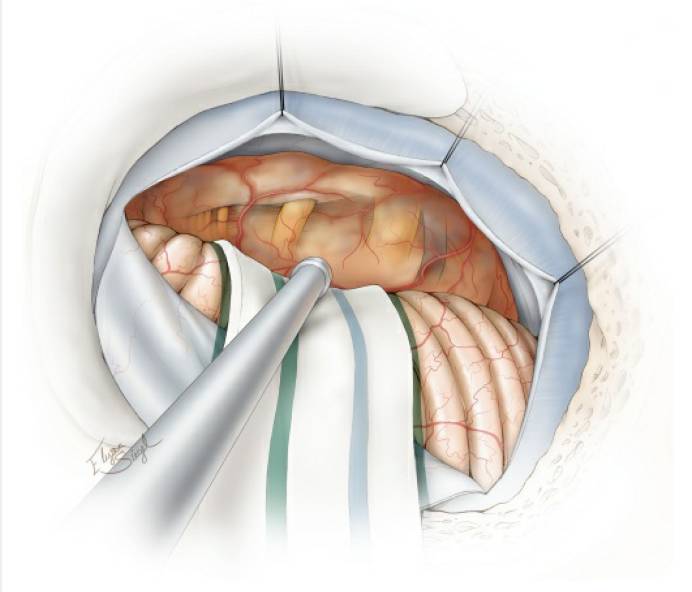
图5. 显示颅神经的大致分布与内听道后型肿瘤前缘包膜的关系。术前仔细研究MRI可使术者形成对肿瘤病理解剖以及重要解剖结构部位的立体构象。
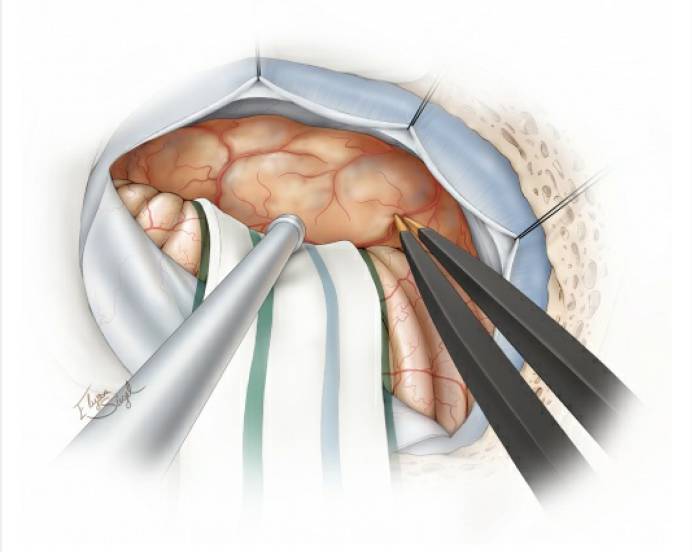
图6. 接下来,电凝并阻断肿瘤后包膜的血管。注意保护供应小脑的过路动脉。
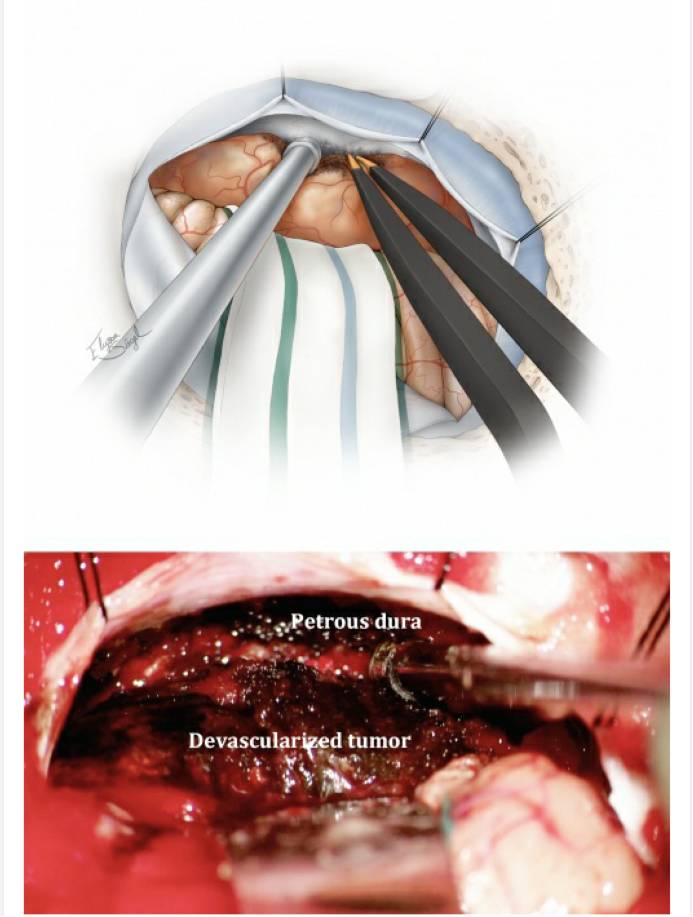
图7. 下一个重要的步骤是阻断肿瘤基底血供,沿着岩尖外侧逐步阻断供血动脉。笔者会沿着这个界面尽可能地分离肿瘤,但是需特别注意避免损伤肿瘤前包膜与颅底之间出入相应骨孔的颅神经。此时,适当释放脑脊液可使肿瘤轻微移动以避免对周围结构的过度牵拉。随后,暴露岩骨-天幕连接处,这是手术的方向标。对于中型肿瘤,沿着肿瘤下极可见到后组颅神经。
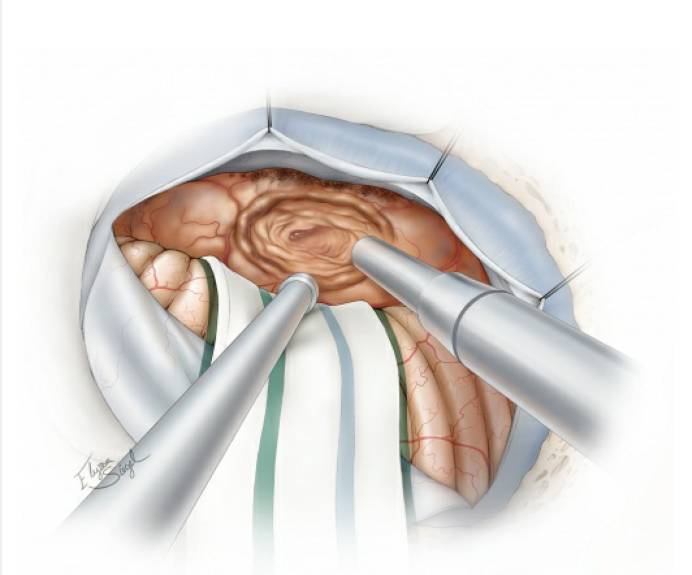
图8. 下一步,使用超声吸引器对肿瘤进行瘤内减压。血供已断的肿瘤减压效率更高,因为此时不需要在瘤腔内重复“切除-止血”的步骤。注意,肿瘤前面的包膜需完整保留,勿大意损伤。
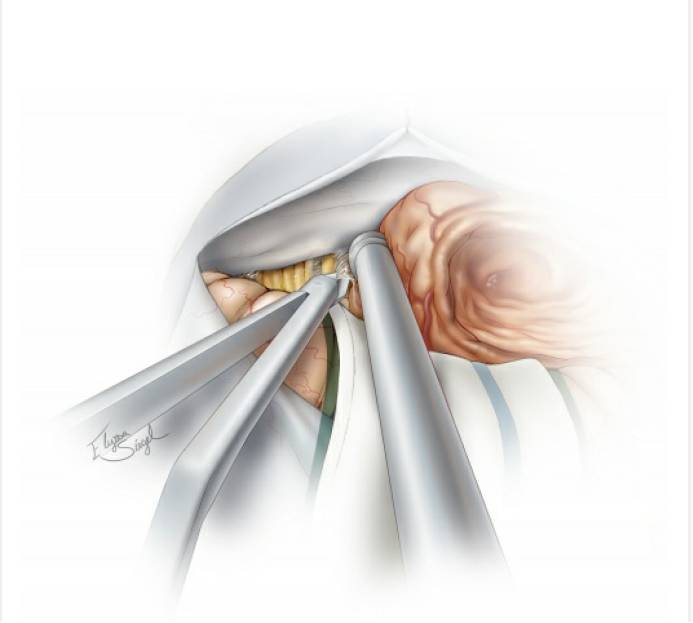
图9. 充分的瘤内减压使得肿瘤包膜移动灵活,从而无需对正常组织结构进行不必要的牵拉。然后将肿瘤下极包膜与后组颅神经进行锐性分离。注意仔细保留包绕神经的蛛网膜,细致松解粘连的血管。
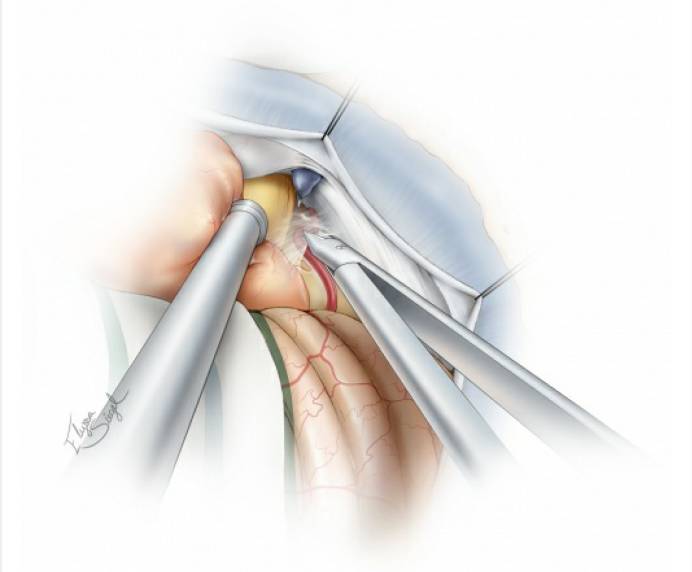
图10. 接下来,肿瘤上极可与天幕和三叉神经分离。此时,岩上静脉已被牺牲,笔者继续寻找滑车神经(被增厚的蛛网膜层包绕)并避免对它直接操作,以保护其功能。注意保留小脑上动脉发出的过路动脉。
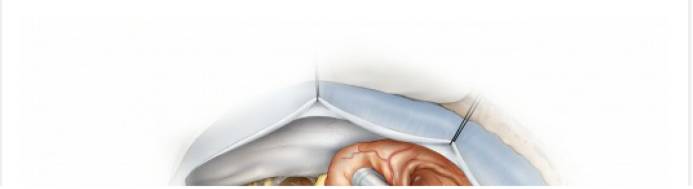
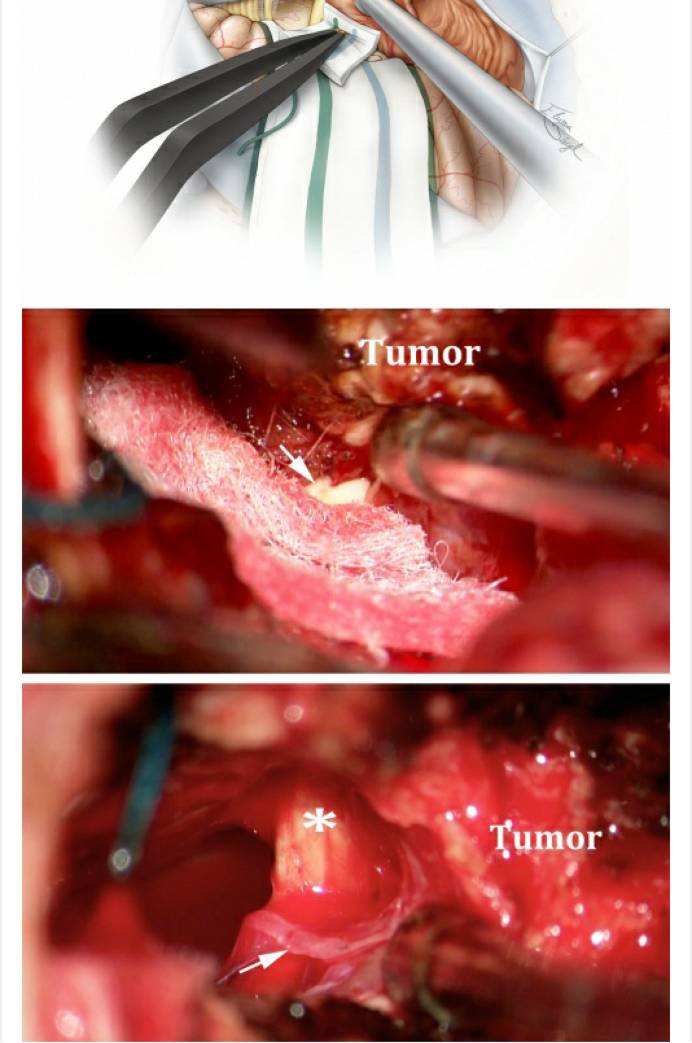
图11. 使用棉片将小脑外侧与肿瘤分离,并标记相应的分离界面。此时分离肿瘤最安全的方法是从内侧向外侧分离(“滚动分离”),这样能较早的发现进出脑干的颅神经根部(上图)。中间的术中图像显示了这个由内向外的分离操作;箭头所指为面神经REZ区。下图提示,肿瘤供血动脉(箭头所示)应沿血管追踪至肿瘤包膜,确认无误后方可离断(“*”号所指为面神经),这一技巧能安全保留过路动脉(包括迷路动脉)。
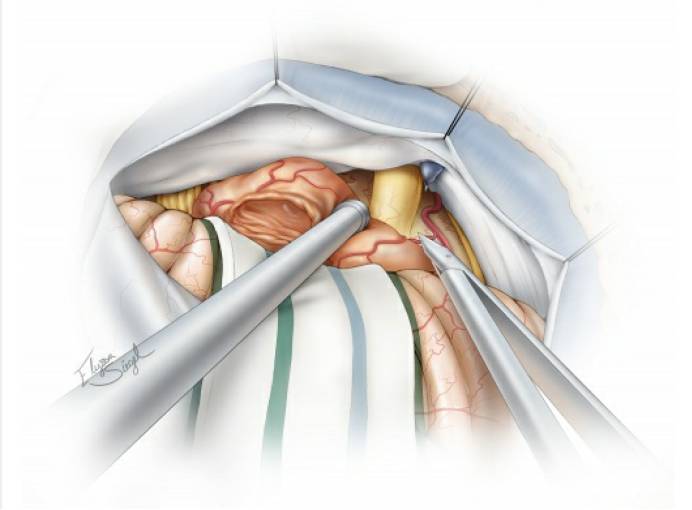
图12. 清晰显示发自小脑上动脉分支的肿瘤供血动脉,将其分离追踪至肿瘤,然后电凝并离断。将肿瘤从三叉神经根部和桥脑外侧缘进行锐性分离,注意保护好桥脑腹侧表面的软脑膜静脉。此时有必要继续逐步瘤内减压使肿瘤松动,可避免将重要结构置于牵拉损伤的境地。
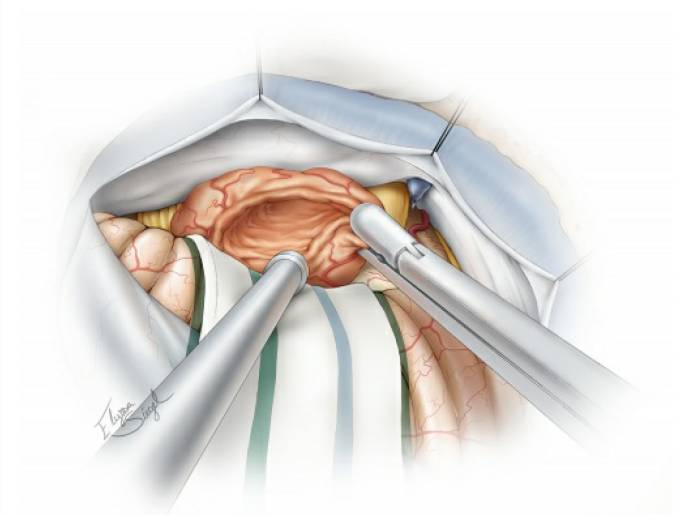
图13. 最后,仔细检查肿瘤包膜,确保分离完全后,再分块切除肿瘤。有时,三叉神经粘连异常紧密,需非常小心地分离以避免术后出现三叉神经功能损伤。注意,所有脑干表面的软脑膜必须完好无损。最后可放置几块罂粟碱浸润的明胶海绵,以减轻颅神经和脑干上的小血管痉挛。
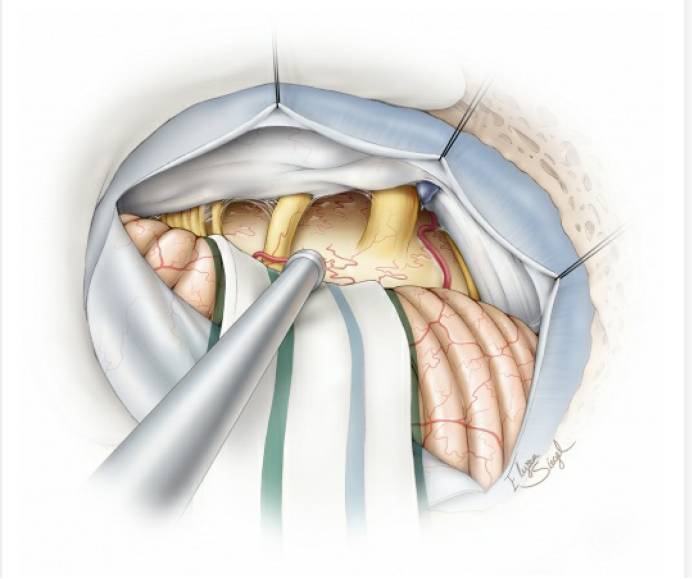
图14. 关颅前,仔细检查所有重要的神经血管结构,确保其解剖完整性。切除或电凝附近岩骨的硬脑膜以降低肿瘤复发风险,注意该操作不要引起对出骨孔处颅神经的热损伤。此外,受侵犯的岩骨也需磨除。
内听道前型桥小脑角脑膜瘤的切除遵循同样的显微手术原则。但是,对于这类肿瘤,颅神经通常在肿瘤的后方,所以术者需在颅神经的间隙中操作,并分块切除肿瘤。三叉神经是最能耐受推移的神经,需充分利用该神经上、下间隙作为工作通道,其他工作通道可选择CN VII/VIII复合体和后组颅神经之间的间隙,而肿瘤也通常会使这些神经间的间隙增宽。注意,这类肿瘤需从外侧向内侧方向分离。
嵌入肿瘤内的颅神经和血管结构需小心保护,由于颅神经之间狭窄手术空间的限制常常影响肿瘤的全切率,因此内听道前型CPA脑膜瘤手术常需残留小片肿瘤以确保神经血管结构不受损伤。
不论是内听道前型还是内听道后型脑膜瘤,它们都可以侵犯到内听道内;所以,为了暴露内听道内的肿瘤则需打开内听道后壁,而骨质磨除的程度则取决于肿瘤侵犯内听道的程度。
小脑凸面脑膜瘤
小脑凸面脑膜瘤的切除技巧与道后型桥小脑角脑膜瘤类似。术前MRV可以了解横窦和乙状窦的开闭情况从而评估肿瘤全切的可行性,如果受侵犯的静脉窦已经闭塞,则全切可能性大。但是对于仅部分闭塞的静脉窦则不能切除或强行操作的,遗留这部分粘连的肿瘤,术后再通过影像学随访观察,若肿瘤增长则行SRS治疗。
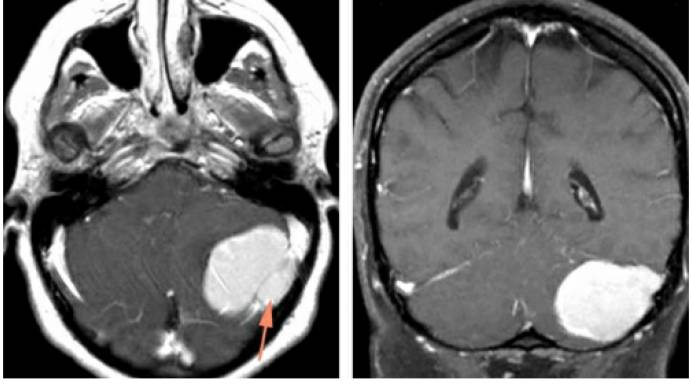
图15:如图所示为1例左侧小脑凸面脑膜瘤,注意肿瘤已侵犯到窦内(左图箭头所指),部分横窦节段已完全闭塞,MRV也证实了横窦局部的闭塞。最终该肿瘤被全切,受侵犯的窦也通过磨除横窦上下方骨质后一并切除,并使用两根丝线结扎其与正常横窦的分界处。同时,labbe静脉汇入至横窦的入口保留完好。
关颅
使用骨蜡充分填充闭塞岩骨及乳突气房后,按标准步骤关颅。
术后注意事项
后颅窝手术可导致术后短暂性梗阻性脑积水(由于小脑肿胀或出血压迫四脑室)和化学性脑膜炎,因此,需密切观察有无相关临床表现。
化学性脑膜炎可进行短期激素治疗;若发生短暂性交通性脑积水(常继发于脑膜炎、蛛网膜下腔出血等),则常需多次腰穿释放脑脊液或脑室分流手术。脑脊液循环梗阻通常为短暂性,但是偶尔也需要永久性的脑脊液分流。
点睛之笔
肿瘤切除需按以下步骤进行:暴露、断血供、瘤内减压、分离并切除。
保护覆盖颅神经和脑干的蛛网膜和/或软脑膜对预后至关重要。
术中如果在一个界面肿瘤与周围结构粘连紧密、分离困难时,最好更换到另外一个肿瘤-脑干/神经界面继续分离并逐渐向原来的界面靠近。
笔者总是很警惕肿瘤前方包膜上是否有正常脑血管存在,宁可在操作前判断错1000次,也不要在误伤重要结构后追悔莫及的判断对一次。
(编译:冯亮;审校:徐涛)
DOI: https://doi.org/10.18791/nsatlas.v5.ch05.10
中文版链接:http://www.medtion.com/atlas/2300.jspx
Contributor: Andrew R. Conger, MD, MS
相关链接

长按并识别二维码或点击“阅读原文”获取原文
















