
随着基因工程和细胞治疗技术的快速发展,活体药物(包括哺乳动物细胞、微生物细胞和病毒)作为一种新兴的治疗手段,正在逐渐改变现代医学的面貌。这些活体药物通过基因编程被设计用于执行复杂的治疗任务,例如动态响应环境刺激、代谢药物生产、主动运动和靶向特定组织。
然而,与传统的小分子药物和蛋白质药物不同,
活体药物在递送过程中面临诸多挑战,包括维持细胞活性、控制细胞复制、管理代谢过程以及减少免疫原性
。
此外,活体药物的复杂性也使得其在靶向特定组织、控制有效剂量和保持稳定性方面面临更大的困难。为了克服这些挑战,生物材料的应用成为关键。通过设计和开发新型生物材料,可以显著提高活体药物的递送效率和治疗效果,从而推动活体药物在临床中的广泛应用。

David J. Mooney
是一位在生物材料和再生医学领域具有重要影响力的科学家。哈佛大学约翰·A·保尔森工程与应用科学学院教授、哈佛大学Wyss生物启发工程研究所(Wyss Institute for Biologically Inspired Engineering)的核心教员。美国国家工程院院士,他的的研究主要集中在生物材料、再生医学和免疫工程领域。他的研究团队致力于开发新型生物材料,用于组织再生、药物递送和免疫治疗。在《Nature》《Science》《Nature Reviews Materials》等顶级学术期刊上发表了超过400篇研究论文。并且拥有超过50项专利,许多专利已经成功转化为临床应用,例如用于组织修复的生物材料和药物递送系统。

David J. Mooney院士团队
在本文中详细讨论了活体药物(包括哺乳动物细胞、微生物细胞和病毒)的递送挑战以及生物材料在解决这些挑战中的作用。文章强调了生物材料在提高活体药物的靶向性、有效剂量和稳定性方面的潜力,并展望了未来发展方向。
1.主要内容

图1 活体药物作为新兴治疗手段
活体药物(包括哺乳动物细胞、微生物细胞和病毒)与传统药物(如小分子和蛋白质)的具有显著的区别,其强调了
活体药物的动态响应、代谢能力、主动运动和复制进化等特性,这些特性为药物递送带来了新的机遇和挑战。
还展示了生物材料如何通过多种给药途径(如口服、吸入、局部注射等)将传统药物递送至人体各个部位,这些策略也可应用于活体药物的递送。
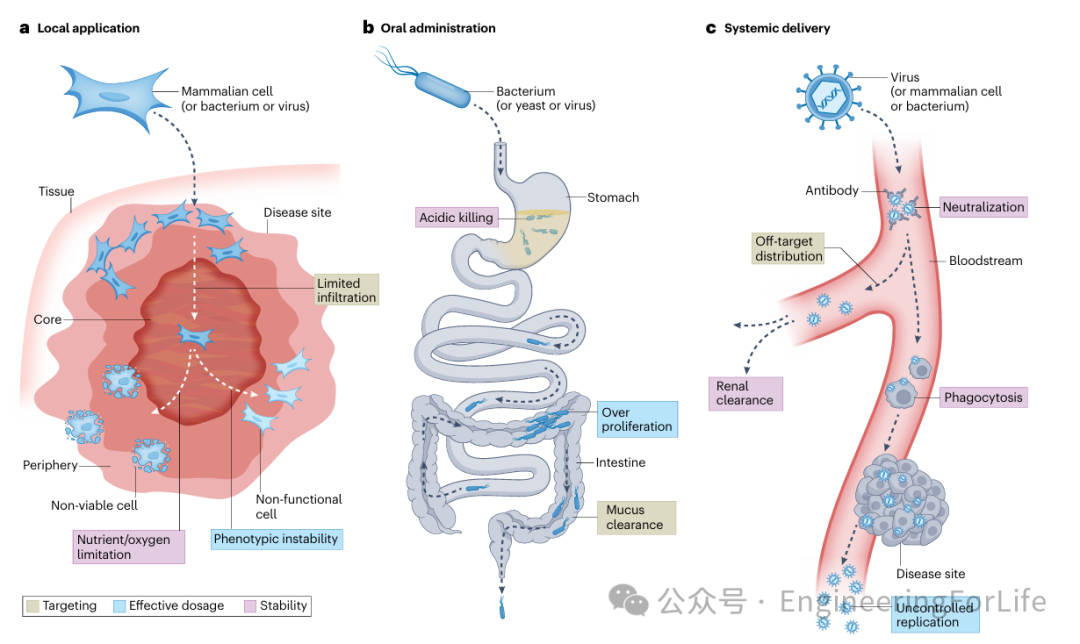
图2 活体药物递送的挑战
通过局部应用、口服和系统性给药三种途径,展示了活体药物在递送过程中面临的挑战,包括药物在目标部位的保留、组织特异性、有效剂量的控制、稳定性以及免疫反应等问题。特别指出哺乳动物细胞、微生物细胞和病毒在递送过程中可能遇到的具体问题,例如细胞在组织中的渗透、药物的生物活性维持以及药物在体内的清除和降解。

图3 生物材料增强靶向性
图中展示了生物材料如何通过局部给药和靶向配体策略增强活体药物的靶向性。例如,
通过植入式药物载体(如Gliadel药片)或靶向配体(如叶酸)增强药物对特定组织的靶向性
。这些策略也被应用于活体药物,包括使用
水凝胶微针贴片、局部水凝胶、生物材料微加工技术、靶向配体修饰的细菌以及自然杀伤细胞表面的靶向抗体等,以提高活体药物在目标组织中的积累和保留。
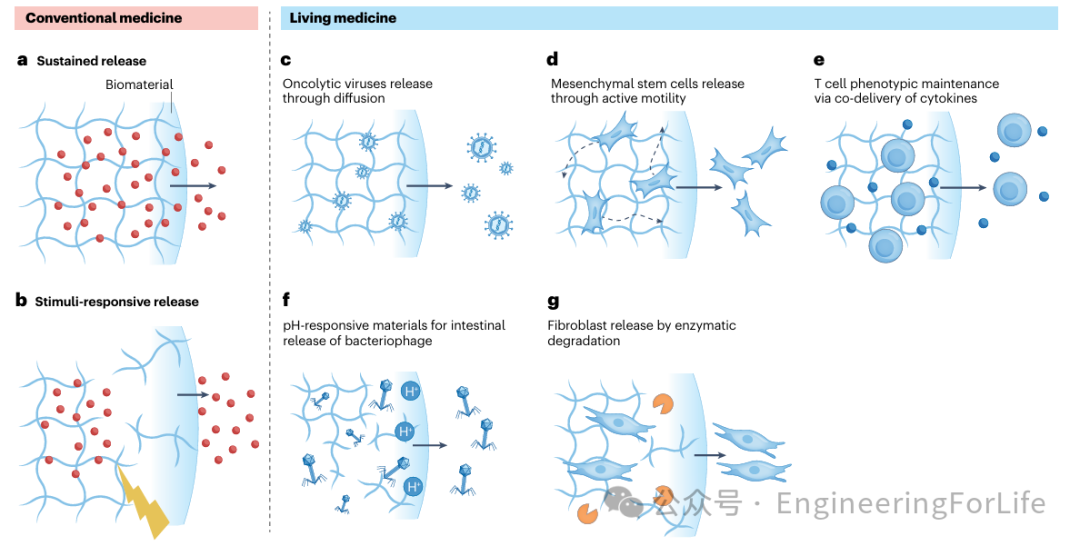
图4 生物材料增强有效剂量
研究人员进一步探讨了生物材料如何通过持续释放和刺激响应型释放系统控制活体药物的剂量和生物活性。例如,
通过扩散控制或降解控制实现药物的缓慢释放,以及通过pH敏感系统或热敏材料响应生理触发释放药物
。
这些策略也被应用于活体药物,包括通过
丝素蛋白水凝胶实现溶瘤病毒的持续释放、利用细胞的主动运动实现细胞从水凝胶支架中的释放、通过水凝胶共递送T细胞和细胞因子以维持抗肿瘤T细胞表型,以及通过pH响应型水凝胶在肠道中选择性释放噬菌体。
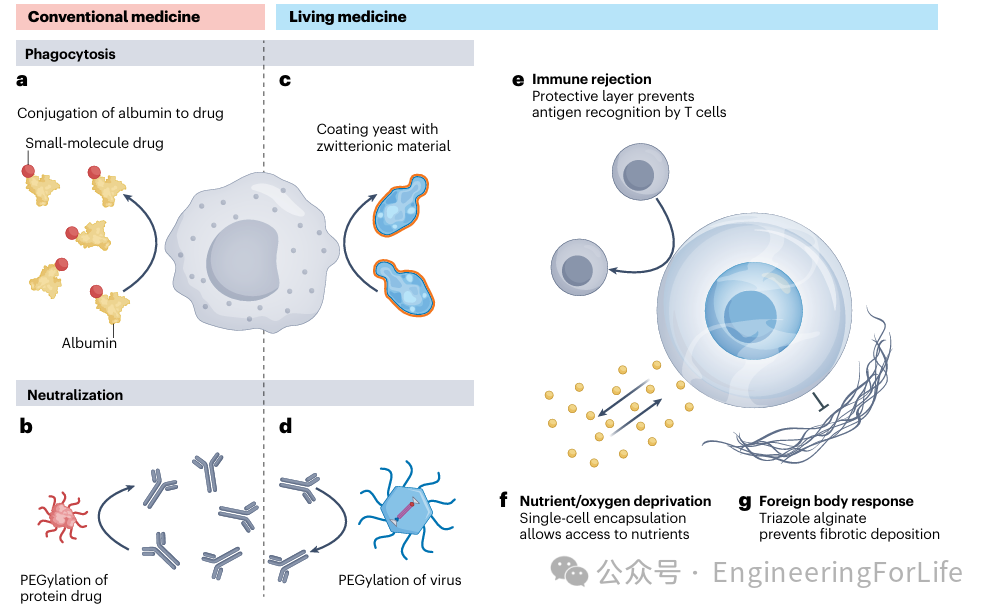
图5 生物材料增强稳定性
研究人员继续讨论了生物材料如何保护活体药物免受体内清除和降解的影响。例如,通过与白蛋白或聚乙二醇(PEG)结合避免网状内皮系统的清除和抗体介导的中和。这些策略也被应用于活体药物,包括
通过两性离子材料涂层保护酵母细胞免受吞噬、通过PEG化保护腺相关病毒(AAV)延长其循环时间、通过水凝胶封装保护哺乳动物细胞免受免疫排斥、通过微囊化技术提高细胞的营养扩散效率,以及通过三唑类藻酸盐抑制异物反应和纤维沉积。
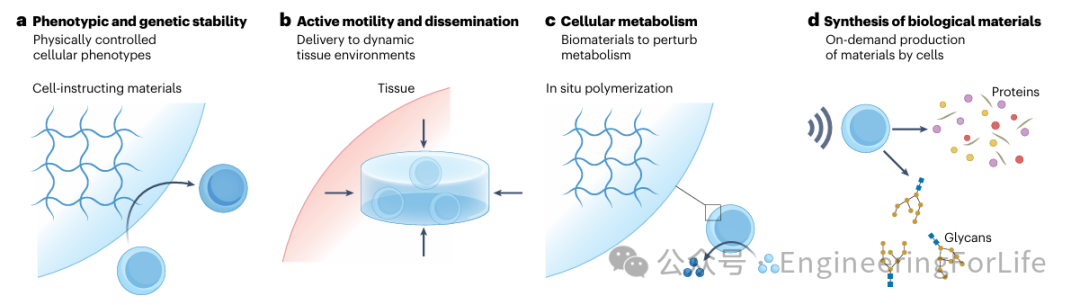
图6 活体药物递送的未来创新
进一步活体药物递送的未来发展方向进行了展望,包括
通过细胞指导材料调节细胞表型和基因稳定性、开发能够承受动态组织环境的先进水凝胶和粘合剂以防止活体药物的泄漏和扩散、调控细胞代谢以控制细胞活性和复制,以及利用合成生物学的进步使活体药物能够合成生物材料,例如通过工程化细胞产生气体囊泡或分泌RNA纳米颗粒,为活体药物的递送提供了新的可能性。
2.全文总结
本文综述了生物材料在活体药物递送中的应用,重点探讨了活体药物(包括哺乳动物细胞、微生物细胞和病毒)的递送挑战及其解决方案。文章首先介绍了活体药物的类型和递送挑战,随后详细讨论了生物材料如何通过增强靶向性、有效剂量控制和稳定性来克服这些挑战。通过分析临床中已采用的生物材料策略,并探讨如何将其适应于活体药物递送,文章最后展望了未来发展方向,强调了材料科学与合成生物学的结合在开发下一代活体药物递送系统中的潜力。
参考资料:
https://doi.org/10.1038/s41578-024-00766-y
来源:
EngineeringForLife
声明:仅代表作者个人观点,作者水平有限,如有不科学之处,请在下方留言指正!






