

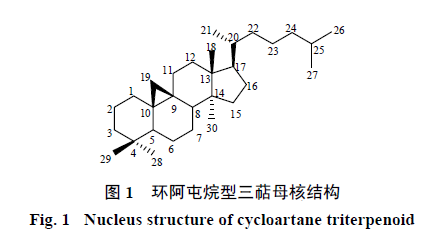
环阿屯烷型三萜是一类四环三萜化合物,其母核结构在
C-13
,
14
位分别连有
β
、
α-CH
3
;
A/B
、
B/C
、
C/D
环均为反式(图
1
)。
C-19
位甲基与
C-9
位脱氢形成的三元环是环阿屯烷型三萜区别于其他类型四环三萜的典型结构特征。环阿屯烷型三萜广泛分布于豆科、五味子科、毛茛科、大戟科、茜草科、兰科、楝科、菊科、芭蕉科、番荔枝科、漆树科、杉科、松科、无患子科、西番莲科、仙茅科等植物中。目前已有较多关于其化学结构及生物活性方面的报道
[1-5]
。
裂环环阿屯烷型三萜是骨架重排的、结构新颖的环阿屯烷型三萜类化合物:
C-3
,
4
位碳键断裂开环,
C-3
位形成羧酸或羧酸衍生物或经氧化形成七元酯环;
C-9
,
10
位断裂形成七元环;
C-3
,
4
位碳键断裂开环或成七元酯环,同时
C-9
,
10
位断裂形成七元环;
C-15
,
16
位碳键断裂开环;也可经一系列氧化、脱氢等反应成为
14(13
→
12)-
abeo
-
环阿屯烷型或
kadlongilactone
环阿屯烷型三萜。文献报道裂环环阿屯烷型三萜具有抗病毒、抗肿瘤等生物活性
[6-8]
。
其中,
14(13→12)-
abeo
-
环阿屯烷型、
kadlongilactone
裂环环阿屯烷型三萜只分布于五味子科植物中,并已有相关综述
[8-9]
,因此本文系统总结了除五味子科外其他科植物中报道的裂环环阿屯烷型三萜化合物的化学结构、生物活性及植物来源。
1
结构分类
1.1
C-3
,
4
位碳键断裂开环的环阿屯烷型化合物
(
I
)
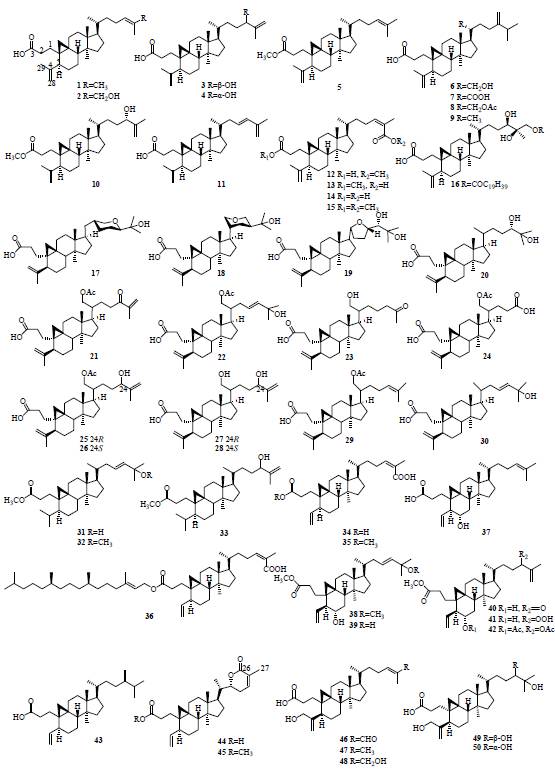
在环阿屯烷型三萜母核基础上,
C-3
,
4
位碳键
断裂开环,
C-3
位形成羧酸或羧酸衍生物,此类型
共分离得到
87
个化合物(
1
~
87
);
C-3
,
4
位碳键
断裂开环之后,经
Baeyer-Villiger
氧化形成七元内酯环,此类型共分离得到
9
个化合物(
88
~
96
)。而化合物
97
C-3
,
4
位断裂开环后形成八元内酯环。另外,
13
个化合物(
34
~
45
、
87
)在裂环的同时失去
C-4
位连接的一个甲基。
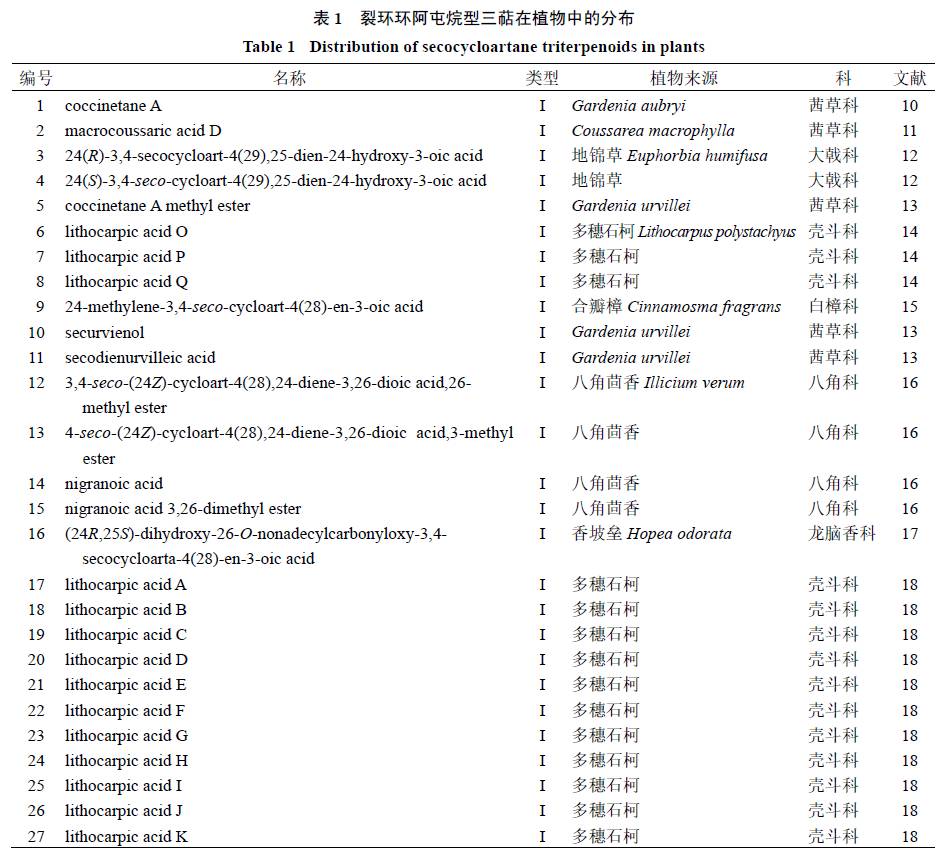
C-3
,
4
位碳键断裂开环的环阿屯烷型化合物(表
1
和图
2
)主要分布于茜草科、壳斗科、蜡梅科、大戟科植物中。



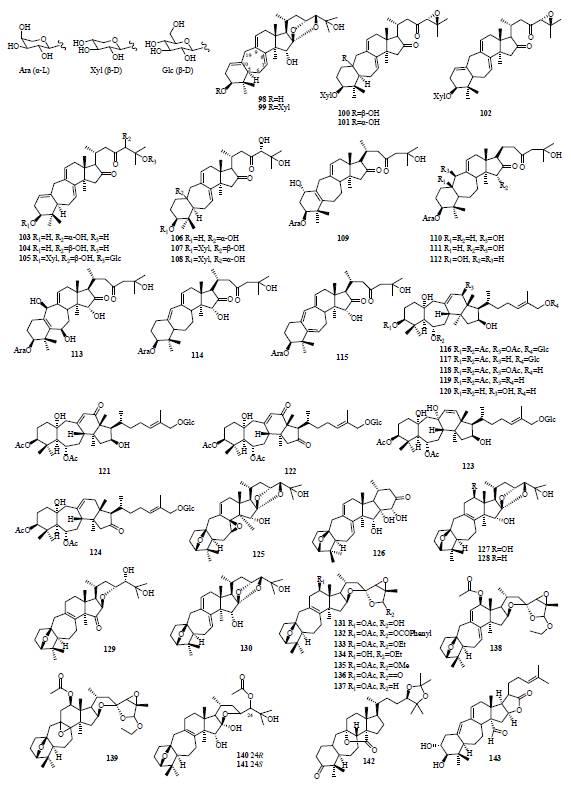
1.2
C-9
,
10
位碳键断裂形成七元环的环阿屯烷型化合物
(
II
)
在环阿屯烷型三萜母核基础上,
C-9
,
10
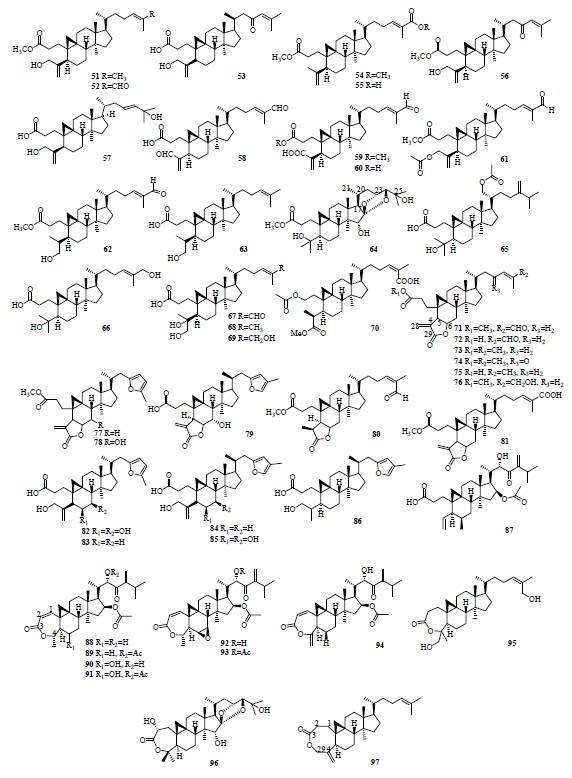
位碳键断裂后形成七元环,此类型共分离得到
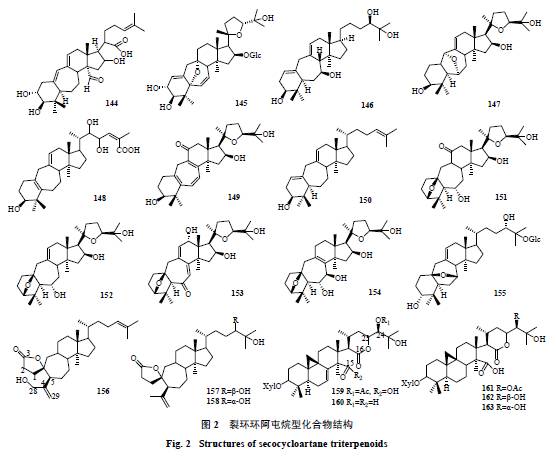
58
个化合物(
98
~
155
,表
1
和图
2
)。此类型化合物多分布于豆科和毛茛科植物中。
1.3
C-3
,
4
位碳键断裂开环同时
C-9
,
10
位断裂形成七元环的环阿屯烷型化合物
(
III
)
在环阿屯烷型三萜母核基础上,
C-3
,
4
位碳键断裂开环同时
C-9
,
10
位断裂形成七元环。此类型共分离得到
3
个化合物(
156
~
158
,表
1
和图
2
)。此类型化合物仅见报道于茜草科植物
Gardenia
urvillei
Montrouz.
和八角科植物地枫皮
Illicium
difengpi
K. I. B. & K.I. M.
中。
1.4
C-15
,
16
位碳键断裂开环的环阿屯烷型化合物
(
IV
)
在环阿屯烷型三萜母核基础上,
C-15
,
16
位碳键断裂开环。此类型共分离得到
5
个化合物(
159
~
163
,表
1
和图
2
)。此类型化合物仅见报道于毛茛科升麻属植物中。
2
生物活性
2.1
抗肿瘤作用
从夏蜡梅中分离得到的
45
对具有多药耐药性的
KB-C2
细胞株表现出显著的细胞毒性
[20]
。从大三叶升麻中分离得到的
64
对
HL-60
细胞表现出显著的细胞毒性,其
IC
50
值为
0.83 μmol/L
[31]
。从大黄栀子中分离得到的
52
、
71
、
72
,对肿瘤坏死因子
-α
(
TNF-α
)诱导的核转录因子
-κB
(
NF-κB
)具有抑制活性,
IC
50
值分别为
8.3
、
6.0
、
5.6 μmol/L
[23]
,且
71
、
72
具有显著的抑制
NO
生成的活性,其
IC
50
值分别为
2.0
、
3.2 μmol/L
。从茜草科植物
Gardenia
tubifera
Wall.
中分离得到
71
~
73
,其中
71
对
P-388
、
BCA-1
细胞具有细胞毒性,
IC
50
值分别为
1.50
、
3.59 μg/mL
;
72
对
P-388
细胞具有显著的细胞毒性,其
IC
50
值为
1.73 μg/mL
;
73
对
P-388
、
KB
、
Col-2
及
Lu-1
细胞具有细胞毒性,
IC
50
值分别为
0.89
、
1.48
、
2.28
、
1.89 μg/mL
[33]
。从大三叶升麻中分离得到的
96
、
125
、
127
对转录激活因子
-3
(
STAT-3
)介导的干扰素(
IFN-α
、
IFN-γ
)形成具有抑制作用
[36]
。从孔膜黏菌科
Tubifera
dimorphotheca
Nann. -Brem. & Loerak.
中分离得到的
143
对长春新碱耐药的人口腔上皮癌细胞
KB
具有显著细胞毒性,其
IC
50
值为
2.7 μg/mL
[47]
。
2.2
抗
HIV
作用
从茜草科植物
Gardenia
obtusifolia
Roxb.
中分离得到的
56
对
HIV-1
的逆转录酶有抑制活性,抑制率为
99.9%
(
200 μg/mL
)
[28]
。从同属植物
G
.
tubifera
中分离得到的
71
和
72
具有显著的抗
HIV
活性,抑制率分别为
71.1%
、
99.9%
(
200 μg/mL
),
IC
50
值分别为
49.7
、
17.0 μg/mL
[33]
。
2.3
其他作用
从多穗石栎中分离得到的
6
和
17
对小鼠和人
11β-
羟化类固醇脱氢酶
I
型同工酶具有显著的抑制活性,
6
的
IC
50
值分别为
0.49
、
1.1 μmol/L
,
17
的
IC
50
值分别为
0.24
、
1.9 μmol/L
。
17
还对藤黄微球菌和枯草杆菌有显著的抑制作用,最低抑菌浓度(
MIC
)分别为
3.1
、
6.3 μg/mL
[14-18]
。从茜草科
Antirhea
acutata
(DC.) Urb.
中分离得到的
37
和
41
对环氧合酶
- 1
、
2
活性表现出抑制作用,其中
37
的
IC
50
值分别为
43.7
和
4.7 μmol/L
,
41
的
IC
50
值分别为
45.7
和
18.4 μmol/L
[21-22]
。从大黄栀子中分离得到的
58
具有显著的抑制血管生成活性,其
IC
50
值为
4.40 μmol/L
[30]
。茜草科大黄栀子
Gardenia
sootepensis
Hutchins.
和
G
.
obtusifolia
Roxb.
中分离得到的
75
对大鼠动脉环微管生长有抑制活性,且呈剂量依赖关系,其
IC
50
值为
4.46 μmol/L
[25]
。从大戟科植物
Neoboutonia
macrocalyx
L.
中分离得到
87
~
94
,其中
87
~
91
、
94
具有显著的抗疟原虫活性,
IC
50
值均小于
2 μg/mL
;
92
和
93
也具有中等抗疟原虫活性,
IC
50
值分别为
5.1
、
6.4 μg/mL
[35]
。从毛茛科植物
Actaea
podocarpa
DC.
中分离得到的
111
具有抗补体活性,其
IC
50
值为
200 μmol/L
[41]
。从茜草科植物
Gardenia
urvillei
Montrouz.
中分离得到的
11
和
156
对氯喹耐药的恶性疟原虫有抗疟活性,
IC
50
值分别为
32.4
、
26.7 μmol/L
[13]
。从地枫皮中分离得到的
157
、
158
通过抑制肿瘤坏死因子
-α
(
TNF-α
)及
NF-κB
的生成或释放表现出很强的抗炎活性。
2
个化合物对脂多糖诱导的
TNF-α
生成的抑制率分别为
90%
、
85%
(
25 μg/mL
),对
NF-κB
释放的抑制率分别为
70%
、
60%
(
20 μg/mL
)
[54]
。
3
结语
裂环环阿屯烷型三萜是一类结构新颖的环阿屯烷型三萜类化合物,多数化合物具有较强的抗病毒、抗肿瘤活性,其中
C-3
,
4
位碳键断裂开环的化合物对肿瘤细胞具有显著的细胞毒性,而
C-9
,
10
位碳键断裂形成七元环的环阿屯烷型化合物多数对肿瘤细胞只有微弱或没有细胞毒性。目前发现仅存在于五味子科的
14(13
→
12)-
abeo
-
环阿屯烷型、
kadlongilactone
环阿屯烷型三萜亦具有显著的抗肿瘤活性
[8]
。裂环环阿屯烷型三萜化合物还表现出显著的抗
HIV
活性,通过抑制
HIV
整合酶和逆转录酶的活性从而抑制
HIV
病毒的复制,具有抗
HIV
活性的化合物多集中在
C-3
,
4
位碳键断裂开环且
C-3
位形成羧基或其酯的化合物中。
C-3
,
4
位碳键断裂开环之后,经
Baeyer-Villiger
氧化形成七元酯环的化合物在具有低细胞毒性的同时表现出显著的抗疟原虫活性
[35]
。药用植物中裂环环阿屯烷型化学成分的研究对于丰富天然化合物的结构以及中药药效物质基础的研究具有积极的意义。
参考文献(略)
来 源:李延勋,栗章彭,苏艳芳. 裂环环阿屯烷型三萜的研究进展 [J]. 中草药, 2017, 48(15):3198-3209.






