经验
|
文献
|
实验
|
工
具
|
SCI写作
|
国自然

作者:叶子
转载请注明:解螺旋·临床医生科研成长平台
2015年全球大约有5580万癌症病例,死亡人数880万。现在每3例癌症患者中有2例生存至少5 年。随着治疗手段的改善,越来越多的患者虽然存活时间没有明显延长,但生活质量得到了保证。从全球水平看,癌症是最具挑战性的健康问题,非洲、亚洲和中美洲、南美洲,10例癌症患者中7例死于癌症,WHO预估到2030年全球癌症死亡率将增至80%。
科学界正在不断努力扭转这一局面,大量的研究推进了抗癌进展。从2016年8月1日至2017年7月31日,FDA批准了九种用于治疗某些类型癌症的新疗法。同时,FDA还批准了八种以前批准的抗癌疗法的新用途。
基础-临床研究是一个迭代循环,在已有知识的基础上做进一步探究。近年来,随着发现步伐的加快和新学科的整合,这个循环越来越有效率。
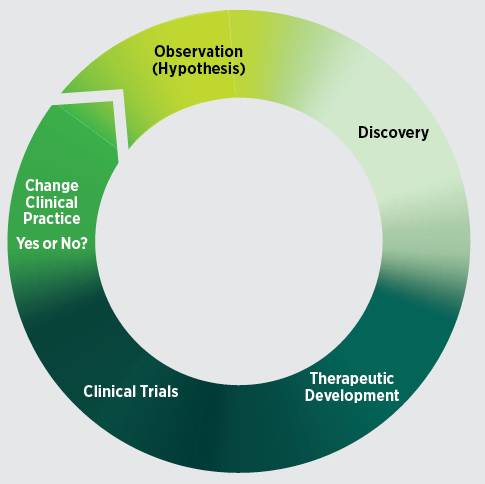
临床试验是生物医学研究周期的核心部分,来确保研究成果尽可能快速、安全地到达最需要的患者。大多数潜在的新型诊断,预防或治疗产品在通过FDA批准并作为患者护理的一部分之前,其安全性和有效性必须通过临床试验严格测试。
所有的临床试验都是由机构审查委员会审查并批准,然后才能开始,并在整个期间进行监测。有几种类型的癌症临床试验,包括治疗试验,预防试验,筛查试验和支持性或姑息治疗试验,每个试验都旨在解决不同的研究问题。
套用在肿瘤研究上,传统的治疗临床试验需要经过三个阶段。这种方法虽然在病人护理方面取得了许多进展。然而,多阶段的临床检测过程需要大量患者,也要花费很多年的时间才能完成,因此成本极高,是科学知识迅速转化为临床进展的最大障碍之一。
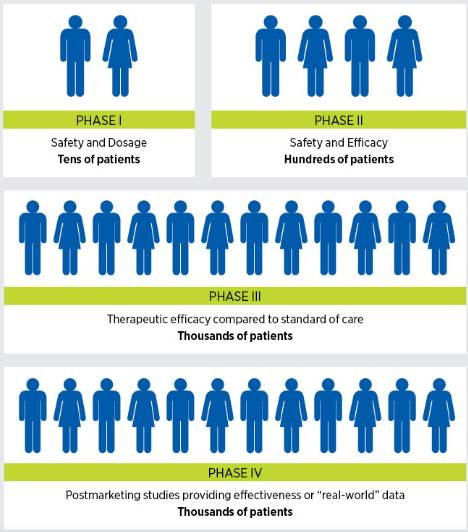
在过去的30年中,FDA已经做出了一些改进,改变了临床试验和审查方式,以减少从临床试验中获得明确结果所需的时间,包括开发四种循证工具的加速评估癌症等威胁生命的疾病的治疗方法。
随着对于癌症基因,分子和细胞变化的理解,目前开发除了越来越多的治疗剂,能更精确地靶向涉及癌症发生和发展的特定分子。分子靶向疗法往往比传统癌症治疗中的化疗和放疗更有效,毒性更低。
而分子靶向治疗的进展很大程度上要归功于癌症基因组学的发展。基因组是一个生物DNA编码的所有遗传信息的总和。肿瘤细胞中DNA序列上出现的突变是导致肿瘤细胞失控的重要原因。
针对涉及癌症过程的不同方面的分子的治疗剂比细胞毒性化学治疗剂更精确地靶向肿瘤内的细胞,由此限制对健康组织的损伤。现在对上万种癌症的遗传机制的了解已经深入到细微的分子水平。这些分子靶向治疗剂的更高的精确性倾向于使其比细胞毒性化学治疗剂更有效且毒性更低。因此,他们不仅拯救了无数癌症患者的生命,而且使这些人的生活质量也高于以前的癌症病人。
在2016年8月1日至2017年7月31日的12个月中,FDA批准了七种新的分子靶向抗癌药,还批准了四种先前批准的分子靶向抗癌疗法的新适应症。
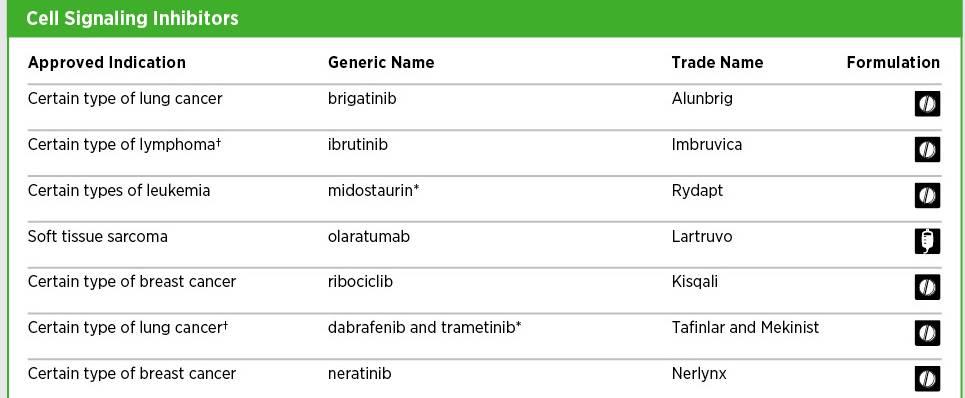
比如说依鲁替尼(Ibrutinib)靶向一种叫做BTK的蛋白质,它是促进免疫细胞B细胞存活和扩展的信号通路组分之一。2017年1月,FDA批准依鲁替尼用于治疗某些非霍奇金淋巴瘤患者,这种淋巴瘤在某些B细胞群中出现。该批准是基于II期临床试验的结果,显示依鲁替尼能让约50%疾病进展的患者肿瘤显著缩小。
下面介绍这一年中,FDA批准的一些分子靶向抗癌疗法。
米哚妥林与急性髓系白血病
急性髓系白血病(AML)是最常见的白血病类型,也是总体五年相对生存率最低的白血病类型,为27%。在过去的几十年里,它的治疗方法都没怎么变。一般分为两步,第一阶段是诱导期,包括细胞毒性化疗的强化过程,旨在使白血病进入缓解期;第二阶段被称为巩固阶段,它包括进一步的细胞毒性化疗或干细胞移植,其目的是保持白血病在缓解期。
但近年来的研究发现了促进白血病生长基因突变,AML中最常发生突变的基因之一是FLT3,这种形式的AML患者的预后特别差。这些研究的成果最终得到了30年来首个获得FDA批准的AML治疗药物,米哚妥林(midostaurin)。米哚妥林也是第一个被批准用于治疗AML的分子靶向治疗药物,它靶向几种被称为酪氨酸激酶受体的相关分子,包括FLT3和KIT。
在III期临床试验中显示,米哚妥林被批准用于AML治疗的诱导和巩固治疗阶段。与接受安慰剂治疗的患者相比,米哚妥林治疗的FLT3突变AML患者总体生存率提升了20%以上。
2017年4月,FDA还批准米哚妥林治疗成人患有的一种侵袭性罕见疾病,称为系统性肥大细胞增多症。在这种疾病的患者中,肥大细胞会在肝脏,脾脏,骨髓和小肠等内脏器官中蓄积。研究表明,大多数系统性肥大细胞增多症是由编码KIT酪氨酸激酶受体的基因突变引起的,而KIT酪氨酸激酶受体正是米哚妥林的靶点之一。
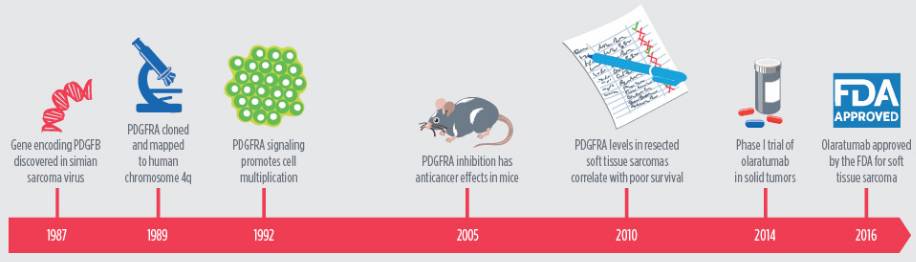
Olaratumab与软组织肉瘤
软组织肉瘤是一种罕见的肿瘤,虽然包括了来源于脂肪、筋膜、肌肉、纤维、淋巴及血管的70多种肿瘤,但其只占所有肿瘤发病率的1%。去年的闹得沸沸扬扬的魏则西事件,他所患的滑膜肉瘤是软组织肉瘤中的一种。转移性软组织肉瘤患者预后差,许多患者使用细胞毒性化疗药物多柔比星(单独使用或联合其他细胞毒性化疗药物)治疗,但即使如此,总体生存率也仅为12至16个月。
2016年10月,FDA加速审批了分子靶向治疗药Olaratumab(Lartruvo)治疗软组织肉瘤患者的申请。这些患者无法用放疗或手术治愈,通常会使用细胞毒性化疗药物如多柔比星治疗。
软组织肉瘤的治疗进展
这次进入快速通道的Olaratumab是靶向蛋白质血小板衍生生长因子受体-α(PDGFRA)的单克隆抗体。将其作为软组织肉瘤潜在治疗方法的基本原理来自许多研究,包括一项研究表明靶向PDGFRA在某些肉瘤的动物模型中具有抗肿瘤活性。
在II期临床试验中,纳入的患者包括25种以上转移性软组织肉瘤。结果显示,多柔比星联合Olaratumab的治疗将使中位总生存期延长近一倍(约140%)。有鉴于此,FDA决定加速Olaratumab的审批,现在进行的III期临床试验正在进一步评估分子靶向治疗的益处。
在其他诸如卵巢癌、乳腺癌、肺癌等癌症中,靶向分子治疗也起着巨大的作用。
癌症免疫治疗是通过释放病人免疫系统的力量来对抗癌症的方式,就像人们对抗流感病毒和细菌感染那样,但并非所有的免疫治疗都用同一种方式进行。
近年来,免疫疗法已经成为临床上最令人兴奋的癌症治疗新方法之一。一些经过免疫治疗的转移性癌症患者已经有了显着和持久的反应,提高了治愈可能性。而且,一些免疫治疗药物已被证明可以对抗越来越多种类的癌症。
阵容不断扩大的免疫检查点抑制剂
尽管已取得重大进展,但只有少数患者在接受FDA批准的免疫治疗时会出现显着且持久的疗效。另外,还没有一种FDA批准的免疫疗法是对于所有类型的癌症都具有高度活性。如何确定和增加免疫疗法的适用人群,这是一个目前大家都在关注的课题。
在临床试验中有多种方法可以对免疫治疗剂的效果进行评估,例如它们如何提高抗癌免疫细胞的杀伤力。另外还有些试验将FDA批准的免疫治疗与其他类型的抗癌治疗(放疗,细胞毒性化疗和分子靶向治疗)相结合。
随着这类研究的进行加深了我们对免疫系统的科学理解,以及它如何与癌细胞相互作用。以此为基础可以开发出许多新的免疫治疗药物,下面就介绍下已经被FDA批准的那些免疫治疗药物。
免疫检查点抑制剂
研究表明,免疫细胞中的T细胞天然能够破坏癌细胞,而一些肿瘤避免被T细胞破坏,就要具有高水平的蛋白质,附着在T细胞上并触“刹车”,阻止它们攻击癌细胞。这些在T细胞表面的刹车就被称为免疫检查点蛋白。研究人员据此开发出了释放T细胞刹车的免疫治疗药物,称为免疫检查点抑制剂。
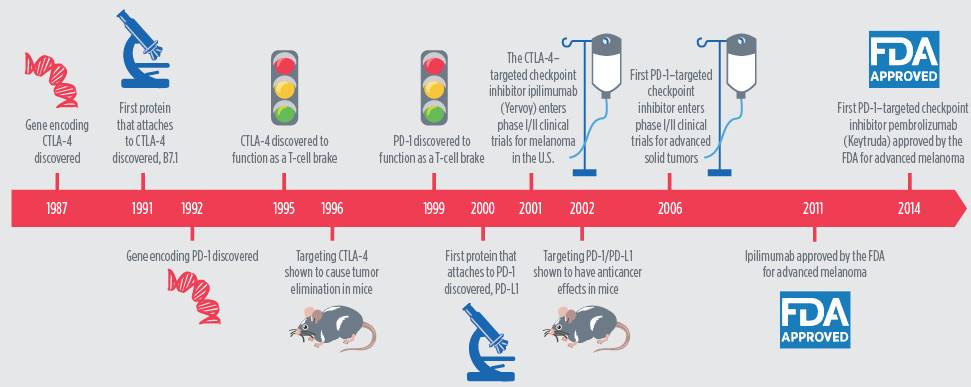
免疫检查点抑制剂的发展历程
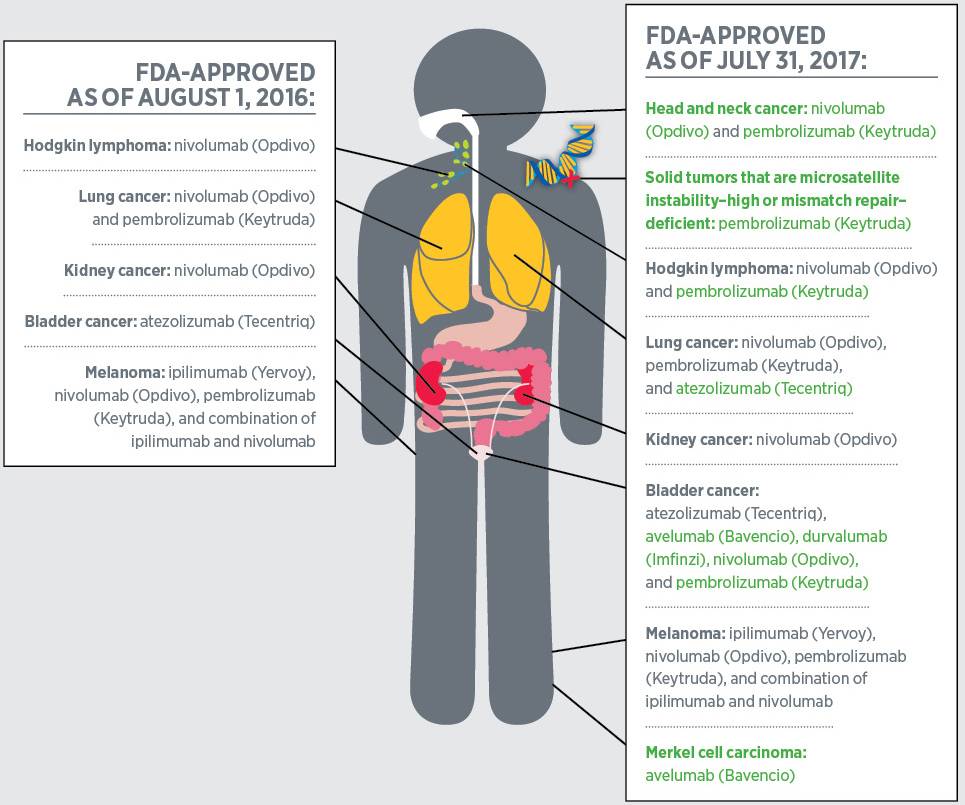
FDA批准的第一个检查点抑制剂是伊匹单抗(Ipilimumab),它针对免疫检查点蛋白CTLA4,保护其免受其他蛋白的影响。2011年3月,FDA批准伊匹单抗用于治疗某些转移性黑色素瘤患者。2015年10月,FDA扩大了伊匹单抗的使用范围,将其作为辅助疗法用于III期黑色素瘤患者,以降低手术后疾病复发的风险。
伊匹单抗成功后,研究人员开始将注意力集中于第二个检查点蛋白PD-1以及其附着蛋白PD-L1上。FDA在2014年9月首次批准针对PD-1或PD-L1的检查点抑制剂派姆单抗(Pembrolizumab)用于某些转移性黑素瘤患者的治疗。
从2016年8月1日至2017年7月31日,FDA批准了两项新的针对PD-1/PD-L1检查点抑制剂,还大大扩展了3个以前批准的PD-1 / PD-L1检查点抑制剂的适用范围。比如2017年5月加速批准派姆单抗用于治疗携带微卫星高度不稳定性(MSI-H)或错配修复基因缺陷(dMMR)的成人和儿童实体瘤患者。
这些生物标志物存在于许多种癌症之中,包括结直肠癌、子宫内膜癌和胃癌。截至2017年7月31日,这也是唯一一个获得FDA批准基于常见生物标志物的抗癌治疗药物,而之前的抗癌药物都是基于癌症发生的位置。
2017年3月,FDA新批准了针对PD-L1的新型检查点抑制剂Avelumab(Bavencio)用于治疗一种罕见皮肤癌,默克细胞癌。在II临床试验中,约30%纳入患者的肿瘤缩小了。Avelumab也成为FDA批准的第一个默克细胞癌的治疗药物。
2017年5月,FDA批准的第二个PD-L1检查点抑制剂是Durvalumab(Imfinzi),用于治疗膀胱癌中最常见的尿路上皮癌。II期临床试验中,16%患者的肿瘤缩小,并且Durvalumab对于局部晚期或转移性尿路上皮癌也有疗效。
这里介绍的都是已经成功的临床试验,现在还有很多PD-1 / PD-L1试验的结果尚不明确。不过初始数据表明,帕母单抗可能对一些胃癌或间皮瘤患者有效;纳武单抗可让一些肝癌患者受益。
CAR-T治疗
CAR-T疗法虽然也是一种免疫治疗,但路子与免疫检查点抑制剂截然不同。CAR-T治疗先通过逆流离心的方法来富集人血液中的淋巴细胞。再将淋巴细胞在体外培养环境中接受特定抗原刺激,并通过病毒载体导入编码CAR或TCR的基因片段。
然后把这些淋巴细胞放在生物反应器中进行分裂增殖,当其数量达到一定值时清洗掉没有表达CAR或TCR的T细胞。而筛选出的细胞经过浓缩及质量检查后才可注回到患者体内。对,这完全是个体化的服务,你的T细胞只有自己能用。
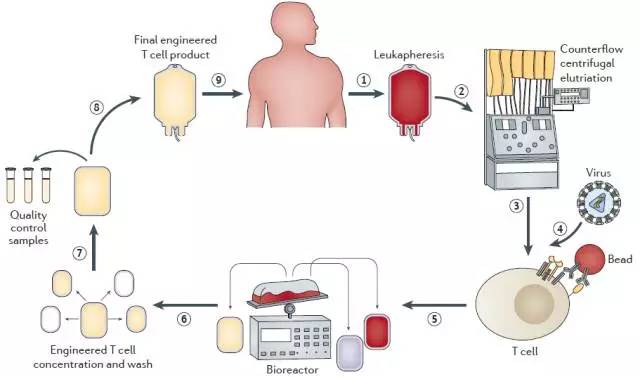
今年FDA批准了两个CAR-T治疗方案,8月的Kymriah(Tisagenlecleucel)用于儿童和年轻成年患者急性淋巴细胞性白血病(ALL)。治疗方案是将病人的T细胞改造为能识别B细胞淋巴瘤和白血病细胞表面抗原CD19的一类被激活的CAR-T细胞。这类CAR-T细胞通过自分泌的细胞因子能促进自身的增殖分化同时对肿瘤细胞具有溶解功能。
它的安全性和有效性在一项针对复发性或难治性B细胞ALL的儿科和年轻成人患者的多中心临床试验中得到证实。治疗三个月内的总体缓解率为83%。














