1月9日,西湖大学生命科学学院郭天南课题组与华中科技大学同济医学院附属协和医院合作团队合作,
在《细胞》期刊在线发表最新研究论文,报道了新冠肺炎死亡患者体内多器官组织样本中蛋白质分子病理全景图。

该研究是全球范围内第一次对新冠患者多个关键器官做从蛋白质组学上的系统分析。这为新冠的后续治疗、药物研发及病理机制研究提供了宝贵的数据。
新冠死亡患者5336个蛋白质表达显著改变
新冠病毒对人类健康巨大危害在于,它可以损伤不限于肺部的重要脏器,如肝、脑、肾、心脏等,造成急性的、严重的并发症。即便是已经转阴性的出院患者,据最新的研究报道,依然会并发在住院期间并未发生的肾脏疾病。
可见新冠病毒对于人体重要脏器的损害具有隐匿性和持续进展性。
详情见网期文章
1733例金银潭新冠患者随访:超七成半年后至少有一种症状
。
该研究收集了19例新冠肺炎死亡患者的
肺、脾、肝、心脏、肾脏、甲状腺和睾丸
等在内的七种器官的组织样本。首先进行病理学检查,然后进行蛋白分子的研究。
共鉴定了11394个人源蛋白质分子
,绘制出新冠肺炎死亡患者的多器官蛋白分子全景图。
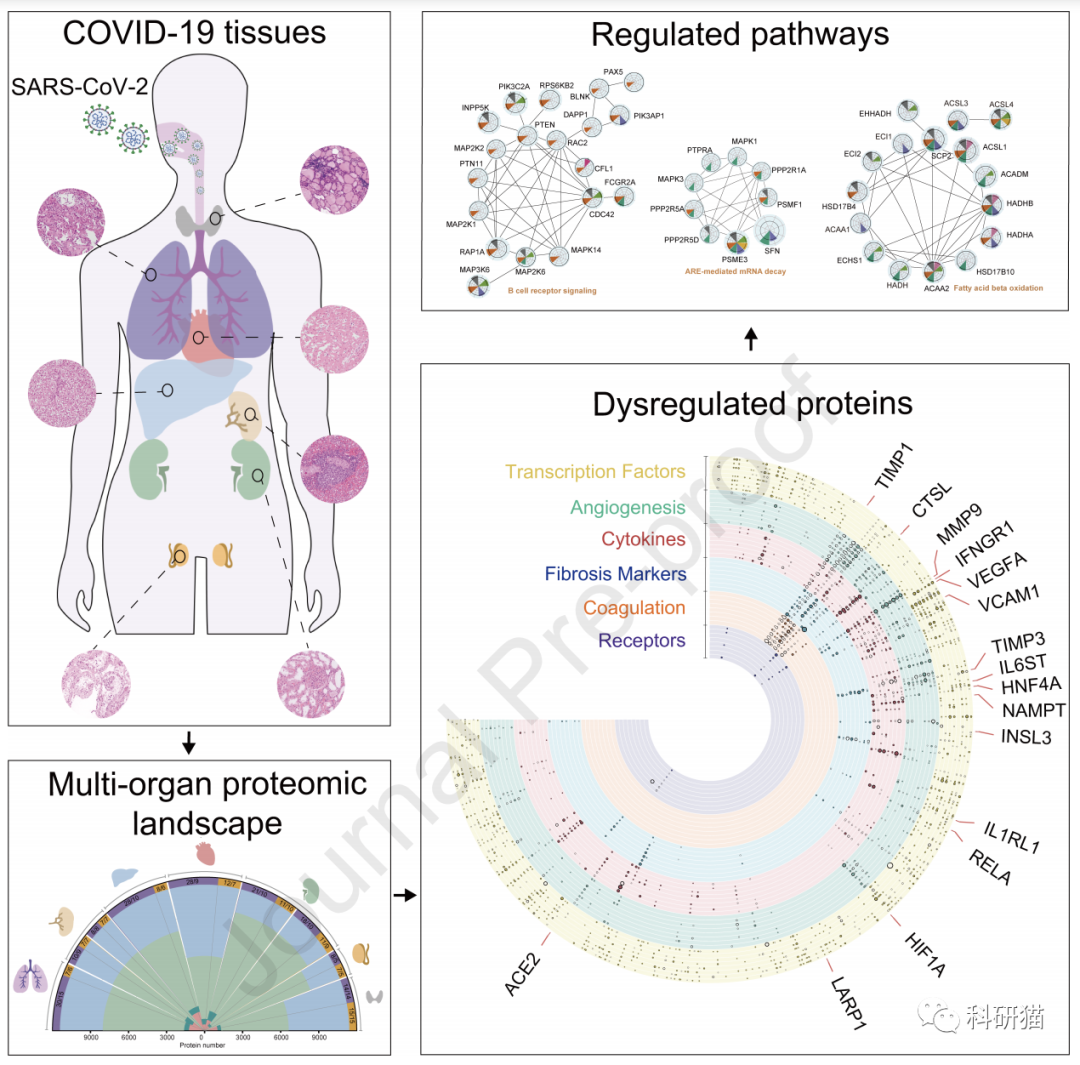
在与非新冠患者的对照组比较中发现,新冠肺炎死亡患者的组织样本中有
5336个蛋白质表达发生了改变
。
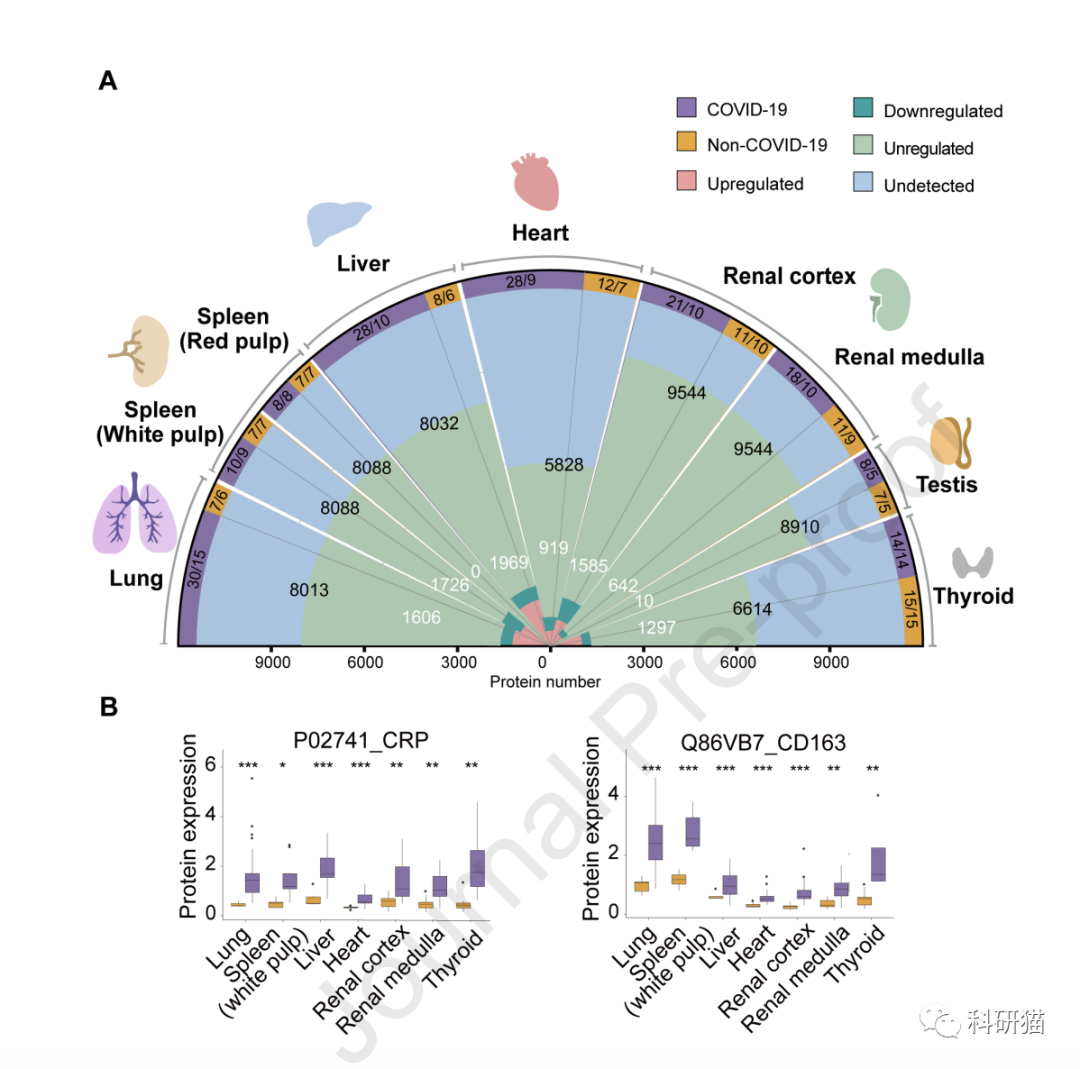
在七类器官中,蛋白表达改变最不明显的是脾脏红髓,而改变的蛋白数量最多(1970个)的是肝脏。暗示了新冠感染重症死亡患者的肝脏受累严重。
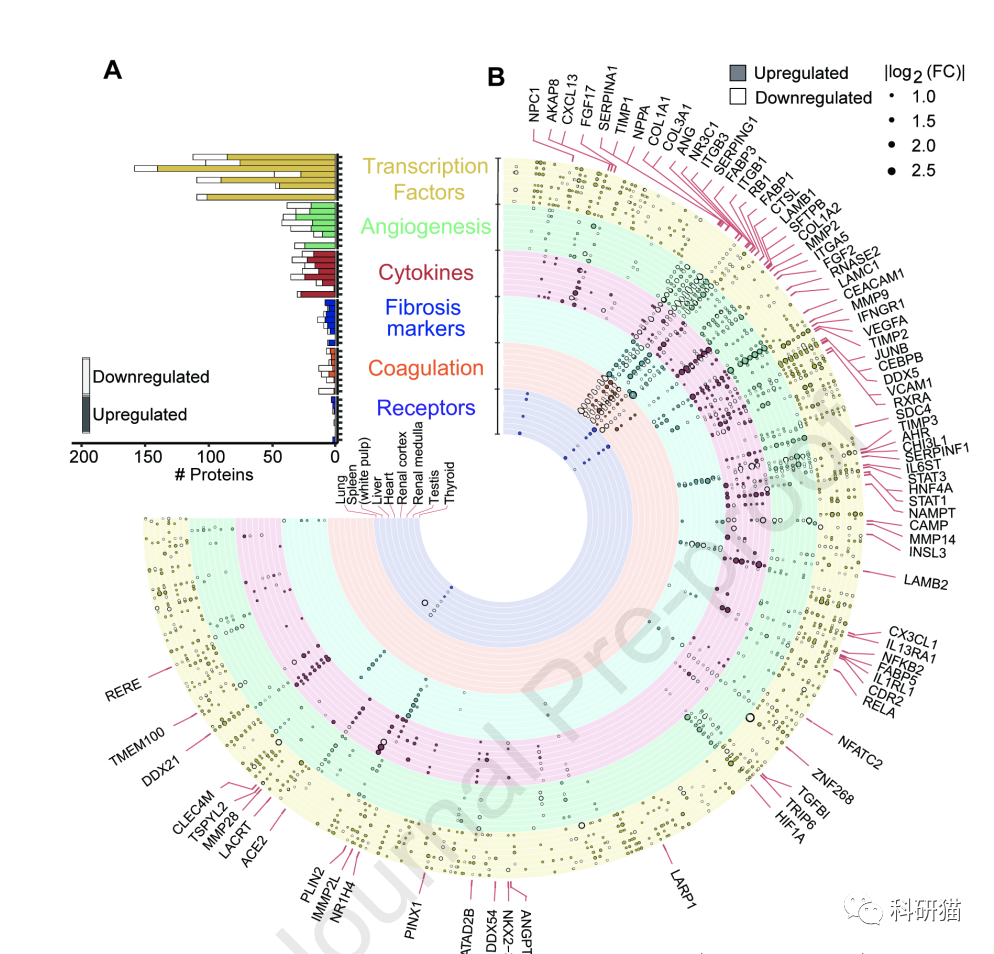
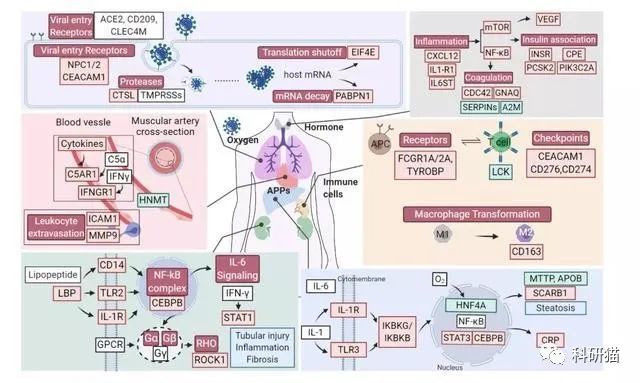
自新冠爆发以来,
ACE2蛋白
就成为「全明星分子」,中文全称病毒受体血管紧张素转化酶2。
因在新冠病毒感染人体细胞的过程中,ACE2是新冠病毒的膜上结合受体,与病毒和宿主细胞的融合、入侵过程密切有关。ACE2又被大家称为新冠病毒进入人体的“罪魁祸首”。
它
是人类血管紧张素转换酶(ACE)同源物,是一种锌金属蛋白酶,属于1型跨膜蛋白,ACE2最初被认为只在心脏、肾脏和睾丸中表达,后面发现在肺、大脑和消化道中也广泛表达。
这是新冠病毒具有多器官损害毒性的分子基础。
显而易见,研究团队会在两对照组之间进行该分子的比较。但,超出意料的是,ACE2在新冠与非新冠病人的器官中表达并无显著差别。反而是,帮助病毒进入细胞相关的
组织蛋白酶L(CTSL)
,在新冠病人肺部表达明显升高。
这提示,CTSL作为治疗靶点的效果可能会更好。
除了肺部,肝、肾也出现纤维化先兆
此后,研究团队进一步对多种器官的生理功能、病理形态与蛋白质组学进行系统比较研究,发现多个肺部蛋白出现改变,包括与病毒增殖相关、参与肺纤维化病理过程及降解病毒限制因子的蛋白。
从临床病理学来看,虽然肺部发生了肉眼可见的(影像辅助下)纤维化病变,但蛋白组学结果却表明,
在肝脏、肾脏等器官也观察到组织纤维化的蛋白表达变化。
对于感染新冠的男性,报道生殖腺功能和结构异常的病例已不在少数。此次研究显示,死亡患者的睾丸组织中有10个蛋白表达改变,功能富集分析显示,这些蛋白多与胆固醇合成抑制、精子活性降低和Leydig细胞特异标记物减少紧密相关。
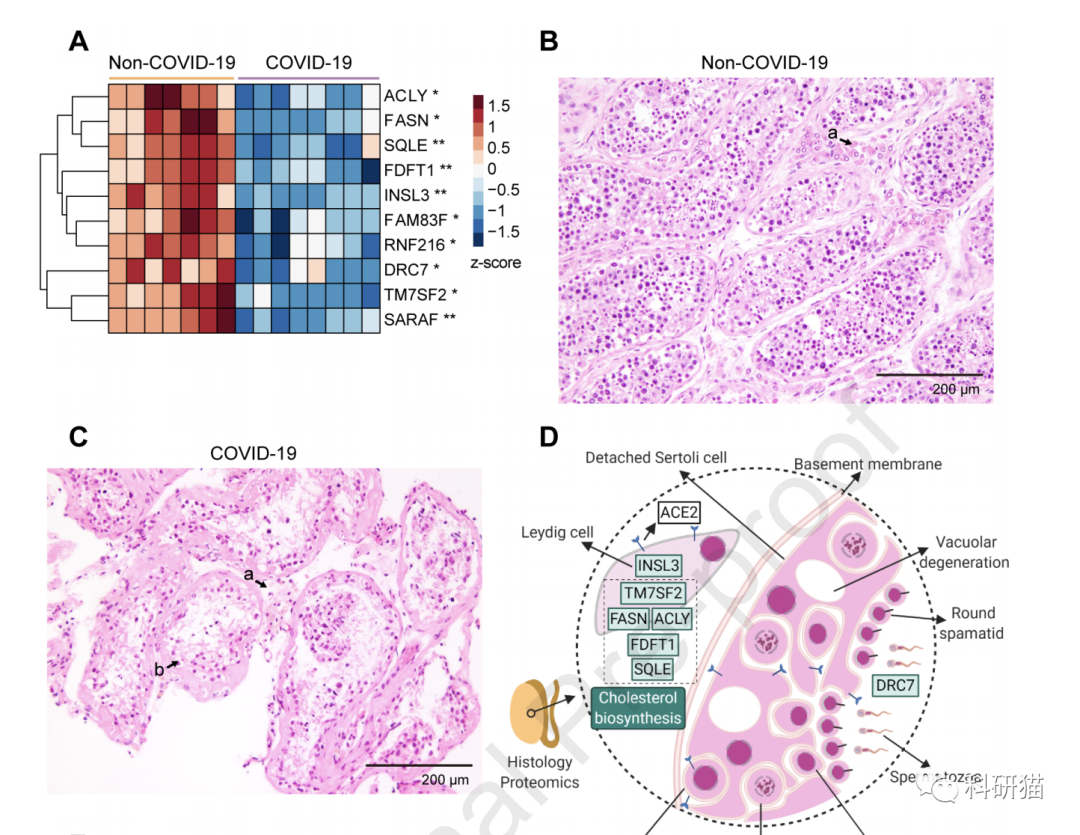
该研究是基于新冠肺炎死亡患者,即病情严重、多器官受累的患者,该蛋白图谱是否适用于轻症、无症状感染者还需要进一步对该群体的研究来说明。
对于肝、肾的非实质性纤维化样蛋白改变,重症患者是否有必要提前进行诊断、检测和治疗;CTSL一直以来受到的关注度不及ACE2,该研究却提示了其异常的高表达。可见,对于新冠肺炎病毒,多学科、多角度和多种技术手段的联合研究是非常必须的。我们对于这种席卷全球,感染近1亿人的超级病毒,还是知之甚少。
总之,该研究提示了我们,新冠肺炎病毒致病的隐匿性,以及非「明星分子」的关键作用。






