正文
对于1型和部分2型糖尿病患者而言,长期注射胰岛素并配合血糖监控是必须的治疗手段。然而,这类疗法不仅会给患者带来极大的痛苦,还可能会导致低血糖等并发症。
David Rawlings博士(来源:Seattle Children's)
在过去10年的大部分时间里,西雅图儿童研究所免疫疗法中心主任David Rawlings博士一直在朝着一个梦想努力,开发一种用于治疗I型糖尿病的新疗法,使患者不再需要每天注射胰岛素。这种新疗法旨在通过利用人体的免疫细胞来“关闭”导致儿童1型糖尿病发展的破坏性免疫反应。
随着最新研究成果的披露,以及新资金的注入,这个梦想离实现又近了一步。
Rawlings博士的研究聚焦免疫系统中对抗疾病的T细胞。在1型糖尿病中,效应T细胞会错误的攻击胰腺中产生胰岛素的β细胞。一旦被“不受约束”的效应T细胞破坏,β细胞就不再能释放胰岛素,血液中的葡萄糖水平不断升高,就会导致糖尿病的早期症状,如尿频、干渴、饥饿和极度疲劳。而效应T细胞之所以会持续攻击β细胞,是因为免疫系统的另一组成——调节性T细胞(Regulatory T cells,Treg)未能正常工作。
“一个健康的免疫系统需要调节性T细胞(
Treg
)来平衡效应T细胞的攻击。调节性T细胞会告诉效应T细胞’冷静下来’,限制对胰腺等组织的伤害。”Rawlings博士解释道。
由于Treg数量不足或功能缺陷与多种自身免疫性疾病有关,因此很多团队希望借助Treg开发细胞疗法来自治疗1型糖尿病等疾病,但这一想法和临床应用之间存在许多障碍,比如,外周血中Treg数量很少,纯化困难,在体外将Treg扩增到治疗级的数量同时维持其抑制功能具有挑战性。此外,回输后Treg的存活和增殖也存在问题。
在这项新研究中,Rawlings博士实验室
设计了一种靶向、高效的基因编辑策略来工程改造患者自身的T细胞,使得改造后的T细胞能够像正常调节性T细胞(Treg)一样起作用。
研究小组希望,当被回输到患者体内后,这些被编辑过的调节性T细胞样细胞(edited regulatory-like T cells,
edTreg
)能够进入胰腺,帮助抑制过度激活的免疫反应,维持和保护β细胞的功能。
来源:Science Translational Medicine
6月3日最新发表在Science Translational Medicine杂志上的一篇论文报道了Rawlings博士及其合作者如何利用基因编辑技术靶向人类T细胞中的
FOXP3
基因。FOXP3全称为Forkhead box protein 3,是一种转录因子,驱动了Treg的抑制活性。研究小组通过HDR( homology-directed repair )在原代人CD4+ T细胞的内源性FOXP3位点引入了一个强启动子,使FOXP3高量稳定表达,从而使得CD4+T细胞能够特化为Treg。
基因编辑使FOXP3在原代人类CD4+外周血细胞中稳定表达(来源:Science Translational Medicine)
经过这种方法产生的edTreg的表型和细胞因子特征与天然的Treg
(纯化的外周血Treg)
非常相似。在动物模型和组织培养的测试中,edTreg也表现出了与天然Treg相似的功能,
显示出了强大的免疫抑制功能,
在异种移植物抗宿主病模型和实验性自身免疫性脑炎模型中被证明可发挥作用。
edTregs在人源化小鼠模型中改善了异种移植物抗宿主病的严重程度(来源:Science Translational Medicine)
研究还证实,edTreg可使用临床相关方法进行
大规模扩增
,
克服了外周血来源的Treg分离和扩增的局限性。
体外临床级扩增或选择后edTreg的特征(来源:Science Translational Medicine)
“这些数据提供了
首个证据
,证明通过启动FOXP3足以制造出功能上类似Treg的细胞产品。这不仅是一项里程碑式的研究发现,而且有潜力向临床应用转化。”Rawlings博士说道。
除了“编辑”FOXP3基因,研究者们还证明他们能够使得这种工程T细胞具有抗原特异性。这是通过将一种T细胞受体(T cell receptor,TCR)附着在工程细胞表面来实现的。TCR是T细胞特异性识别和结合抗原肽-MHC分子的分子结构,通常与CD3分子呈复合物形式存在于T细胞表面。因此,这一设计对于edTreg能够靶向进入糖尿病患者的胰腺中至关重要。
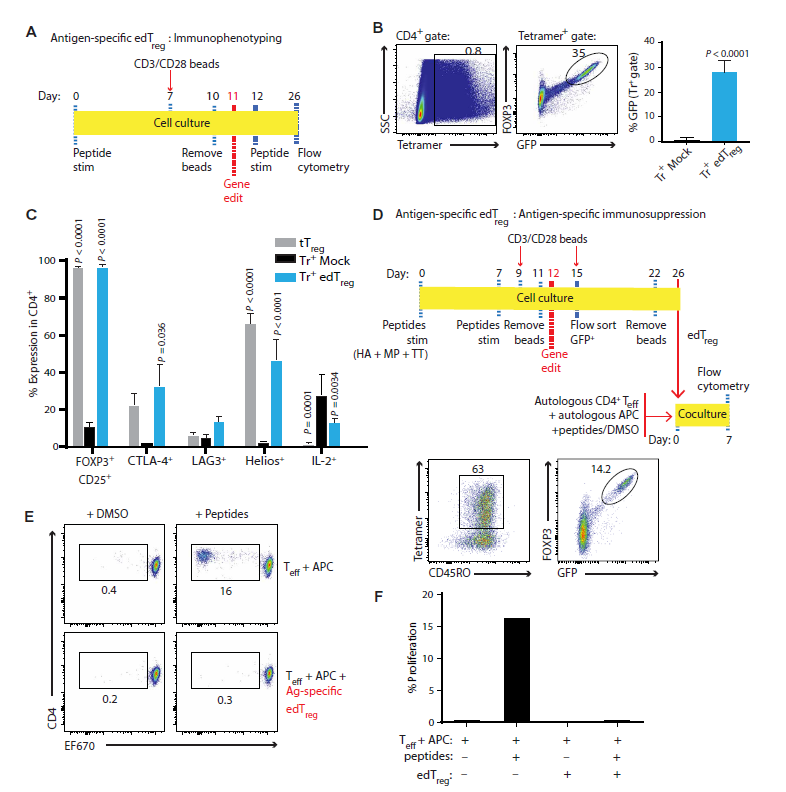
抗原特异性人类edTreg的产生及其对CD4+效应T细胞增殖响应的抑制(来源:Science Translational Medicine)
下一阶段,研究小组将进一步调整用于edTreg的T细胞受体
(最佳的T细胞受体可将edTreg引导到胰腺中,并使得这些细胞发挥它们的保护活性,且对大多数1型糖尿病患者都有效)
,并改进被用于临床的edTreg的生产工艺。
研究人员认为,进一步验证这些结果的研究将有助于为1型糖尿病细胞治疗的I期临床试验铺平道路。
Rawlings博士乐观地认为,最新的资助将使他们有机会完成临床前研究以及向FDA递交IND申请所需的研究。他说:“与其它在研Treg疗法相比,我们的技术有着潜在的优势。领域内有一些人质疑我们的方法是否真的能起作用,令人欣慰的是,我们的研究不仅证明它能起作用,而且将继续产生数据,证明edTreg在治疗和预防1型糖尿病方面有多出色。”
相关论文:
[1]
Yuchi Honaker et al. Gene editing to induce FOXP3 expression in human CD4+ T cells leads to a stable regulatory phenotype and function. Science Translational Medicine(2020).
参考资料:
1#
Engineered T cells for type 1 diabetesmove closer to clinic(来源:Seattle Children's Research Institute)

点亮“在看”,好文相伴






