
细胞中关键的生化过程发生在由磷脂层包裹的囊泡区室内或囊泡膜上,这些区室促进隔离水腔中的专门活动,有助于物质运输、维持生命的代谢和物质储存。天然囊泡由脂质层组成,脂质层形成膜以包裹内部物质。与脂质基和膜包裹的囊泡不同,无膜的液滴状隔室是由液-液相分离(LLPS)形成的,并通过生物分子之间的多价相互作用凝聚而成。
受囊泡隔室的启发,来自浙江大学顾臻教授、李洪军研究员联合中国医科大学附属第一医院刘福囝教授
描述了一种基于核酸-蛋白质复合物的LLPS囊泡组装体,其中自组装发生在用胆固醇(Chol-ssDNA)和组蛋白修饰的单链DNA(ssDNA)的特定成分上(图1)。作者已经证明这种凝聚层囊泡被高密度层包裹和稳定。凝聚层囊泡可以有效地隔离生物药物并在温和条件下保持其生物活性,并增强其在体外和体内的递送效果。
相关研究成果以
“Coacervate vesicles assembled by liquid–liquid phase separation improve delivery of biopharmaceuticals”
为题于2025年1月13日发表在
《Nature Chemistry》
上。
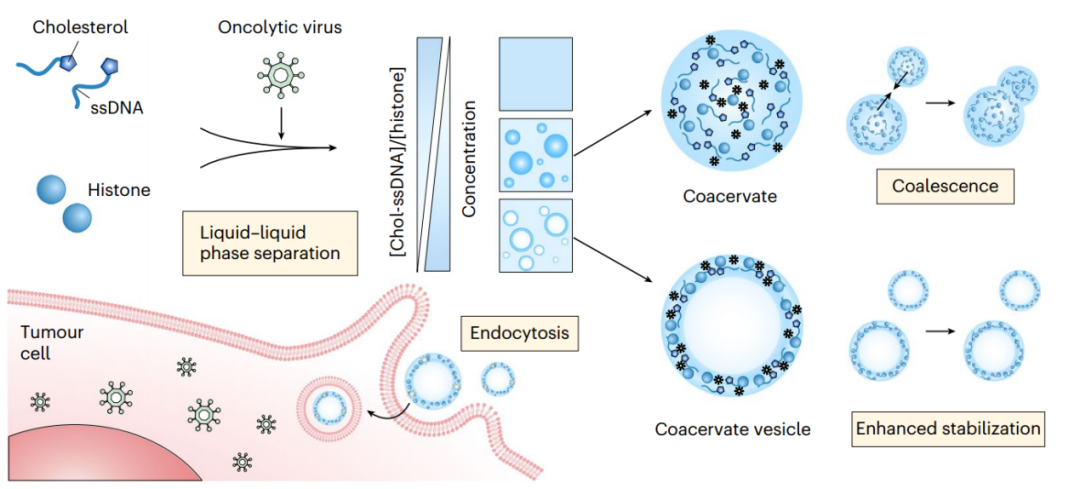
图1 用于生物制药输送的凝聚层囊泡的构建
1.凝聚囊泡的制备及表征
在真核细胞中,基因组DNA和核蛋白可以通过相分离介导压缩成无膜异染色质结构域。因此,作者应用组蛋白和Chol-ssDNA来确定其是否在体外发生相分离。
通过系统的研究,在不同比例和浓度的组蛋白和Chol-ssDNA下观察到三种不同的相状态,包括均质溶液(SOL)、凝聚层液滴(COA)和以低密度腔为特征的凝聚层囊泡(CV)(图2a-d)。与密度均匀的凝聚层不同,CV的内部核心似乎充满了水性介质,而外部边缘则代表高密度层(图2c、d)。使用三维重建图像和荧光强度分析来验证内部分子分布,随后确定为Chol-ssDNA和组蛋白的混合物(图2c、e)。作者还使用了SEM(图2d)来确认COA和CV的精细亚结构。Chol-ssDNA-组蛋白层包裹的核心是低密度相,脱水后转变为空腔(图2d)。CV为微米级组装体,稳定状态下直径约为1.82 µm(图2f、g)。光密度分析表明COA的凝聚程度高于CV(图2h)。
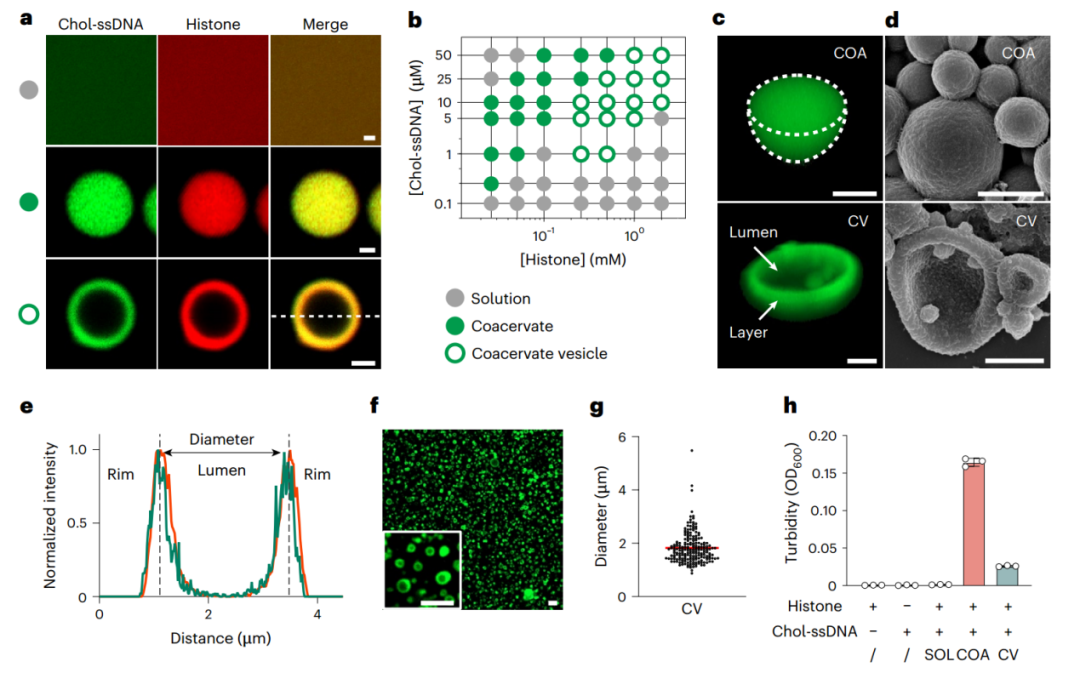
图2 基于Chol-ssDNA组蛋白的凝聚层囊泡的表征
2.凝聚层囊泡的LLPS特性
作者使用光漂白后荧光恢复(FRAP)过程评估凝聚相的动态行为。与COA(100秒几乎完全恢复)相比,CV的恢复时间延长(1,200 秒为一半恢复)(图3a、b),这意味着由于凝聚相的囊泡化导致分子动力学降低。此外,还评估了融合事件以进一步研究LLPS 特性(图3c)。融合行为表明,两个单个COA液滴表现出快速(180秒)的融合过程,表明COA具有高流动性。相反,CV在观察期间没有融合,反映了相分离层提供的更高稳定性(图3d)。使用带有5 µm聚苯乙烯胶体探针的原子力显微镜来量化 LLPS 组件的界面力学(图3e)。
综合结果表明,固有的弱分子间相互作用和增强的分子间相互作用分别控制着COA和CV的LLPS过程
。此外,作者还发现CV的LLPS过程与电荷有关(图3g)。
通过在LLPS过程中添加病毒(ad11)、双链DNA(dsDNA)、信使RNA、肽(LTX-315)和细胞因子(白细胞介素2,IL-2)进一步探索凝聚相的募集能力。负载货物和Chol-ssDNA之间的荧光信号共定位证实了LLPS载体的成功募集和多功能性(图3h)
。为了全面衡量生物药物的生物活性,将ad11-GFP(感染后表达绿色荧光蛋白的工程ad11)、LTX-315和葡萄糖氧化酶与CV结合。它们的功能(包括GFP 表达、细胞毒性和酶活性)随时间保持不变,这意味着CV封装可以保留生物药物的生物活性(图3i、j)。此外,还研究了用外部刺激处理或富含ad11、dsDNA、mRNA、LTX-315和IL-2的CV的稳定性。通过溶液浊度和CLSM鉴定,COA和CV结构在很宽的温度、pH 值和某些盐浓度范围内相对稳定(图3k)。
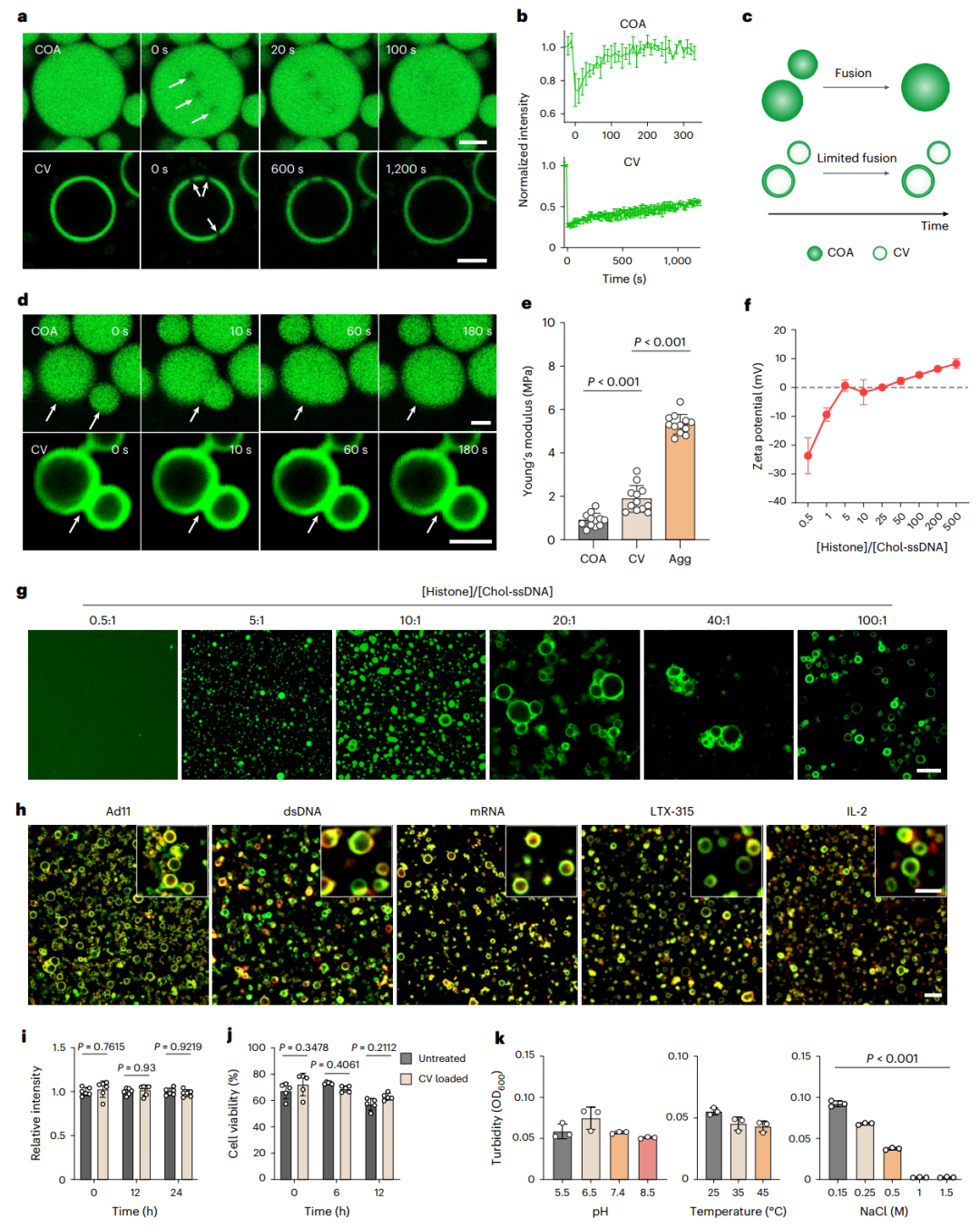
图3 凝聚层囊泡的物理化学特性
3.负载ad11的凝聚层囊泡的表征
接着,作者进一步评估了相图中不同LLPS组装条件的负载能力。Ad11可以以高负载效率(平均约86.2%)封装在COA或CV中,如CLSM图像中观察到的(图4a),并通过定量聚合酶链反应(qPCR)结果进行量化。关于空间分布,发现ad11与Chol-ssDNA和组蛋白共定位,在COA和CV层的凝聚液相中高度富集(图4a、b)
。
为了确保定位准确性,通过 SEM、透射电子显微镜(TEM)和低温TEM成像重新确认了ad11粒子在SOL、COA和CV中的分布(图4c、d)。在ad11-COA和ad11-CV条件下,ad11主要富集在凝聚液相中(图4d),这进一步通过ad11在COA球体和CV层表面的吞噬得到验证(图4c)。
接下来,使用CLSM和浊度测量对加载ad11后的性能进行研究。具体而言,在37°C下孵育48小时后,几乎无法辨别出ad11-CV的融合活性,而ad11-COA的不规则结构是由液滴之间的聚结引起的(图4e)。同样,ad11-COA溶液从浊度到澄清的转变证实了ad11-COA的稳定性较差(图4f)。与孵育48小时后几乎澄清的ad11-COA溶液相比,ad11-CV混合物仍然浑浊(图4g)。
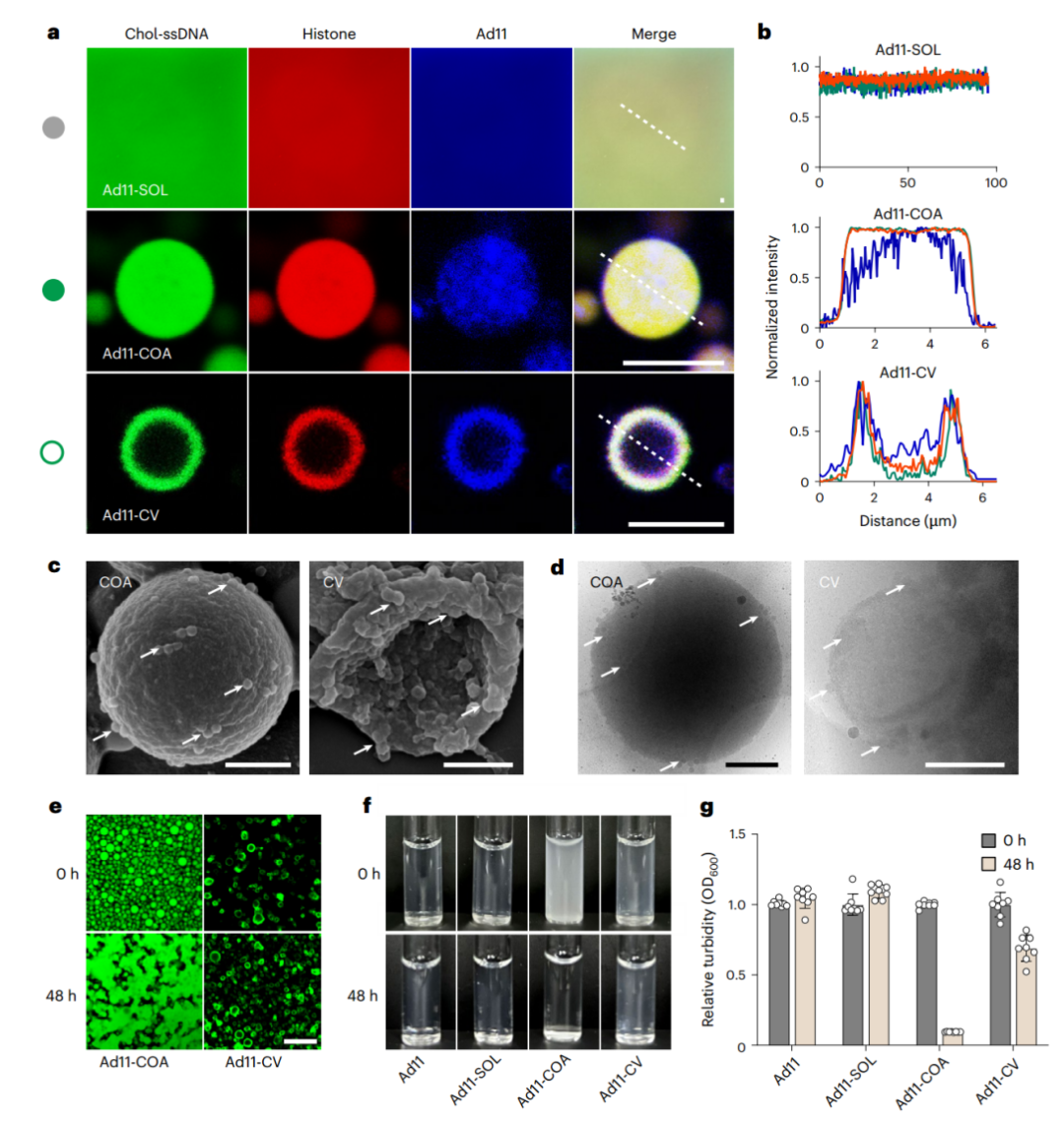
图4 溶瘤腺病毒通过凝聚囊泡募集
4.CV包装增强ad11的细胞内化
尽管成功吸收了ad11,但LLPS组装体的主动细胞吸收是有效病毒传递的关键因素。此后,进一步应用ad11-COA和ad11-CV来证明TC-1细胞系的自发细胞内吸收。
为了详细探究细胞吸收对病毒结合受体(如CD46)的依赖性,还涉及另一个细胞系TC-1-hCD46(过表达人源CD46受体)。通过CV封装后,无论CD46过表达(依赖性)还是不表达(独立性),ad11的内化都会增强,如细胞质中强大的ad11荧光信号(图5a)和流式细胞术分析(图5b、c)所示。
根据LLPS组装体的稳定性测定和表面电荷分析(图4e),ad11-CV的相对稳定性和带正电的表面为促进细胞摄取效率提供了可能性。用ad11、ad11-COA和ad11-CV处理的受体非依赖性和受体依赖性细胞切片的TEM图像显示这些结构在细胞质内分散(图5d)。此外,为了确定ad11-CV增强作用在多种细胞系中的普遍性,作者评估了Hep1-6、4T1、B16F10、C1498和GL261细胞系中ad11的摄取量。与ad11-CV孵育后,所有测试细胞均能吸收高水平的ad11,吸收效率分别比游离ad11处理组高 48.0倍、36.8倍、39.0倍、4.3倍和32.1倍(图5e)。
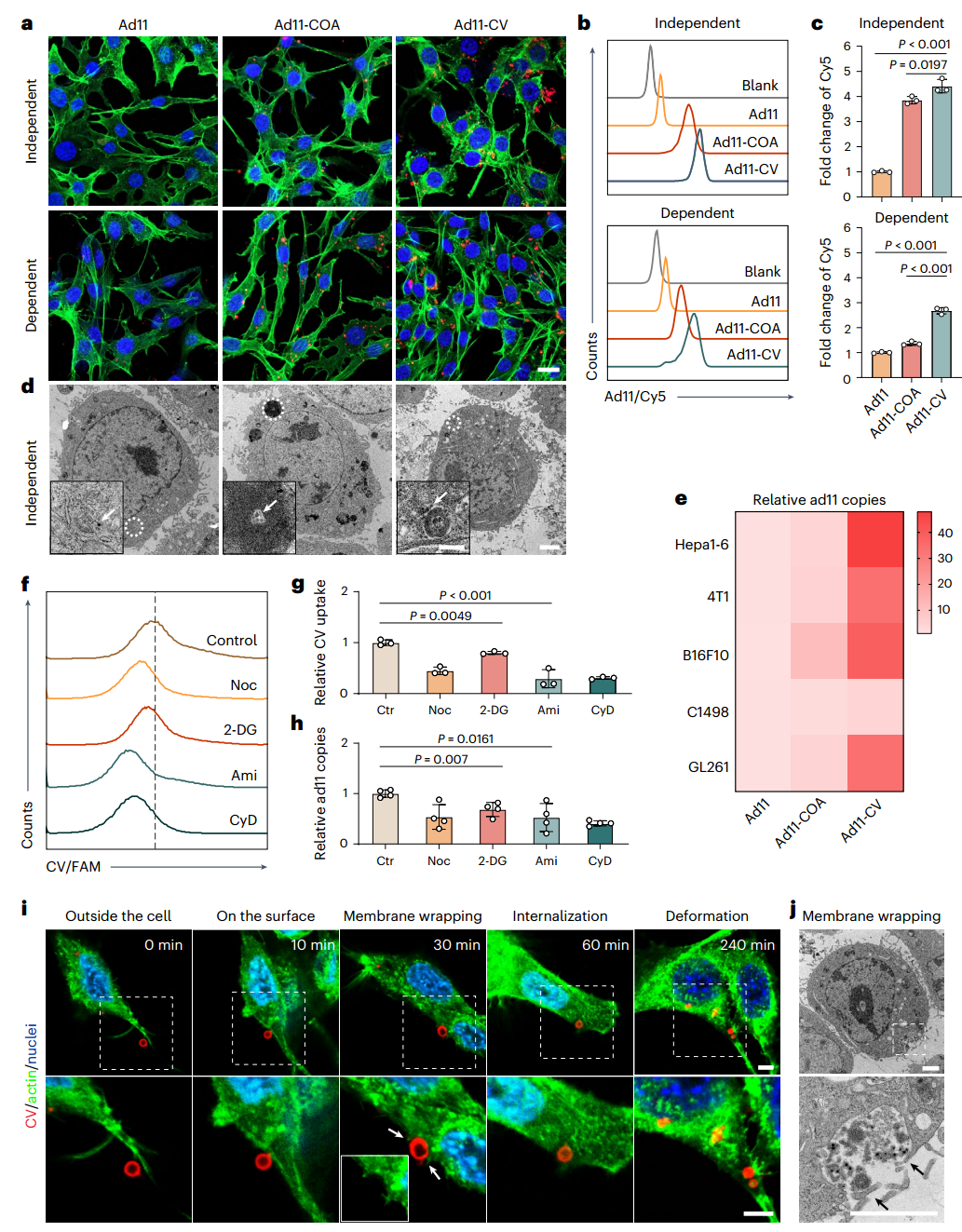
图5 TC-1(独立)细胞和 TC-1-hCD46(依赖)细胞对ad11-CV的细胞吸收
5.ad11-CV对体内肿瘤模型的溶瘤作用
基于体外高细胞进入效率,在异种移植肿瘤模型中评估了体内肿瘤病毒治疗的可行性。首先,验证了瘤内注射后病毒的体内分布和肿瘤驻留情况。将不同配方的Cy5标记的ad11注射到瘤内,并在注射后48小时分析ad11的空间分布。
Ad11-CV留在肿瘤部位,而游离ad11的踪迹变得可以忽略不计,表明CV可以促进ad11在肿瘤部位的驻留(图6a)。进一步的离体荧光成像和相应的定量分析显示,与ad11和ad11-COA 治疗组相比,ad11-CV组的病毒保存率最高。同样,肿瘤切片证实了ad11-CV的肿瘤驻留。ad11-CV处理的肿瘤组织在48小时后显示出明显的荧光,而游离ad11则没有荧光(图6b)。通过qPCR分析进一步定量了肿瘤中ad11的含量,结果与上述结论一致(图6c)。其次,在TC-1异种移植瘤C57BL/6J雌性小鼠模型上评估了浓缩相负载ad11的体内抗肿瘤效果(图6d)。ad11-CV疗法显著减缓了肿瘤生长并延长了小鼠的生存时间,显示出最高的抗肿瘤效果(图6e-h)。
结果表明,ad11-CV疗法能够显著提高病毒驻留率、调节免疫反应和增强抗肿瘤疗效方面具有优异的效果
。

图6 ad11-CV对皮下TC-1肿瘤的体内免疫反应和溶瘤作用
本文报道了一种由胆固醇修饰的DNA和组蛋白的液-液相分离形成的凝聚层囊泡。与基于磷脂的膜结合囊泡不同,凝聚层囊泡表面没有膜结构,由高密度液体层和充满水的腔体组成。通过简单的凝聚过程,证明各种生物因子,包括病毒颗粒、mRNA、细胞因子和肽,都可以无害地直接在液相中富集。与容易出现聚集问题的液滴状凝聚层相比,凝聚层囊泡表现出优越的动力学稳定性,使其成为生物制药的多功能运载载体。结果证实,将溶瘤病毒整合到这些凝聚囊泡中可赋予它们强大的溶瘤功效,并在小鼠模型中引发强大的抗肿瘤免疫反应
。
参考资料
:
https://doi.org/10.1038/s41557-024-01705-8
来源:
EngineeringForLife
声明:仅代表作者个人观点,作者水平有限,如有不科学之处,请在下方留言指正!






