

摘 要:
倍半萜类化合物是苍术属植物的主要活性成分之一,从苍术属植物根茎中分离得到的倍半萜类化合物按骨架类型可分为桉叶烷型、愈创木烷型、香根螺烷型和艾里莫酚烷型
4
种,以桉叶烷型为主。苍术属倍半萜类化合物具有广泛的生物活性,包括抗炎、抗肿瘤、保护神经系统、保肝、抗菌和抗病毒等活性。总结了苍术属植物中倍半萜类化合物化学成分的结构特点和生物活性,为该属植物深度开发利用提供参考。

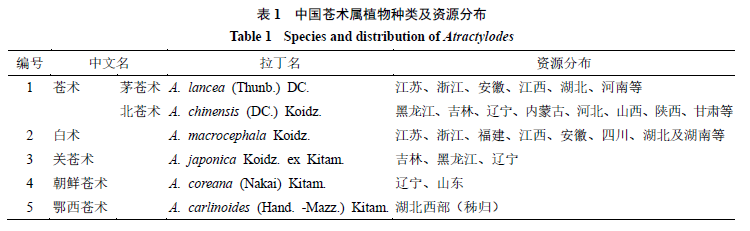
苍术属
Atractylodes
DC.
为菊科多年生草本植物,苍术属植物约有
7
个种,主要分布在亚洲东部地区,在我国有
5
个种
[1]
。《中国药典》
2020
年版中规定苍术为茅苍术
Atractylodes
lancea
(Thunb.)
DC.
或北苍术
A. chinensis
(DC.)
Koidz.
的干燥根茎
[2]
。苍术属植物在我国分布较广,种类及资源分布见表
1
,
除鄂西苍术根茎不发达不作药用外,其他苍术属植物均以根茎入药,可作药用。倍半萜类化合物是苍术属植物的主要化学成分之一,种类繁多、结构多样、药理活性广泛。目前发现苍术属植物中倍半萜类化合物具有抗炎、抗肿瘤、保护神经系统、保肝、抗菌、抗病毒等药理作用。近年来,苍术属下级各植物的倍半萜类化合物的研究受到了国内外学者的广泛关注,尤其对茅苍术和白术的研究较多,但对
整个苍术属植物倍半萜类化合物的结构及生物活性的系统性归纳总结尚显欠乏。本文对苍术属植物倍半萜类化学成分的分类、来源、结构、药理作用等研究现状进行综述,重点总结了该属植物中倍半萜的种类和药理活性方面的研究进展。
1
化学结构
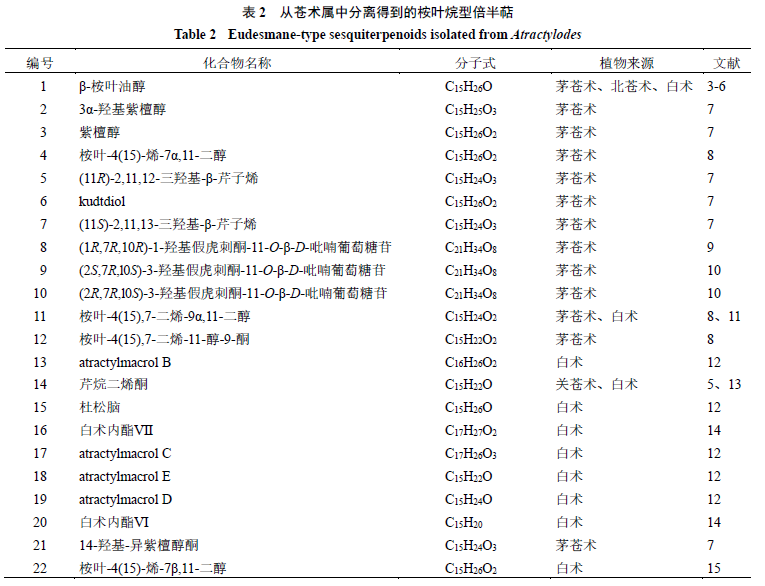
苍术属植物以根茎入药,从苍术属植物根茎中分离得到的
98
个倍半萜类化合物,根据其骨架类型可分为桉叶烷型、愈创木烷型、香根螺烷型和艾里莫酚烷型
4
种,其中桉叶烷型有
63
个,可见苍术属所含倍半萜以桉叶烷型骨架为主。
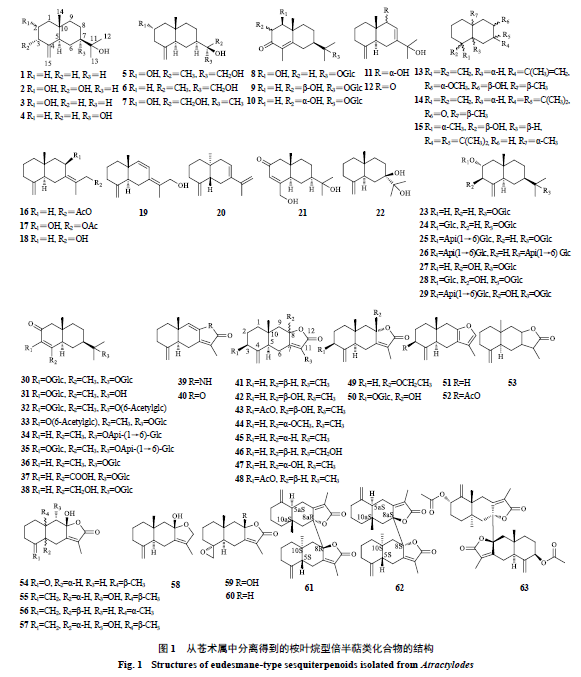
1.1
桉叶烷型倍半萜
苍术属中已报道的桉叶烷型倍半萜有
63
个,占该属已报道倍半萜的一半以上,化学成分及结构见表
2
和图
1
。其基本骨架母核是由
15
个碳原子组成的
2
个六元环和
4
个甲基,此类倍半萜结构多样,
结构变化与环外羟基、羰基的取代位置、糖基的类型和取代位置以及环内双键位置有关。其中,化合物
9
具有优于阳性药的保肝作用,推测可能与
C-2
、
C-3
位的羰基有关。桉叶烷型倍半萜苷类的糖基部分主要为
β-
D
-
吡喃葡萄糖基和
β-
D
-
呋喃芹菜糖基,氧苷的糖链主要结合在苷元的
C-3
、
C-11
位。桉叶烷内酯类大多在
C-8
、
C-12
位成环,同时,在
C-11
位多具有甲基。此类倍半萜内酯具有抗炎、抗肿瘤、保护神经系统、抗菌、抗病毒等多种生物学活性。此外,在相同剂量下化合物
55
比化合物
41
、
45
具有更强的抑制一氧化氮释放的作用
[15]
,推测可能与
C-9
位上具有羟基有关。从苍术属中分离得到
3
个倍半萜二聚体,其结构都是倍半萜内酯在
C8-C8a
桥头位置相连形成二聚体倍半萜内酯。

1.2
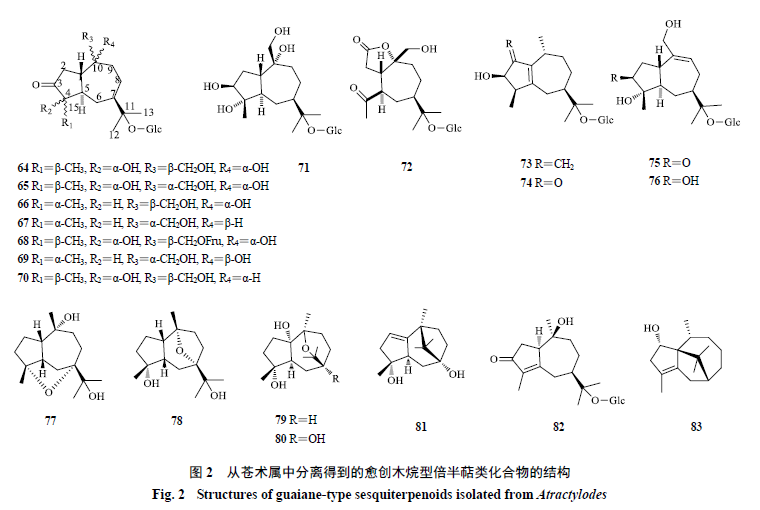
愈创木烷型倍半萜
愈创木烷型倍半萜是一种特殊的倍半萜,属于薁类化合物,可看成是由五元环的环戊二烯负离子和七元环的环庚三烯正离子骈合而成,所以薁是一种非苯型的芳烃类化合物,具有一定的芳香性,这类化合物多具有抗肿瘤、保护神经系统等生物活性。苍术属中的愈创木烷型倍半萜多在
C-11
位有糖基取代形成倍半萜苷。可在
C-4
、
C-7
、
C-10
和
C-11
位被氧化,在
C-4
和
C-7
、
C-7
和
C-10
处出现环氧桥,这类结构对小鼠白血病
P388
和人肺癌
A549
细胞有细胞毒作用
[8]
。此外,苍术属愈创木烷型倍半萜糖苷的
C-10
位羟基可能具有重要的抗炎活性
[35]
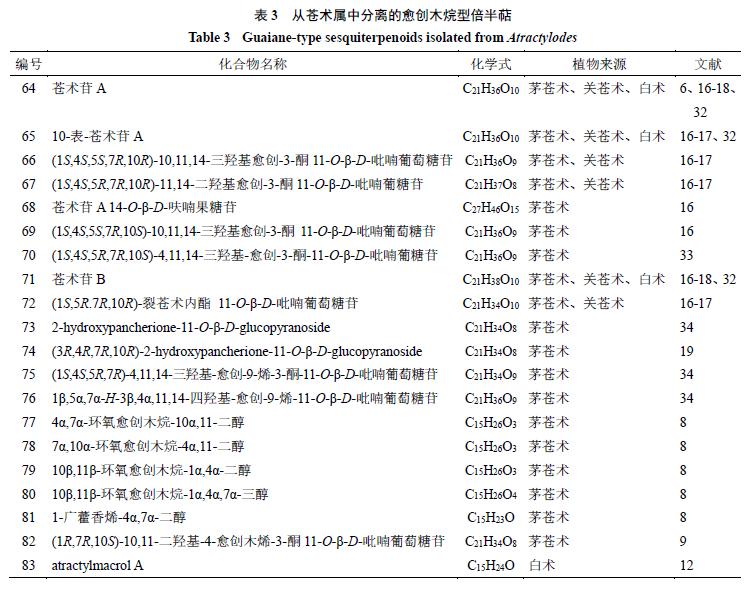
。从苍术属中分离得到
20
个愈创木烷型倍半萜,化学成分及结构见表
3
和图
2
。
1.3
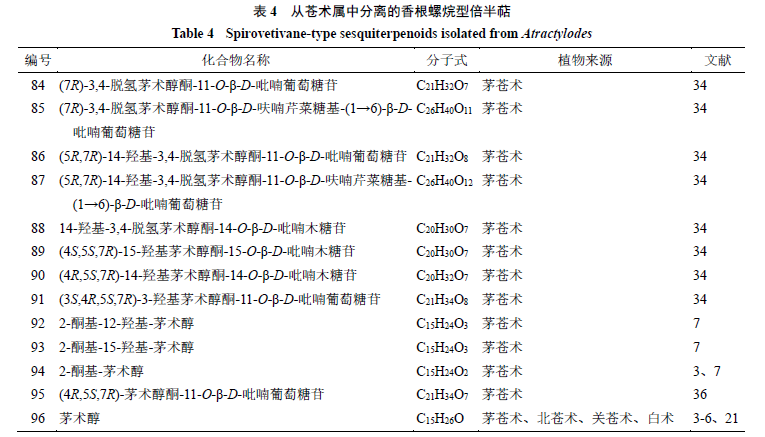
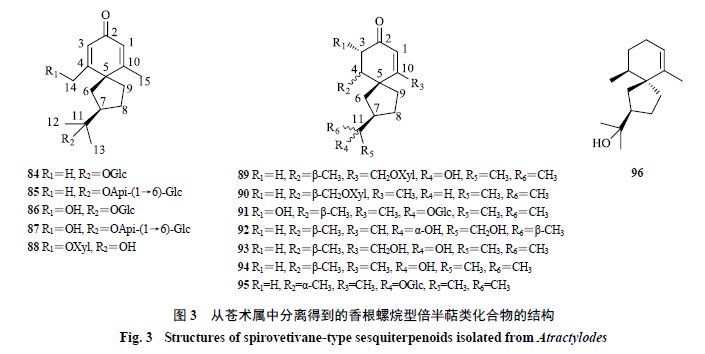
香根螺烷型倍半萜
香根螺烷型倍半萜是螺环化合物,其结构特点为
1
个六元环和
1
个五元环通过
1
个螺原子相连而成,苍术属中该类型倍半萜的结构变化与五元环的构型、六元环内双键位置及
C-3
、
C-4
、
C-10
和
C-11
位的取代基有关。其中,具有
2
个立体中心(
C-5
和
C-7
)的化合物
86
~
88
与具有
1
个立体中心(
C-7
)的化合物
84
~
85
具有相似的
ECD
谱数据。从苍术属中分离得到
13
个该类型化合物,化学成分结构见表
4
和图
3
。
1.4
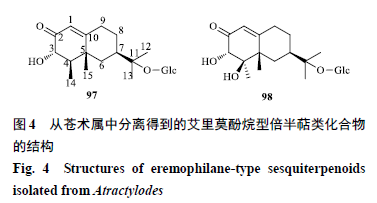
艾里莫酚烷型倍半萜
苍术属中艾里莫酚烷型倍半萜较少,从茅苍术中分离得到
2
个艾里莫酚烷型倍半萜
[19]
,分别为
(3
S
,4
R
,5
R
,7
R
)-3,11-
二羟基
-11,12-
二氢诺卡酮
-11-
O
- β-
D
-
吡喃葡萄糖苷(
97
)、
(3
S
,4
R
,5
S
,7
R
)-3,4,11-
三羟基
-11,12-
二氢诺卡酮
-11-
O
-β-
D
-
吡喃葡萄糖苷(
98
),从苍术属中分离得到的艾里莫酚烷型倍半萜类化合物的结构见图
4
。
2
生物活性
近年来,国内外学者对苍术属倍半萜类化合物进行药理研究,发现其具有抗炎、抗肿瘤、保护神经系统、保肝、抗菌、抗病毒等活性,并对其作用机制进行了探讨。整理了近年来苍术属倍半萜类化合物生物活性及作用机制的研究进展,为该属植物
深度开发利用提供参考。
2.1
抗炎
苍术属植物具有抗炎活性,化合物
40
和
42
均可通过抑制肿瘤坏死因子
-α
(
TNF-α
)和一氧化氮的产生而发挥抗炎作用,且化合物
40
的抑制作用更强
[37]
,作用机制为剂量相关性的抑制
TNF-α
、白细胞介素
-1β
(
IL-1β
)、血管内皮生长因子(
VEGF
)、胎盘生长因子(
PIGF
)和一氧化氮的水平
[38]
,其抗炎作用还可能与抑制
NF-κB
、
ERK1/2
和
p38
信号通路有关
[39]
。从茅苍术中分离的化合物
52
具有很强的抗炎镇痛作用,能显著抑制细胞中诱导型一氧化氮合酶(
induciblenitric oxide synthase
,
iNOS
)和环氧合酶
-2
(
cyclooxygenase-2
,
COX-2
)等的表达
[40]
,在卵白蛋白诱发的变应性鼻炎动物模型中,化合物
52
显示出抑制过敏性炎症的作用。化合物
52
还能抑制
Caspase-1/NF-κB/MAPKs
信号通路,降低佛波酯
-12-
肉豆蔻
-13-
乙酸酯加钙离子载体
A23187
(
PMACI
)诱导人肥大
HMC-1
细胞产生的炎症反应。在动物模型中,可降低白细胞介素
-1
(
IL-1
)、白细胞介素
-4
(
IL-4
)、白细胞介素
-5
(
IL-5
)、白细胞介素
-6
(
IL-6
)、白细胞介素
-13
(
IL-13
)、
COX-2
、细胞间黏附分子
-1
和巨噬细胞炎症蛋白
-2
的表达
[41]
。化合物
41
、
45
和
55
均具有抗炎活性,可降低脂多糖诱导巨噬细胞
RAW264.7
产生一氧化氮而发挥抗炎活性,半数抑制浓度(
IC
50
)值分别为(
48.6
±
0.5
)、(
32.3
±
2.9
)、(
46.4
±
3.2
)
μmol/L
,其中化合物
55
对一氧化氮生成的抑制作用最强
[15]
。
2.2
抗肿瘤
苍术属倍半萜类化合物具有广泛的抗肿瘤活性,化合物
40
对多种癌细胞增殖具有抑制作用,可通过线粒体介导的凋亡途径诱导肺癌
A549
细胞凋亡
[42]
。此外,化合物
40
对人早幼粒白血病
HL-60
细胞具有剂量相关性的细胞毒活性,作用机制可能是通过抑制
HL-60
细胞的铜锌超氧化物歧化酶(
Cu
,
Zn-SOD
),从而诱导细胞凋亡有关
[43]
。此外,化合物
40
可以通过灭活
Notch
通路有效抑制癌细胞增殖和诱导细胞凋亡
[44]
,化合物
40
还可通过上调
p21
基因表达,同时下调
cyclin B1
、
CDK1
、
Cdc25c
基因表达来抑制膀胱癌细胞增殖,使细胞周期阻滞在
G
2
/M
期。在小鼠实验中,化合物
40
阻断了
T-24
或
253J
诱导的异种移植瘤的生长,但无明显毒性
[45]
。化合物
42
对
TSLP
刺激的人肥大细胞白血病细胞系
HMC-1
具有抗肿瘤活性,作用机制为抑制肥大细胞增殖,
IL-13
及磷酸化信号转导和转录激活子。化合物
11
、
39
~
41
对
B16
癌细胞具有抑制作用,其中
39
~
41
较有效,
IC
50
值分别为
54.88
、
76.46
、
84.02
μmol/L
,其作用机制可能与诱导细胞分化,抑制细胞迁移有关
[46]
。化合物
92
~
94
对
B16
黑色素瘤细胞的黑色素合成有中度的抑制作用(
100 m
mol/L
时抑制率分别为
39%
、
34%
、
48%
)
[7]
。化合物
41
可以调控
Akt/ERK
信号通路而显著抑制胃癌细胞的活性、增殖和诱导细胞凋亡
[47]
。化合物
77
~
78
、
80
对
P388
和
A549
细胞有细胞毒作用,但均无活性
[8]
。化合物
1
对肿瘤
HeLa
、
SGC-7901
和
BEL-7402
细胞增殖呈时间和
剂量相关性的抑制作用。此外,
2.55 mg/kg
化合物
1
显著抑制小鼠体内
H22
和
S180
肿瘤的生长,作用机制是通过抑制生长因子信号通路
CREB
的激活而抑制血管生成
[48]
,化合物
1
还可抑制白血病
HL-60
细胞生长并使其凋亡
[49]
。
2.3
保护神经系统
苍术属倍半萜类化合物对中枢神经系统具有保护作用,在以暴露于
1-
甲基
-4-
苯基
-
吡啶离子(
MPP
+
)
的人骨髓神经母细胞瘤
SH-SY5Y
细胞建立帕金森病模型实验中。化合物
40
~
42
、
44
、
53
、
61
表现出神经保护作用。其中
40
~
42
、
44
、
61
在
1 μmol/L
时有保护作用,在
10 μmol/L
时有明显的神经细胞保护作用
[27]
。化合物
42
能显著改善大鼠慢性高剂量同型半胱氨酸所致的学习记忆障碍,降低同型半胱氨酸诱导的活性氧生成,恢复同型半胱氨酸诱导的磷酸化蛋白激酶
C
表达水平的下降。此外,化合物
42
可保护原代培养神经元免受同型半胱氨酸诱导的凋亡,对学习和记忆受损的大鼠起到神经保护作用
[50]
。化合物
61
对
D
-
半乳糖诱导小鼠的记忆损伤有神经保护作用,可显著降低活性氧的形成,降低乙酰胆碱酯酶的活性,增加突触素
I
和蛋白激酶
C
的表达,提示化合物
61
对老年相关记忆障碍有治疗潜力
[51]
。此外,化合物
61
可以诱导
PI3K-Akt-GSK3β
通路影响谷氨酸的合成,进而对大鼠肾上腺嗜铬细胞瘤细胞和
SH-SY5Y
细胞系细胞损伤具有神经保护作用
[52]
。化合物
1
对神经系统有多种独特的作用,在浓度为
100
、
150 μmol/L
时可显著诱导大鼠嗜铬细胞瘤
PC-12
细胞的轴突延伸,最高浓度(
150 μmol/L
)时可抑制
[3H]
胸腺嘧啶核苷掺入,机制可能与影响磷脂酰肌醇特异性磷脂酶
C
(
phosphatidylinositol-specificphospholipase C, PI-PLC
)和丝裂原活化蛋白激酶(
MAPK
)参与轴突的生长有关。而且化合物
1
是一种小分子,因此可能是一种很有前途的先导化合物
[53]
。














