此前结果表明恩格列净将2型糖尿病成人患者的肾病和心血管疾病发生和进展风险降低了39%,EMPA-KIDNEY有待后续公布
恩格列净可以降低慢性肾病患者的风险
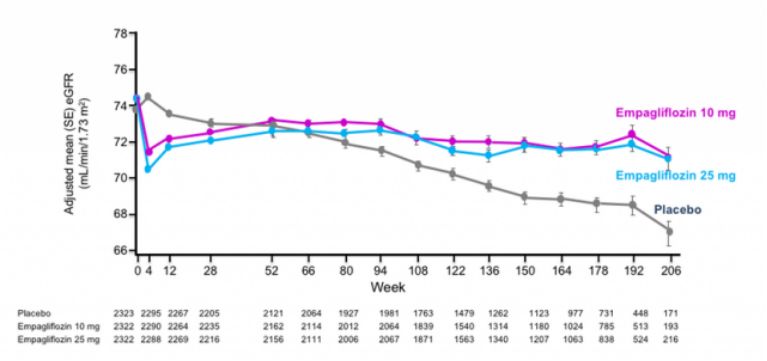
数据来源:BI
BMS宣布FDA已批准Opdivo与Yervoy联用,治疗既往接受过索拉非尼治疗的HCC患者
BMS宣布FDA已批准Opdivo与Yervoy联用,治疗既往接受过索拉非尼治疗的HCC患者,Opdivo+Yervoy是FDA批准的针对该患者群的首个也是唯一的双重免疫疗法
Opdivo(nivolumab)和Yervoy(ipilimumab)是BMS公司开发的免疫检查点抑制剂,分别通过抑制PD-1和CTLA-4免疫检查点蛋白,提高T细胞的抗癌免疫反应
在CheckMate-040临床1/2期研究中,既往接受索拉非尼治疗的HCC患者,经过至少28个月的随访
33%(16/49;95% CI:20-48)的患者获得缓解;8%(4/49)获得完全缓解(CR)。缓解持续时间(DOR)为4.6至30.5+月,其中88%持续至少六个月,56%至少持续12个月,31%至少持续24个月
杨森宣布FDA已经授予双特异性疗法JNJ-6372突破性疗法认定,治疗携带EGFR外显子20插入突变NSCLC患者
杨森(Janssen)公司宣布,美国FDA已经授予双特异性疗法JNJ-6372突破性疗法认定,用于治疗携带EGFR外显子20插入突变的转移性非小细胞肺癌(NSCLC)患者
JNJ-6372是一种靶向EGFR和MET的双特异性抗体。它不但能够阻断配体与EGFR和MET的结合,促进受体降解,而且可以触发抗体依赖性的细胞毒性
在一项开放标签,多中心1期临床研究中,实验者将评估JNJ-6372单药治疗和联合lazertinibi治疗成人晚期NSCLC的情况,Lazertinibi是一种创新第三代EGFR TKI
结果待后续披露
ViiV Healthcare宣布,其长效创新HIV双药组合疗法,在3期临床试验中达到主要终点。
ViiV Healthcare公司宣布,其长效创新HIV双药组合疗法,在名为ATLAS-2M的3期临床试验中达到主要终点。这一组合疗法由ViiV公司开发的cabotegravir和杨森(Janssen)公司开发的rilpivirine构成
Rilpivirine是已经在美国和欧盟获批的口服非核苷逆转录酶抑制剂(NNRTI),而cabotegravir为处于开发阶段的整合酶抑制剂(INI)。
在1045名感染HIV-1病毒的患者中,评估长效cabotegravir和rilpivirine构成的组合疗法,每8周注射一次和每4周注射一次相比的抗病毒活性和安全性
试验结果表明,治疗48周后,每8周注射一次这一双药组合疗法,与每4周注射一次的治疗方案相比,在HIV-1感染成人患者中,达到抑制病毒的非劣效性标准。
勃林格殷格翰宣布FDA批准Ofev(ninetdanib)治疗慢性进行性纤维化间质性肺病(ILDs)患者
勃林格殷格翰(Boehringer Ingelheim)公司宣布,美国FDA批准Ofev(ninetdanib)治疗慢性进行性纤维化间质性肺病(ILDs)患者,这是FDA批准的首款治疗进行性慢性纤维化ILDs的疗法
Ofev是一种小分子酪氨酸激酶抑制剂,可同时阻断3种生长因子受体,包括血管内皮生长因子受体,血小板源性生长因子受体,以及成纤维细胞生长因子受体,有效抑制纤维化过程中的信号通路
在INBUILD3期临床试验中,研究者评估了Ofev的安全性和耐受性
在第52周,通过患者用力肺活量(FVC)的评估,Ofev的治疗使患者的肺功能下降幅度减少了57%,达到试验的主要终点
Kala Pharmaceuticals宣布其开发Eysuvis在治疗干眼症(DED)患者的3期临床试验中达到主要和次要研究终点
Kala Pharmaceuticals公司宣布,其开发Eysuvis(KPI-121)在治疗干眼症(DED)患者的3期临床试验STRIDE 3中达到主要和次要研究终点
Eysuvis是一种利用Kala公司专有的粘液穿透颗粒(MPP)技术,靶向增强渗透到眼睛组织中的新型盐酸柏非特诺(loteprednol etabonate)纳米颗粒制剂
在3期临床研究,901名干眼症患者入组
Eysuvis达到了两项主要疗效终点。治疗15天后,意向治疗组患者和严重眼部不适患者的眼部不适严重程度(ODS)达到了统计学意义上的显著改善。
美国FDA宣布批准诺华的Isturisa(osilodrostat)口服片剂上市,治疗成年库欣病(Cushing’s disease)患者
美国FDA宣布批准诺华的Isturisa(osilodrostat)口服片剂上市,治疗成年库欣病(Cushing’s disease)患者。这些患者无法接受垂体手术,或者在接受垂体手术之后仍然患有这种疾病
Isturisa是第一个FDA批准的直接解决皮质醇生产过量的疗法,通过阻断
11β-羟化酶,能够阻止皮质醇的合成
在137名成人患者的研究中,患者平均年龄41岁,大多数在接受垂体手术后疾病未被治愈,或者不能接受手术。患者先进行24周治疗,然后部分患者
进行了后续8周的治疗
在接受治疗24周之后,接近一半患者的皮质醇水平降低到正常范围内。在后8周中,接受Isturisa维持治疗的患者中86%的患者皮质醇水平在正常范围内,而服用安慰剂的患者组的数值为30%
Cushing疾病的治疗选择
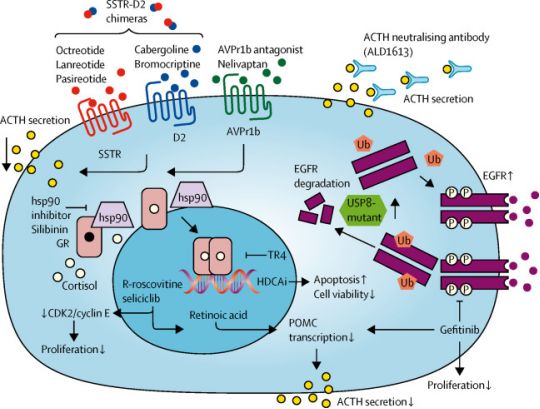
数据来源:诺华
MorphoSys公司宣布美国FDA已接受tafasitamab联合治疗复发/难治性DLBCL患者的BLA






