普林斯顿大学分子生物学系的研究人员发现一种小分子RNA能帮助保持健康乳腺组织和乳腺癌组织中干细胞的干性并逃逸免疫抑制,这表明microRNA(miRNA)能促使乳腺癌发展成致命形式,同时研究也证明抑制这种分子有助于提高现有乳腺癌疗法以及新的肿瘤免疫治疗的疗效。

(康毅滨教授)
这一重要的成果在线公布在5月22日的Nature Cell Biology杂志上,并将成为该杂志六月期刊封面论文。
该研究由普林斯顿大学分子生物学系终身教授康毅滨博士领导完成,康教授研究工作的重点是关于乳腺癌扩散的分子机理,他建立了一系列先进的小鼠模型,并结合基因组,分子生物学,活体成像技术等高技术手段寻找与癌症复发,转移,以及抗药性有关的基因,并深入进行功能方面的研究(
康毅滨:癌转移基因MTDH 促进乳腺癌干细胞的存活
)。同时参与这项研究的还包括复旦大学上海医学院的邵志敏(Zhi-Ming
Shao)教授。
为了找到帮助乳腺干细胞(MaSCs)抵抗分化并保持其自我更新能力的因素,康毅滨教授领导研究组筛选了能结合并抑制蛋白编码mRNAs的miRNAs,以便能减少某些特异性蛋白的表达水平。从中研究人员发现了一种miRNA:miR-199a能过抑制称为LCOR的蛋白的生成,帮助MaSCs保持其干细胞活性,LCOR蛋白的作用是结合DNA,调控基因表达。
研究人员发现当提高小鼠MaSCs中miR-199a的水平时,LCOR就会受到抑制,正常干细胞功能就能提升,相反,如果增加LCOR的蛋白水平,乳腺干细胞活性就会减少。
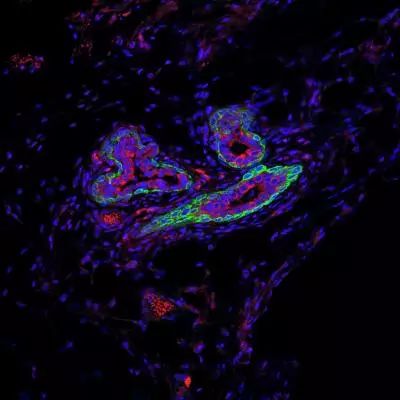
见图,显微图像显示了小鼠正常乳腺导管中不同的细胞类型。乳腺细胞(红色)是生成乳汁的细胞,基底细胞(绿色)具有收缩功能,同时也负责再生乳腺,因为它们包含大多数乳腺干细胞。位于腺体外层的这些干细胞能接触到微环境因子,并与乳腺中的各种免疫细胞(包括巨噬细胞)相互作用。
康教授等人在人和小鼠乳腺癌干细胞中都发现了miR-199a。然而虽然提高miR-199a水平有助于正常的乳腺干细胞保持其活性,但这种分子也会提高癌症干细胞形成肿瘤的能力。如果提高LCOR的水平,则可以降低癌症干细胞的这种肿瘤形成能力。同时康教授与复旦大学邵志敏教授研究组合作,发现表达大量miR-199a的乳腺癌患者生存率差,而LCOR水平较高的患者则有更好的预后。
研究人员还发现,LCOR能令细胞对来自乳腺上皮细胞和免疫细胞,尤其是巨噬细胞释放的干扰素信号分子的作用更为敏感。在正常的乳腺发育过程中,这些细胞能分泌α-干扰素,促进细胞分化,抑制细胞分裂。如果抑制LCOR,miR-199a就会保护MaSC免受干扰素信号,从而使MaSC保持未分化并能自我更新。
miRNA在肿瘤发生过程中也起着相似的作用,保护乳腺癌干细胞不受肿瘤中免疫细胞分泌的干扰素的抑制。研究发现,
如果降低miR-199a的表达或提供LCOR的表达, 肿瘤干细胞活力大大降低并引起细胞衰老(senescence)。 相反,
如果在癌细胞中高表达miR-199a, 癌细胞的成瘤能力大大增强, 并引起向多个器官的转移。
“这是一项非常好的研究,将正常和恶性的免疫调节因子保护性乳腺干细胞进程联系在了一起,”来自斯坦福大学医学院的肿瘤生物学教授Michael
Clarke(首位发现乳腺癌干细胞的科学家,未参与该项研究)说,“这项研究具有明确的治疗意义,能利用免疫调节剂合理的靶向乳腺癌干细胞”。
文章的第一作者,康教授实验室的副研究员ToniCelià-Terrassa表示:“这项研究揭示了乳腺癌干细胞的一种新特性,令它们在免疫系统的相互作用中占据优势,因此也可以说是改进癌症免疫治疗的绝佳机会。”
康教授说:“这一研究指明了肿瘤干细胞与免疫系统的复杂关系与肿瘤治疗的重要联系。干扰素已被广泛用于治疗多种癌症类型,如果通过靶向miR-199a-LCOR途径,能使干扰素抵抗的癌症干细胞变得敏感,那么这些治疗的疗效可能会更好。目前免疫治疗在乳腺癌病人中的效果有限,这可能与乳腺癌干细胞逃逸免疫抑制的功能有关。有关miR-199a-LCOR通路的分子机理的进一步研究将有助于开发让免疫治疗更为有效的药物”。
原文标题
Normal and cancer mammary stem cells evade interferon-induced constraint through the miR-199a-LCOR axis






