近日,领业医药获得2.6亿人民币战略投资,高雅萍、金石东方投资;全国药品带量集采公告下发, 4+7正式官宣扩围;《Biomaterials》:研究开发出一种无载体的多重基因编辑系统,可用于抗癌免疫疗法……关注阅读动脉新医药每周周报,了解更多精彩。
下面动脉新医药将与大家一同回顾过去一周行业资讯。
上周共计7起生物医药类投融资,国内发生了4起,国外发生了3起。其中领业医药融资额最高,为2.6亿元,乐威医药次之,为1亿元。
2019.8.26-2019.9.1,本周新药数据共9个,其中CNS疾病3个,心血管2个,皮肤2个,免疫,呼吸各1个
*AZ宣布IFN受体抗体anifrolumab在一个关键三期临床达到一级终点,用于治疗红斑狼疮(SLE)患者。
SLE虽然市场巨大,但是机理复杂,新药成功率很低,被埋葬的产品不计其数,百健、Xencor、赛诺菲都在其列。过去60年只有1个产品上市,而且效果一般。AZ的anifrolumab其实也是一波三折,此前设置的终点是部分器官彻底改善,结果华丽丽地失败了,后来老老实实地参考了GSK Benlysta的上市终点,要求所有器官有部分改善,最终获批
*Abbvie宣布抗体偶联药物Rova-T一线维持SCLC实验失败,58亿美元正式打了水漂。
这2年抗体偶联药物(ADC)在国际大热,immunomedics和第一三共的案例让大家对ADC领域期望颇高。不过不能光见贼吃肉,不见贼挨打,Rova-T的失败是一个警醒。从目前看,虽然FDA已经批了6个产品上市,但除了her2这个天赋异禀的靶点外,其他产品离重磅炸弹的门槛都还比较远。国内目前ADC也是扎堆在Her2靶点,考虑到这个靶点竞争非常激烈,若该领域的公司希望在资本市场上有显著溢价,可能真得在其他靶点上有所突破
诺华宣布人源化的CD20抗体ofatumumab,在治疗复发性多发性硬化症患者的3期临床试验中达到主要终点
诺华(Novartis)公司宣布,其人源化的CD20抗体ofatumumab,在治疗复发性多发性硬化症(RMS)患者的3期临床试验中达到主要终点
Ofatumumab是一款完全人源化的CD20抗体。它通过与B淋巴细胞表面的CD20结合,能够清除血液中B细胞
3期实验,1882例MS患者参与,时间为30个月。头对头对比ofatumumab与teriflunomide治疗MS成人患者的安全性和疗效
ofatumumab与活性对照组相比,在降低MS的年复发率(ARR)上达到了主要临床终点。其延缓疾病进展的关键性次要终点也得以满足
美国FDA授予SpringWorks的nirogacestat突破性疗法认定,用于治疗硬纤维瘤或深部纤维瘤病
SpringWorks Therapeutics公司宣布,美国FDA授予该公司开发的nirogacestat突破性疗法认定,用于治疗复发或难治性,无法切除的硬纤维瘤(desmoid tumors)或深部纤维瘤病(deep fibromatosis)
Nirogacestat是一款口服特异性γ-分泌酶小分子抑制剂
nirogacestat治疗表现出100%的疾病控制率,由于患者的疾病缺乏进展,在试验数据公布时患者的中位无进展生存期尚未达到
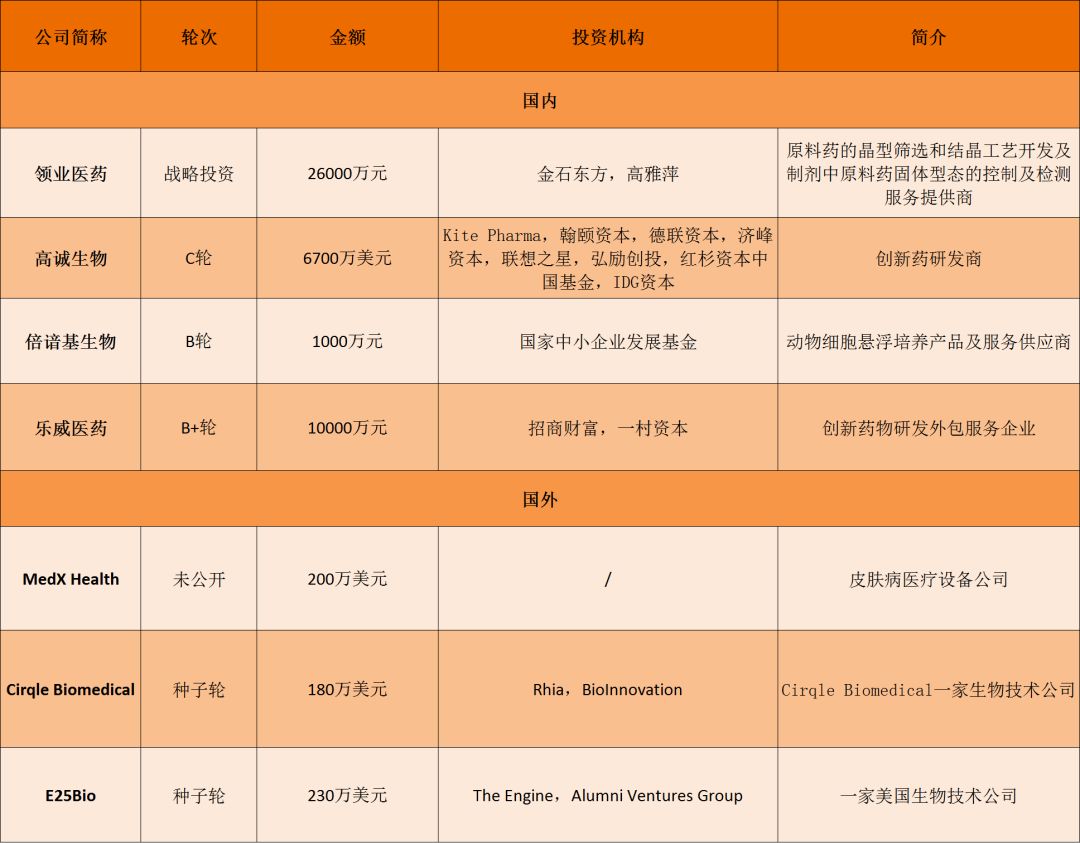
Esperion降低低密度脂蛋白胆固醇(LDL-C)的在研药物组合在2期临床实验中达到主要和关键性次要终点
Esperion降低低密度脂蛋白胆固醇(LDL-C)的在研药物组合bempedoic acid/ezetimibe,在治疗同时患有高胆固醇血症和2型糖尿病的患者的2期临床试验中,达到主要和关键性次要终点
公司的药物组合包括bempedoic acid(BA)/ezetimibe(EZE),其中BA是ATP柠檬酸裂解酶(ACL)抑制剂,能降低胆固醇的生物合成;而EZE抑制胆固醇运输蛋白NPC1L1的活性,降低胃肠道内胆固醇的吸收和向肝脏的胆固醇运输
共有179例同时患有高胆固醇血症和2型糖尿病的患者参与这一为期12周的随机双盲2期临床试验,这些患者同时接受稳定的糖尿病药物治疗,但是已经停止使用其它脂质调节疗法。
与安慰剂组相比,BA/EZE治疗组患者的LDL-C水平显著降低40%。LDL-C水平<70 mg/dl或LDL-C降低幅度超过50%的患者接近患者总数的40%
bempedoic acid/ezetimibe药物组合可以显著降低LDL-C的水平
数据来源:
Esperion
阿斯利康的三联疗法在治疗COPD患者的3期临床试验ETHOS中,达到试验的主要终点
阿斯利康(AstraZeneca)宣布了其三联疗法PT010, 在治疗中度至极重度慢性阻塞性肺病(COPD)患者的3期临床试验ETHOS中,达到试验的主要终点
PT010是一款由布地奈德(ICS),格隆溴铵(LAMA)和富马酸福莫特罗(LABA)构成的固定配方复方三联疗法。它使用Aerosphere递送技术,可以装在一个吸入器中使用
8500多名中重度COPD患者参与随机双盲试验,这些患者在一年内曾经历过中重度疾病恶化情况并且在进入试验之前至少接受了两次的吸入性维持治疗
PT010达到了试验的主要临床终点。在标准和低ICS剂量下,与活性对照组的双联疗法相比,PT010显著降低中重度COPD患者的疾病恶化率,且表现出和双联疗法一致的安全性和耐受性
美国FDA接受了Viela Bio公司抗CD19单克隆抗体inebilizumab的BLA,治疗视神经脊髓炎谱系疾病患者
Viela Bio公司宣布,美国FDA接受了该公司为抗CD19单克隆抗体inebilizumab递交的生物制剂许可申请(BLA),治疗视神经脊髓炎谱系疾病(NMOSD)患者
Inebilizumab是一款对CD19具有高度亲和力的人源化单克隆抗体
231名患者随机接受了inebilizumab单药疗法或者安慰剂的治疗。这些患者包括体内产生或不产生抗AQP4抗体的NMOSD患者
Inebilizumab达到试验的主要终点,在抗AQP4抗体阳性患者中,与安慰剂相比将NMOSD发作的风险降低77%(HR: 0.227; p<0.0001)
美国FDA批准协和麒麟开发的创新药Nourianz上市,作为辅助疗法治疗经历“关闭”期的PD患者
美国FDA宣布,批准协和麒麟(Kyowa Kirin)株式会社开发的创新药Nourianz(istradefylline)上市,作为左旋多巴/卡比多巴的辅助疗法,治疗经历“关闭”期的帕金森病(Parkinson’s disease)成人患者
Istradefylline是一种口服给药的选择性腺苷A2A受体拮抗剂,腺苷A2A受体是一种存在于基底神经节(basal ganglia)中的G蛋白偶联受体
在4项含安慰剂对照的临床试验中,总计包含1143名患者入组,这些患者都在使用左旋多巴/卡比多巴
接受istradefylline治疗的患者每天经历“关闭”期的时间与安慰剂组相比得到统计显著缩短。
每年只需接受两次皮下注射的RNAi疗法inclisiran,在降低LDL-C的3期临床试验中,达到主要和次要终点
The Medicines Company宣布,每年只需接受两次皮下注射的RNAi疗法inclisiran,在降低低密度脂蛋白胆固醇(LDL-C)的关键性3期临床试验中,达到试验的所有主要和次要终点
Inclisiran是第一款降低LDL-C的RNAi疗法。它直接与编码PCSK9蛋白的mRNA结合,通过RNA干扰作用降低mRNA的水平
在随机双盲,含安慰剂对照的关键性3期临床试验,参加试验的患者患有动脉粥样硬化心血管疾病(ASCVD),或者即便使用最大耐受剂量的他汀类疗法,LDL-C水平仍然得不到控制
inclisiran达到了试验的所有主要终点和次要终点,疗效与此前的1期和2期临床试验相当。此前公布的试验结果表明,inclisiran能够将LDL-C水平降低51%,并且维持至少210天。
礼来和Incyte联合宣布,JAK抑制剂与在治疗中重度特应性皮炎患者的3期临床试验中达到主要终点
礼来(Eli Lilly and Company)公司和Incyte公司联合宣布,JAK抑制剂Olumiant(baricitinib)与外用皮质类固醇联用,在治疗中重度特应性皮炎患者的3期临床试验中达到主要终点
Baricitinib是一款每日一次的口服JAK抑制剂
在含安慰剂对照的关键性3期临床试验中,中重度特应性皮炎患者在接受标准外用皮质类固醇治疗以外,接受了baricitinib的治疗。这些患者来自亚洲、欧洲、南美洲和澳大利亚
当baricitinib与标准疗法联用,显著改善了疾病的严重性,达到皮肤症状清除或几乎清除(vIGA=0,1)的患者比例显著高于安慰剂组
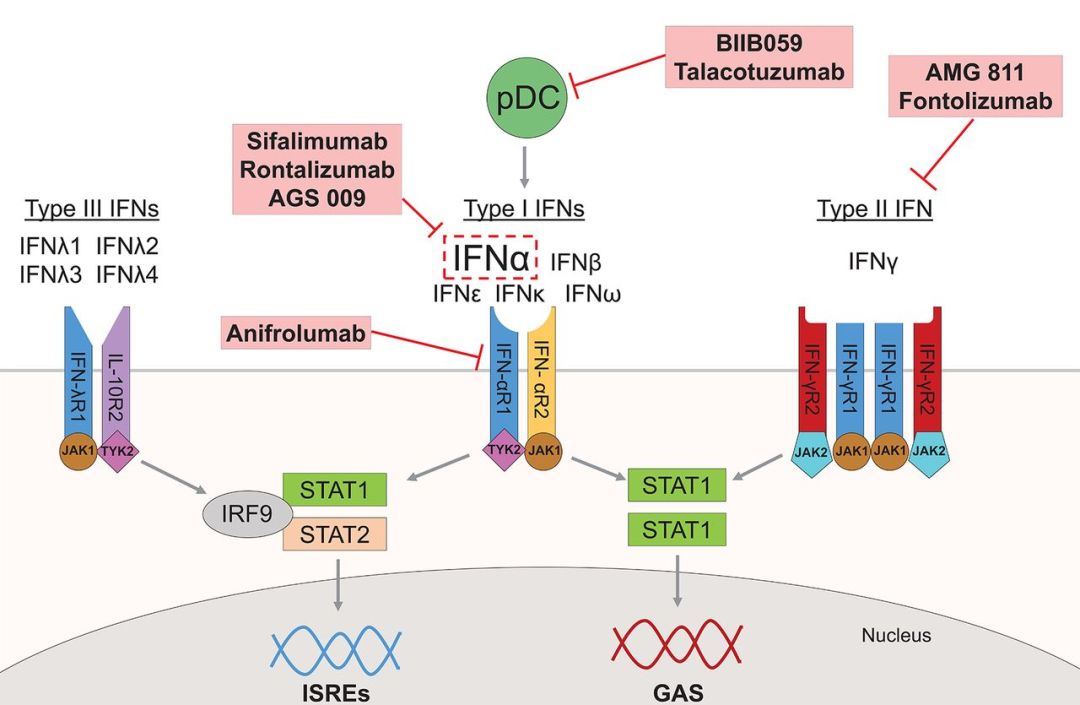
阿利斯康用于治疗系统性红斑狼疮的在研单抗药物anifrolumab在关键性3期临床试验中达到了主要终点
阿利斯康(AstraZeneca)宣布,其用于治疗系统性红斑狼疮(systemic lupus erythematosus,SLE)的在研单抗药物anifrolumab,在关键性3期临床试验TULIP 2中,达到了显著改善病情的主要终点
Anifrolumab可与I型干扰素受体的亚基1相结合,进而拮抗所有1型干扰素(IFN-α、IFN-β和IFN-ω)相关活动
373名中重度SLE患者参与了TULIP 2试验,他们被随机分为两组,在接受标准疗法的基础上,分别接受每4周注射一次300mg anifrolumab,或安慰剂
anifrolumab显著改善了基于BILAG的狼疮综合评价指数(BICLA),为患者病情带来统计显著且具有临床意义的缓解
Anifrolumab的作用机制
数据来源:
rheumatic disease
强生/Arrowhead启动RNAi三药方案IIb期研究
近日,Arrowhead公司宣布,强生旗下杨森制药已开始在IIb期研究(REEF-1)对不同组合方案进行患者给药,包括RNAi药物JNJ-3989(前称ARO-HBV)和/或JNJ-6379以及一种核苷(酸)类似物。随着该研究的启动,Arrowhead从杨森收到一笔2500万美元的里程碑付款。目前,JNJ-3989正被开发作为一种潜在的治愈性疗法,用于HBV感染者。JNJ-6379则是一种口服给药的衣壳组装调节剂,能够阻断HBV复制过程中的正常衣壳组装。( 生物谷 )
新基与Immatics Biotechnologies达成合作, 开发针对多种癌症新型过继性细胞疗法
8月29日,致力于发现基于T细胞重定向的癌症免疫疗法的Immatics Biotechnologies公司宣布,与新基公司达成一项战略合作协议。两家公司将开发针对多种癌症的新型过继性细胞疗法。根据协议条款,Immatics将获得7500万美元的预付款,负责研发3个TCR-T项目,至先导药物阶段。届时Celgene可以行使选择权,并承担进一步的全球开发,制造和推广。对于每款选定的TCR-T细胞疗法,Immatics可获得高达5.05亿美元的后续付款。( 新浪医药 )
三星与Kaiser Permanente联合推出新型心脏康复解决方案
日前,三星与Kaiser Permanente合作推出了一种以家庭为基础的心脏康复解决方案,该解决方案基于在《新英格兰医学杂志(NEJM)》上发布的研究结果。《NEJM》文章显示,研究结果与传统的心脏康复计划相比有显着改善,虽然这些病症的美国全国平均医院再入院率约为10%-15%,但参与计划的患者再入院率低于2%。该计划实现了87%的患者完成率,比基于康复中心的康复计划提高了74%。( businesswire )
Adaptimmune与Noile-Immune达成合作,开发新一代T细胞产品
8月28日,Adaptimmune Therapeutics宣布与Noile-Immune Biotech达成一项合作开发协议,联手开发结合Adaptimmune的SPEAR T细胞技术,和Noile-Immune的PRIME技术的下一代T细胞产品。新一代SPEAR T细胞产品将共表达趋化因子IL-7和CCL19。依据协议条款,Adaptimmune将拥有最终产品的全球开发和市场化专有权。Noile-Immune将获得可高达3.12亿美元的现金预付款和里程碑付款,以及未来销售额分成。( 新浪医药 )
绿叶制药与阿斯利康签署协议,授予后者血脂康胶囊新加坡独家推广权
近日,绿叶制药集团宣布与阿斯利康签署协议,授权后者在新加坡独家推广天然调脂药血脂康胶囊。今年3月,双方已就该产品的全球商业化达成战略合作备忘录。本次协议的签订,标志着血脂康国际化进程的加速推进。血脂康胶囊在新加坡的注册商品名为Lipascor®。根据协议,阿斯利康负责Lipascor®在新加坡的独家推广,而绿叶制药继续持有该药品的资产权、销售权、注册准证、全部知识产权等推广权之外的权利。( 美通社 )
UIUC与Infosys达成战略合作,共同开发精准医疗解决方案
近日,伊利诺伊大学厄巴纳-香槟分校(UIUC)和数字服务和咨询服务提供商Infosys宣布建立战略合作伙伴关系,以开发精准医学解决方案。作为战略合作伙伴关系的一部分,Infosys成为计算生物技术和基因组医学中心(CCBGM)的成员。本次合作将结合Infosys在先进机器学习方面的优势,通过Infosys Nia平台提供的人工智能功能,以及UIUC在计算系统、生物信息学和基因组应用方面的专业知识,以改善预防性护理并提高潜在疾病治疗结果的可预测性。( HIT )
❖
艾伯维
宣布III期MERU研究的中期分析结果显示,抗体偶联药物Rova-T(rovalpituzumab tesirine)作为一线维持疗法相比安慰剂对于晚期小细胞肺癌患者的生存期没有显著改善,其安全性结果与之前的数据一致。AbbVie同时宣布Rova-T的开发项目正式终止,58亿美元正式打了水漂
❖
AbbVie
同时宣布接受独立数据监测委员会的建议终止了MERU研究,Rova-T的开发项目也同时正式终止。专注于开发靶向RNA的反义寡核苷酸(ASO)药物的Ionis Pharmaceuticals公司宣布,基于其在研药物IONIS-HBVRx和IONIS-HBV-LRx,在治疗慢性乙肝(CHB)患者的2期临床试验中获得的积极结果,葛兰素史克(GSK)公司将选择获得这两款在研疗法的研发和推广权益。
❖
安进公司
(Amgen) 宣布,已与
新基公司
(Celgene)和百时美施贵宝(BMS)公司达成一项协议,以134亿美元的价格收购Otezla(apremilast),后者是治疗银屑病和银屑病关节炎的唯一一款口服、非生物制剂治疗药物。
❖
阿斯利康
的重磅肺癌药物泰瑞沙(甲磺酸奥希替尼片,AZD9291)的两项注册进度状态已变为"审批完毕-待制证"。从以往经验看,这相当于获批的"提前官宣"。据悉,此次泰瑞沙注册的适应症是一线治疗EGFR突变阳性局部晚期或转移性非小细胞肺癌。
❖
上海阳关
采购网发布《联盟地区药品集中采购文件》,文件内容包括联盟地区以及采购品种及约定采购量,采购品种为阿托伐他汀口服常释剂型等25个品种,这被视为是4+7扩面的计划即将正式执行。
阿斯利康泰瑞沙在中国获批非小细胞肺癌一线治疗
8月31日,阿斯利康奥希替尼(中文商品名泰瑞沙)获得国家药监局批准,作为EGFR突变阳性晚期或转移性非小细胞肺癌(NSCLC)的一线标准治疗。奥西替尼是阿斯利康公司研发的第三代口服、不可逆的选择性EGFR突变抑制剂,是全球第一个上市,也是我国首个获批的用于EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌的肿瘤药物 ( 医谷 )
盐野义Xofluza获中国台湾批准,治疗A型和B型急性流感
近日,日本药企盐野义宣布,其流感药物Xofluza(baloxavir marboxil)已获中国台湾批准,用于12岁及以上患者A型和B型急性流感的治疗。Xofluza在中国台湾的批准,基于在健康流感患者中开展的一项日本II期研究和一项全球III期研究(CAPSTONE-1)以及在流感并发症高危人群中开展的一项全球III期研究(CAPSTONE-2)的疗效和安全性数据。( 新浪医药 )
恒瑞医药新药注射用达托霉素获得美国FDA批准
8月29日,恒瑞医药发布企业公告称,公司向FDA申报的注射用达托霉素简略新药申请(ANDA)已获得批准。达托霉素为环脂肽类抗生素,经玫瑰孢链霉菌发酵得来,其适应症为治疗成人复杂性皮肤和皮肤组织感染(cSSSI)、成人血液金黄色葡萄球菌感染;作用机制为达托霉素与细菌细胞膜结合,并引起细胞膜电位的快速去极化,细胞膜电位的这种降低抑制了蛋白质、DNA和RNA的合成,最终导致细菌细胞死亡。( 药智网 )
罗氏Tecentriq+Abraxane一线治疗PD-L1阳性患者获欧盟批准
近日,罗氏宣布欧盟委员会已批准PD-L1肿瘤免疫疗法Tecentriq(atezolizumab)联合化疗(Abraxane[白蛋白结合型紫杉醇],nab-paclitaxel)作为一种初始疗法,用于治疗肿瘤表达PD-L1(≥1%)并且既往未接受化疗控制转移性疾病的不可切除性局部晚期或转移性三阴性乳腺癌成人患者。在美国,Tecentriq+Abraxane组合方案获FDA批准,用于肿瘤表达PD-L1的不可切除性局部晚期或转移性TNBC患者。( 生物谷 )
4Web Medical颈椎独立式椎间融合器获FDA 510(K)批准
8月29日,4Web Medical宣布其颈椎桁架系统-独立的椎体间融合装置(CSTS-SA)获FDA 510(K)上市批准。与4Web现有的产品组合一致,CSTS-SA采用了开放式架构、先进的结构设计,并结合了该公司专有的Truss Implant Technology™。CSTS-SA产品的设计允许通过桁架植入物将固定螺钉放置到相邻椎体中,从而形成一个零轮廓独立结构,消除了传统钢板和螺钉固定的需要。( 汇众医疗 )















