Sunil R. Hingorani, Lei Zheng, Andrea J. Bullock, Tara E. Seery, William P. Harris, Darren S. Sigal, Fadi Braiteh,
Paul S. Ritch, Mark M. Zalupski, Nathan Bahary, Paul E. Oberstein, Andrea Wang-Gillam, Wilson Wu,Dimitrios Chondros, Ping Jiang, Sihem Khelifa, Jie Pu, Carrie Aldrich, and Andrew E. Hendifar
本刊负责人:张绪超 广东省人民医院
审校:王风华
中山大学附属肿瘤医院
翻译:王宁薇 中国医科大学
摘要
目的
:
转移性胰腺导管腺癌的特征是在肿瘤微环境中过量透明质酸(hyaluronan,HA)积聚,升高间质压力并损害灌注。临床前研究表明,
PEGPH20
(pegvorhyaluronidase alfa)可以降解HA,从而增加药物输送。
患者和方法
:先前未经治疗的转移性胰腺导管腺癌患者被随机分配到PEGPH20+nab-紫杉醇/吉西他滨组(PAG)或nab-紫杉醇/吉西他滨(AG)组。采用新型亲和组化法回顾性测定肿瘤组织中HA的水平。主要研究终点为无进展生存( progression-free
survival ,PFS;总体)和血栓栓塞(thromboembolic,TE)事件发生率。次要研究终点包括总生存率,不同HA表达水平的PFS和客观缓解率(ORR)。PAG组中TE事件的早期失衡导致临床持有;随后合并TE事件的患者被排除,开始进行依诺肝素预防。
结果
:共有279例患者被随机分配。246例患者有HA数据;231例可评价疗效;84例(34%)患者HA肿瘤高表达(即在任何强度下≥50%肿瘤表面细胞外基质HA染色)。PAG治疗显着改善总体人群的PFS(HR 0.73; 95%CI,0.53-1.00;
P
= 0.049)和HA-高含量的患者的PFS(HR0.51,95%CI为0.26-1.00 ;
P
= 0.048)。对于 HA高含量患者PAG组 和AG组)的ORR分别为45%和31%,mOS分别为11.5个月和8.5个月(HR0.96; 95%CI 0.57-1.61)。两组3/4级不良事件有显著差异,最常见的治疗相关3/4级不良事件(PAG vAG)包括肌肉痉挛(13%v 1%),中性粒细胞减少(29%v 18%)和肌痛(5%v 0%)。在使用依诺肝素后,两组TE事件发生率相当(14% vs. 10%)。
结论
:本研究满足主要研究终点PFS和TE事件发生率。接受PAG治疗的HA高表达肿瘤患者人群中观察到PFS的最大改善。在研究的第2阶段两个治疗组观察到相似的TE事件发生率。
介绍
在美国,胰腺导管腺癌(Pancreaticductal adenocarcinoma,PDA)仍然是癌症相关死亡的主要原因,到2030年,发生率和死亡率预计会大幅增加。
1
,
2
PDA的预后仍然很差,转移患者的5年生存率为3%。
2
大多数患者在诊断时为晚期,胰腺癌晚期全身治疗效果有限。
1,3
转移性PDA治疗性抵抗部分归因于复杂的肿瘤微环境(tumormicroenvironment,TME)。
3-6
PDA中丰富的结缔组织和细胞外基质(extracel-lularmatrix,ECM)共同提高肿瘤间质凝胶 - 流体压力,压缩肿瘤脉管系统,阻碍治疗药物和潜在的免疫细胞进入肿瘤部位。
4,7-10
透明质酸(Hyaluronan,HA)是一种大的线性多糖,在很多实体肿瘤中是ECM的主要成分,
11
能够强烈地结合水,形成一个不动的凝胶液相,诱导血管崩溃。
6,12
在PDA中高HA含量也与疾病侵袭性增加和总生存(OS)降低有关。
4,8,9,13
因此,多种机制理论支持针对这种高度耐药性恶性肿瘤靶向TME中的HA
。
4,13
PEGPH20降解肿瘤内HA并重塑肿瘤基质。临床前研究结果显示在具有高水平HA的PDA模型中PEGPH20介导的HA降解降低了间质凝胶 - 流体压力,
7
增加血流灌注,且增加抗癌药物的摄取。
7,8,11
在未经治疗的mPDA患者的Ib期研究中,PEGPH20联合吉西他滨联合治疗通常具有良好的耐受性,并显示出令人印象深刻的疗效,这种反应在吉西他滨单独使用时并不常见。
14
最近,与单药吉西他滨相比,nab-紫杉醇联合吉西他滨(AG)进一步延长无进展生存期(PFS)和OS,成为mPDA患者的新的标准治疗,然而,结果仍然不理想。
15
本项随机多中心II期研究比较了PEGPH20联合AG与单独AG治疗既往未治疗的mPDA患者的临床活性。
方法
研究设计
:HALO-202试验分两个阶段进行,使用集中的交互式Web响应系统进行随机化。在阶段1,患者被随机分配1:1接受PAG或AG。在研究早期观察到的血栓栓塞(TE)事件的不平衡导致暂时的临床持有。在阶段2,试验方案修改后,以2:1随机分组方式重新开始试验,以排除TE事件患者,并在两组中开始依诺肝素预防。TE事件发生率作为主要安全终点也被用来评估依诺肝素预防降低TE风险的效率。回顾性地使用ECM中的HA的亲和组织化学测定和评估肿瘤HA水平。采用亲和组化法回顾性检测肿瘤组织中HA的水平和得分算法评估ECM中的HA(Ventana HA RxDx Assay; Roche,Tucson,AZ)针对不同的HA割点,使用治疗-HA状态交互作用的测试方法对阶段1的肿瘤样品进行回顾性分析,目的是识别与临床获益相关的HA累积阈值以。阶段2肿瘤样品和功效数据用作验证组。
本研究遵循赫尔辛基宣言的道德原则,并得到当地参与机构的伦理委员会的批准。所有患者在入组前都提供了书面知情同意书。
患者:
入组患者标准包括:IV期PDA伴肝和/或肺转移(允许其他转移部位),转移病灶既往未接受治疗,预期寿命大于或等于3个月,KPS评分大于或等于70%。要求提供肿瘤组织用于HA检测。所有患者都需要足够的肾脏、骨髓和肝功能。在阶段2中,筛查期间有TE事件证据、既往存在的颈动脉疾病、短暂性脑缺血发作史或脑血管意外史、先前接受低分子量肝素治疗期间大出血、或根据国家综合癌症网络指南
16
,肝素使用禁忌症患者被排除在外。修订后的方案还要求患者在发生TE事件时停止PEGPH20治疗。
治疗:
每4周为一个周期,包括治疗3周和休息1周。PEGPH20(3mg/ kg)在第一周期每周两次静脉给药,在随后的周期期间每周给药一次。 AG方案采用标准剂量(nab-紫杉醇125mg/ m 2和吉西他滨1,000mg/ m 2)。在PAG组中,第一周期第一周初始AG剂量在PEGPH20第一剂后24小时给药; 随后AG在PEGPH20给药后2至4小时给予。所有患者在每次PEGPH20给药前2小时和8-12小时口服地塞米松8mg
17
,以处理肌肉骨骼事件(MSE),试验第2阶段的患者每天接受依诺肝素预防(初始剂量40mg/d,后来根据更新的指南修改为推荐1 mg/ kg / d)。
18
终点和评估:
主要终点是总体人群PFS和第2阶段TE事件的发生率。次要终点是HA水平分层的PFS,OS和客观缓解率(objective response rate,ORR)。探索性终点包括HA水平分层的OS和应答持续时间(duration of response,DoR)。
每8周进行一次肿瘤评估,采用实体瘤疗效评估标准(RECIST1.1版和独立盲法中心评价
。
19
采用美国国家癌症研究所常见术语标准CTC 4.03版评估不良事件(AE)严重程度。
20
统计方法:
分类数据汇总采用频率计数和百分比。连续数据采用平均值,标准偏差,中位数,最小值和最大值进行汇总。所有统计学检验均以0.05的双侧显着性水平进行。对于多重性未设定一个a值。9.4版SAS软件(SAS Institute,Cary,NC)用于所有分析。该研究以80%的统计学功效来检测疗效可评估(EE)群体的PFS差异,双侧显着性水平为0.1。
21
研究人群。阶段1和阶段2的数据用于汇总分析。意向治疗(ITT)人群包括所有随机分配的患者,用于总结基线特征和效果分析。EE人群包括所有接受研究药物治疗的患者,在基线时具有可测量的疾病,且具有基线后疗效评估或疾病进展; EE人群是总体PFS(主要终点)的预定主要分析人群。安全人群包括接受任何研究药物的患者。主要安全终点TE事件发生率在第二阶段安全人群中进行评估。对于可获得HA数据的患者,基线特征和疗效结果也通过肿瘤HA水平进行分析。
疗效。使用Kaplan-Meier方法计算中位PFS和OS;根据基线KPS和分层Cox回归模型估计的风险比(HR)采用双对数秩检验分层评估治疗差异。当95%的入选患者停止研究治疗时进行分析。各治疗组的ORR进行汇总和采用Cochran-Mantel-Haenszel检验进行组间疗效比较。
安全性。主要安全终点是在研究的第二阶段发生TE事件的患者比例。 Fisher精确检验比较治疗组之间的TE率。不良事件通过药事管理的标准医学术语优选术语和描述性统计进行汇总。
22
结果
患者与治疗:
患者配置。研究的第一阶段(2013年3月至2014年4月),146名患者1:
1被随机分配接受PAG组或AG组。治疗组之间TE事件的不平衡导致短暂的临床持续。在此期间,29名接受PAG的患者继续单独使用AG治疗,其中7名在试验重新开始后时恢复PEGPH20治疗。在试验的第二阶段(2014年8月至2016年2月),另有133名患者2:1被随机分配到 PAG组与AG组。两个阶段的随机化(n = 279)通过KPS(70%或80% vs. 90%或100%;图1)分层。

基线特征。总体患者人群,HA高肿瘤患者人群和不同研究阶段患者人群的人口统计学和疾病特征见汇总表1和附录表A1(仅在线)治疗组之间的基线特征总体平衡。研究第一阶段患者肿瘤样品的回顾性分析界定在任何强度的ECM中50%的肿瘤表面积的HA表达的阈值。根据这一标准,246例可用HA数据的患者中有84例肿瘤(34%)HA高表达。

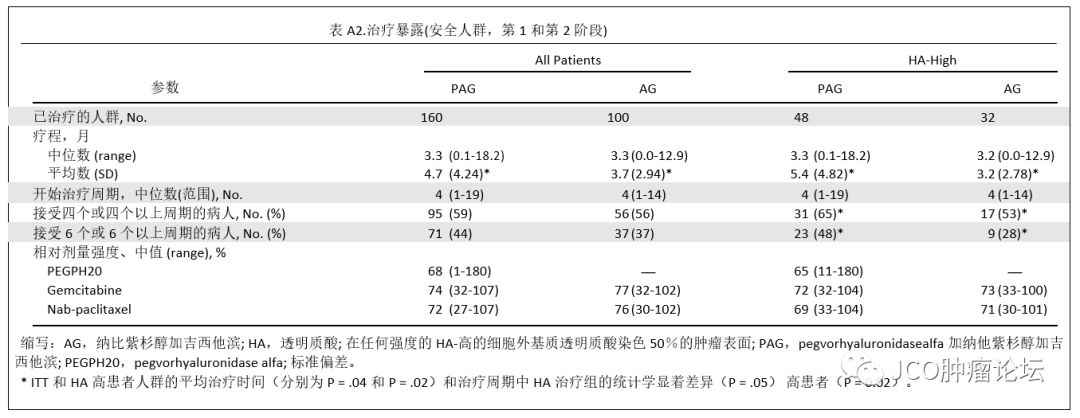
 治疗暴露。总体治疗暴露包括中位治疗持续时间、治疗周期的中位数、和每种药物的中位剂量数,组间平衡(附录表A2,仅在线)。尽管研究第1阶段PAG组中有29名患者PEGPH20治疗中断或中止,)。在研究阶段2,总体人群和HA高人群中PAG组治疗的中位持续时间更长。AG组的相对中位剂量强度组间相似(吉西他滨:74%PAG对77%AG; nab-紫杉醇:72%PAG对76%AG),提示联合PEGPH20治疗不影响化疗给药。
治疗暴露。总体治疗暴露包括中位治疗持续时间、治疗周期的中位数、和每种药物的中位剂量数,组间平衡(附录表A2,仅在线)。尽管研究第1阶段PAG组中有29名患者PEGPH20治疗中断或中止,)。在研究阶段2,总体人群和HA高人群中PAG组治疗的中位持续时间更长。AG组的相对中位剂量强度组间相似(吉西他滨:74%PAG对77%AG; nab-紫杉醇:72%PAG对76%AG),提示联合PEGPH20治疗不影响化疗给药。
 疗效:
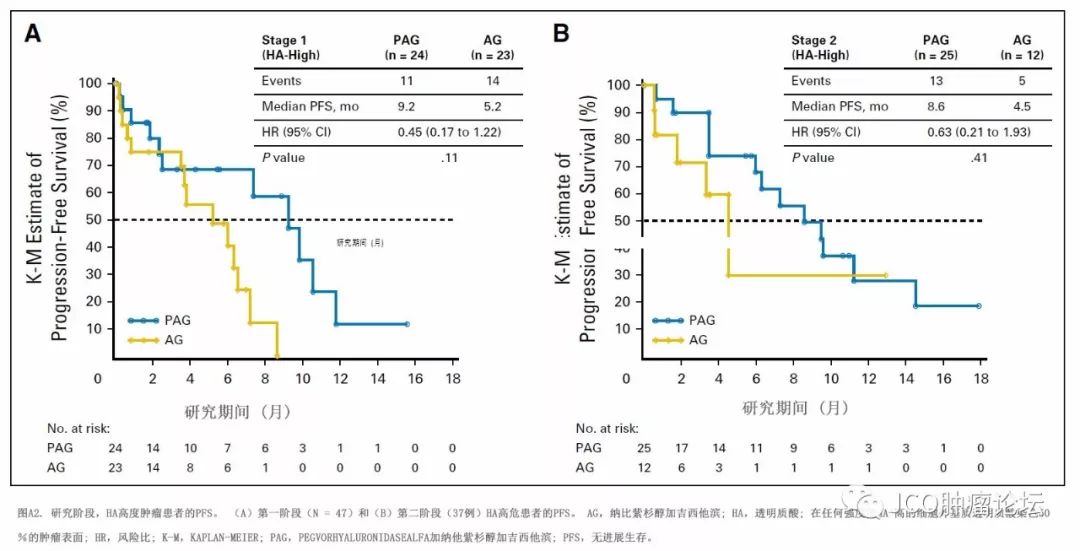
截至2016年12月,在方案定义的EE人群(图2A)和ITT人群(附录图A1,仅在线)中的主要研究终点PFS在PAG组(6.0个月)较AG组(5.3个月)获得中度但显著改善( HR,0.73;95%CI,0.53至
1.00;
P
=0.049)。这种获益在
HA高肿瘤患者中更为明显,PAG组中位PFS为9.2个月,AG组为5.2个月(HR为0.51; 95%CI为0.26〜1.00;
P
= 0.048;图2B)。无论哪个研究阶段,HA高患者的PFS改善均一致(附录图A2,仅在线)。然而, HA表达水平较低的肿瘤患者(即任何强度下ECM中的HA表达<50%的肿瘤表面积)的中位PFS在不同治疗组间无差异,PAG组和 AG组分别为5.6个月和5.3个月(HR0.88;95%CI为0.59至1.32)。
疗效:
截至2016年12月,在方案定义的EE人群(图2A)和ITT人群(附录图A1,仅在线)中的主要研究终点PFS在PAG组(6.0个月)较AG组(5.3个月)获得中度但显著改善( HR,0.73;95%CI,0.53至
1.00;
P
=0.049)。这种获益在
HA高肿瘤患者中更为明显,PAG组中位PFS为9.2个月,AG组为5.2个月(HR为0.51; 95%CI为0.26〜1.00;
P
= 0.048;图2B)。无论哪个研究阶段,HA高患者的PFS改善均一致(附录图A2,仅在线)。然而, HA表达水平较低的肿瘤患者(即任何强度下ECM中的HA表达<50%的肿瘤表面积)的中位PFS在不同治疗组间无差异,PAG组和 AG组分别为5.6个月和5.3个月(HR0.88;95%CI为0.59至1.32)。



整体研究人群的OS不同治疗组间相似(PAG v AG:9.6V 9.2个月; HR,0.90;95%CI,0.68到1.19;图3A)。联合研究阶段1和阶段2的HA高表达患者人群的OS未观察到差异肿瘤(PAG v AG:11.5个 v月8.5个月; HR,0.96;95%CI,0.57至1.61;图3B),虽然在研究第二阶段HA高表达肿瘤的患者观察到了OS的适度获益趋势(图3C)。尽管部分患者的治疗被中断,但是在研究第一阶段中HA高表达肿瘤观察到这种趋势(图3D)。在研究的第2阶段的ITT人群中观察到PAG组患者具有统计学意义的中位OS改善(PAG v AG:11.7mv 9.7m; HR,0.63;95%CI,0.41到0.98,
P
=0 .04;图3E)。
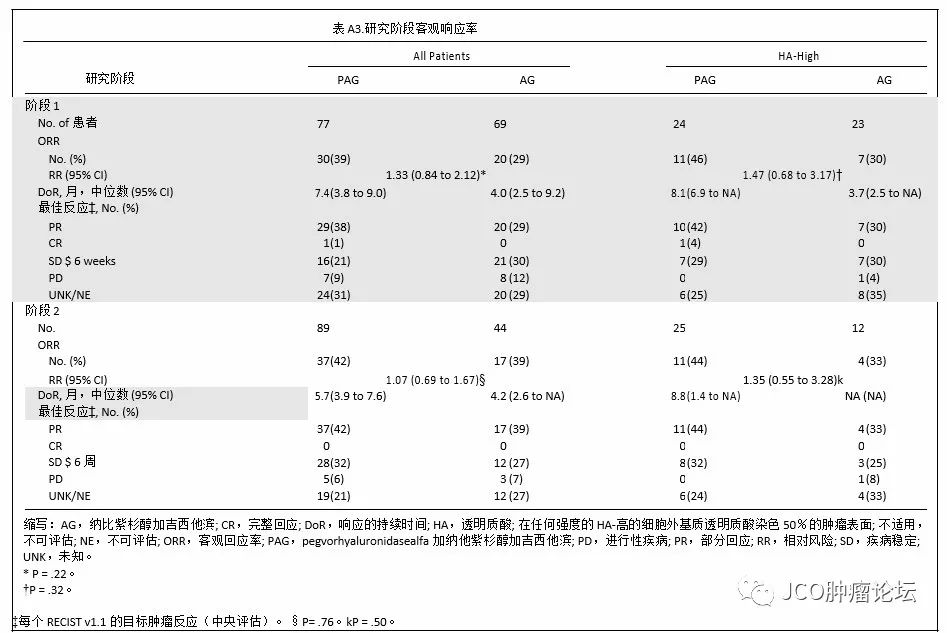
总体人群中,PAG组患者的ORR(主要是部分反应)高于AG组患者(40% v 33%;
P
= 0.23)不同研究阶段人群结果类似,尤其是HA高肿瘤患者人群更加明显(45%vs 31 %;
P
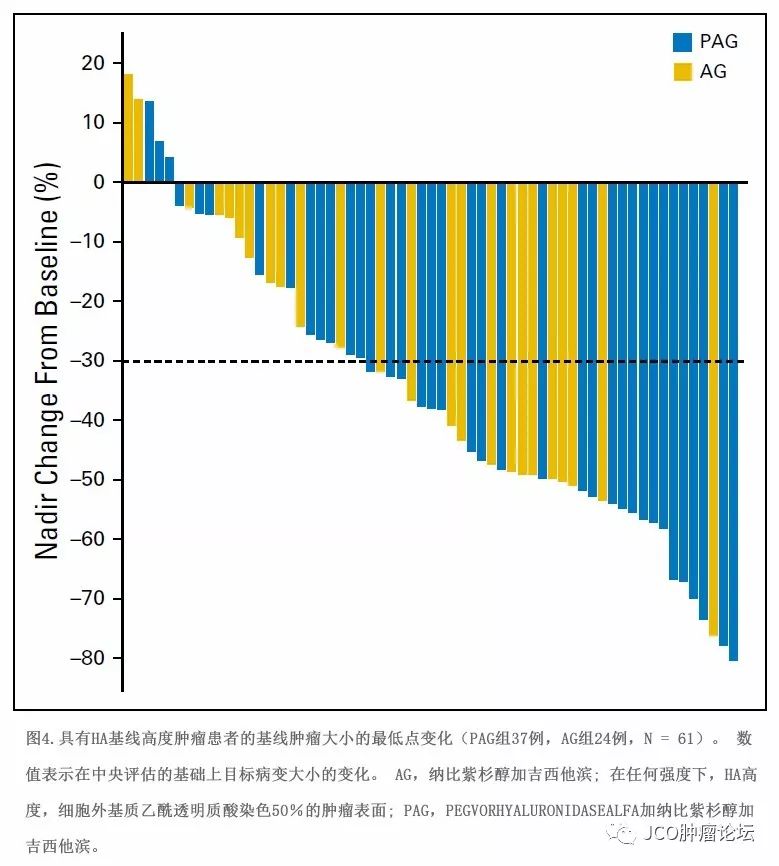
= 0.24;附录表A3,仅在线)。在61例HA高肿瘤患者(PAG组37例,AG组24例)中,至少有一次基线后肿瘤评估,接受PAG治疗患者可观察到靶病变大小的显著变小(平均[SD] PAG组为39.3 mm AG组为29.9mm[23.4mm];
P
= 0.15;图4)。一名HA高肿瘤患者接受PAG治疗后获得完全缓解。
安全:
主要安全终点TE事件的发生的。在第一阶段,PAG组43%的患者发生TE事件,而AG组25%(
P
= 0.03),事件以静脉为主。第二阶段所有患者接受依诺肝素预防后两组TE发生率(14%PAG v 10%AG;
P
=0 .77)降低。接受依诺肝素1 mg / kg / d推荐剂量预防给药患者中,TE率下降,PAG组为10%,AG组为6%(
P
= 0.72;表2)。
 HA水平与TE事件无关,无论HA状态如何,TE事件的减少均一致。动脉TE事件发生仅见于第二阶段AG组,认为与治疗无关。预防依诺肝素给药并没有增加出血风险:第2阶段不同治疗组的出血事件发生率相似(任何级别的出血事件,两组均为36%; 3级出血事件,PAG组为4%,AG组为8%)。
HA水平与TE事件无关,无论HA状态如何,TE事件的减少均一致。动脉TE事件发生仅见于第二阶段AG组,认为与治疗无关。预防依诺肝素给药并没有增加出血风险:第2阶段不同治疗组的出血事件发生率相似(任何级别的出血事件,两组均为36%; 3级出血事件,PAG组为4%,AG组为8%)。
整体安全结果。最常见的任何级别的AE(PAG v AG)为疲劳(72%vs 66%),外周水肿(63%vs 26%),肌肉痉挛(56%v 3%),恶心(49%v 47%),腹泻(40%v 39%)和贫血(39%v 38%)。两组中的大部分不良事件是轻微的(1级和2级)。PAG组和AG组最常见的3级及以上不良事件为中性粒细胞减少(29%比18%),疲劳(21%比16%)和贫血(17%比20%)。PAG组患者MSE(即肌肉痉挛,肌痛)发生率较高,但通常为1或2级,且很少导致治疗停止(肌肉痉挛,n = 4例 [2.5%];肌痛,n = 1例[0.6%])。
 在两个治疗组中报告全血细胞减少多见; PAG组的3/4级中性粒细胞减少和血小板减少症发生率高于AG组(分别为29%和18%,16%和9%,表3)。评估中性粒细胞和血小板最大基线变化时从实验室数据可观察到类似发现(3/4级中性粒细胞减少:PAG组为40%,AG组为40%)和血小板减少(3/4级:16%PAGv11%AG)时)。全血细胞减少似乎与感染(包括3级及以上肺炎3%PAG v 1%AG,发热性中性粒细胞减少4%PAG v 2%AG,中性粒细胞减少性脓毒症0.6%PAG v 1%AG)或出血无关,因为在治疗组之间没有观察到显着差异。 AE导致PAG组27%患者停药,AG组23%患者停药。
在两个治疗组中报告全血细胞减少多见; PAG组的3/4级中性粒细胞减少和血小板减少症发生率高于AG组(分别为29%和18%,16%和9%,表3)。评估中性粒细胞和血小板最大基线变化时从实验室数据可观察到类似发现(3/4级中性粒细胞减少:PAG组为40%,AG组为40%)和血小板减少(3/4级:16%PAGv11%AG)时)。全血细胞减少似乎与感染(包括3级及以上肺炎3%PAG v 1%AG,发热性中性粒细胞减少4%PAG v 2%AG,中性粒细胞减少性脓毒症0.6%PAG v 1%AG)或出血无关,因为在治疗组之间没有观察到显着差异。 AE导致PAG组27%患者停药,AG组23%患者停药。
 PAG组和AG组的与研究治疗相关的严重不良事件(SAEs)发生率分别为44%和31%,最常见的是脱水(5%v 1%),中性粒细胞减少(4%v1%)和败血症(4%v 8%)。大多数SAE发生于1-2例患者,组治疗间无显著差异。 PAG组11名SAE(7%)和AG组10名SAE(10%)导致患者死亡; PAG组中3例SAE(中性粒细胞减少性脓毒症,心脏骤停和肺炎各1例)和AG组中4例SAE(n = 3次败血症,n = 1次肺部感染)被认为与治疗有关。
PAG组和AG组的与研究治疗相关的严重不良事件(SAEs)发生率分别为44%和31%,最常见的是脱水(5%v 1%),中性粒细胞减少(4%v1%)和败血症(4%v 8%)。大多数SAE发生于1-2例患者,组治疗间无显著差异。 PAG组11名SAE(7%)和AG组10名SAE(10%)导致患者死亡; PAG组中3例SAE(中性粒细胞减少性脓毒症,心脏骤停和肺炎各1例)和AG组中4例SAE(n = 3次败血症,n = 1次肺部感染)被认为与治疗有关。
论述
这项开放性II期临床研究评估了PEGPH20联合mPDA目前一线标准化疗方案纳米紫杉醇+吉西他滨的的疗效和安全性。研究结果显示接受PAG的患者PFS显著改善,而在第研究第2阶段开始依诺肝素预防给药后TE事件发生率显着降低。
两个研究阶段患者的PFS均持续改善,尽管暂时临床持有,表明即使停止PEGPH20,治疗获益也可能持续。虽然HA高表达患者病例数有限(AG组49名患者,AG组患者35名患者),但观察到PAG最大的治疗获益,正如预期的那样,HA是PEGPH20特异性靶标 TME。这强调了靶向治疗患者人群选择的重要性。尽管在更大的队列中进行进一步的研究有必要,但这些结果明确支持了PAG治疗HA高mPDA患者的治疗潜力。
在研究的第2阶段,相对于AG组患者,HA高表达患者接受PAG治疗后可看到OS中等程度的改善,尽管统计学上无显著差异,可能亚组分析中患者例数有限。在研究第2阶段,所有患者均观察到PAG组统计上显著的OS改善。研究第1阶段和第2阶段接受PAG治疗后患者的OS获益存在明显差异,可能与几个因素(例如二线治疗)有关,但主要是研究第1阶段相对较高比例的患者(39%)在临床持有期间停用PEGPH20治疗。
PAG方案的AE是可以控制的,并且基本上与这些药物的先前研究中观察到的一致。
14,15
PAG组和AG组区差别的最常见的与治疗有关的AE为外周性水肿,MSE和全血细胞减少(中性粒细胞减少症和血小板减少症)。在PEGPH20的I期研究中,MSEs被认为是剂量限制性的,并且可以通过预防性给予地塞米松来降低其严重性。
14
目前研究中发生的MSE主要是轻度至中度严重程度,并且很少导致治疗中断。尽管PAG组白细胞减少和血小板减少的发生率较高,但没有观察到感染率和出血率的增加。值得一提的是,之前单一药物PEGPH20和PEGPH20-吉西他滨的研究没有报道这些血细胞减少的增加。
14,17
与其他癌症类型相比,胰腺癌患者处于高凝状态,伴TE事件风险增加(约7倍),转移性疾病和化疗进一步增加这种风险。
23,24
在吉西他滨治疗晚期PDA患者的随机研究中,预防血栓形成可显着降低TE事件发生率。
24
在本研究的第1阶段,AG组观察到的诸多TE事件发生证实了该疾病的高凝状态,TE事件发生率在PAG组进一步增加。在第2阶段加用enox-aparin预防性治疗后两个治疗组的TE事件发生率均降低.但出血无明显增加,支持对所有mPDA患者考虑血栓预防措施,这一点和既往研究和专家观点一致
25
。
这些研究结果的解释存在一定局限性。虽然这是一个随机2期研究,但开放标签而不是双盲的安慰剂对照设计可能影响了研究的任何一方的患者。采用研究阶段1的数据确定HA高表达切割点,这些患者构成研究中整个HA高人群的大部分。相对有限的的HA高肿瘤患者例数(PAG组为49例,AG组为35例)影响疗效评估,临床持有期间的治疗中断进一步影响评价,阻碍根据HA水平行OS和ORR分层分析的统计学效能分析。尽管有这些警告,但我们观察到AG联合PEGPH20显着改善了以前未经治疗的mPDA患者的PFS,尤其是对于HA高表达肿瘤患者。该组合毒性可控制,依诺肝素预防降低了两个治疗组的TE事件发生率。这些数据也支持把肿瘤HA作为潜在的预测标志物,选择HA高表达mPDA人群开展PAG对比AG治疗的III期临床研究的开展,这项全球研究正在开展中(ClinicalTrials.gov号:NCT02715804)。
AUTHORS’ DISCLOSURES OF POTENTIAL CONFLICTS OF INTEREST
Disclosures provided by the authors are available with this article at jco.org.
AUTHOR CONTRIBUTIONS
Conception and design
: Sunil R. Hingorani, William P. Harris, Wilson Wu. Ping Jiang, Andrew E. Hendifar
Collection and assembly of data
: Sunil R. Hingorani, Lei Zheng, Andrea J.Bullock, Tara E. Seery, William P. Harris, Darren S. Sigal, Fadi Braiteh,Paul S. Ritch, Mark M. Zalupski, Nathan Bahary, Paul E. Oberstein, AndreaWang-Gillam, Andrew E. Hendifar
Data analysis and interpretation
: Sunil R. Hingorani, Wilson Wu,Dimitrios Chondros, Ping Jiang, Sihem Khelifa, Jie Pu, Carrie Aldrich
Manuscript writing
: All authors
Final approval of manuscript
: All authors
Accountable for all aspects of the work
: All authors
REFERENCES
1. Rahib L, Smith BD, Aizenberg R, et al: Projecting
cancer incidence and deaths to 2030: The unexpected
burden of thyroid, liver, and pancreas cancers in the
United States. Cancer Res 74:2913-2921, 2014
2. Siegel RL, Miller KD, Jemal A: Cancer Statistics,
2017. CA Cancer J Clin 67:7-30, 2017













