12月19日(周四)19:00-20:00
细胞治疗快速工艺开发
马上扫码预约:
近年来,细胞治疗产业飞速发展,免疫细胞、干细胞等1500余种细胞治疗药物处于临床前或临床开发阶段,为血液肿瘤、神经肌肉疾病等带来了治愈的新希望。
以嵌合抗原受体T细胞(CAR-T)为代表的细胞治疗药品更
是
为血液系统恶性肿瘤等复发或难治性疾病提供了有效的治疗手段
。Frost&Sullivan预测,到2030年,全球CAR-T细胞疗法的市场规模
有望达到218亿美元
,前景广阔。
▲ 全球CAR-T细胞疗法市场规模预测
在这一背景下,CAR-T疗法赛道的竞争也日趋白热化。今年7月,精准生物CAR-T疗法“普基仑赛注射液”上市申请获受理,
11月,艺妙神州IM19嵌合抗原受体T细胞注射液上市申请获受理等,或将进一步加剧市场竞争。
另一方面,尽管CAR-T疗法具有显著的治疗效果,但其耗时较长、治疗费用高昂的痛点也日益凸显。
因此,如何缩短CAR-T疗法的工艺开发周期、降低成本,已成为企业亟需解决的问题。
细胞治疗作为一个“活物”,其制备生产是一个高度个性化且复杂的过程。就已获批的自体CAR-T细胞产品,治疗过程需要经过患者抽血、体外制备(激活、转染、扩增)、检验放行、冻干运输、回输患者体内等多个步骤。每一步都需严格控制以确保细胞产品的质量和安全性。
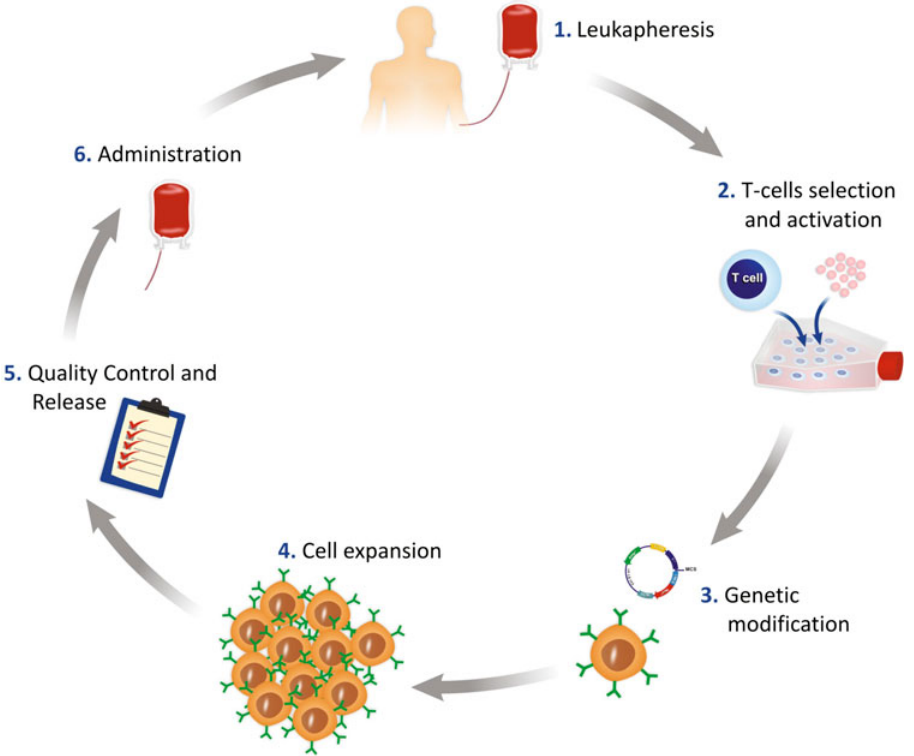
▲ CAR-T细胞治疗工作流程的示意图
从患者单采血完成,需要严格控制
运输过程中的
时间控制和温度
,以确保PBMC(外周血单核细胞)的质量、活性和回收率。
由于PBMC的组成差异很大,为保证尽量获得一致的CAR-T细胞
,需要利用基于磁珠的技术分离出特定的T细胞亚群。之后需要进行充分的转染和扩增以活化T细胞。
接着,通过
基因工程改造
对T细胞进行体外基因修饰,常用
的方法包括使用携带编码CAR受体序列的病毒载体,转座子,通过纳米颗粒、脂质体、电穿孔介导的mRNA转染方法或CRISPR/Cas9技术方法来实现T细胞的基因修饰。其中,
病毒载体修饰法的核酸残留控制尤为关键
,它直接关系到产品的注册申报与后续应用的安全性。此后,工程化的T细胞通常需要经过7-10天的扩增达周期以满足治疗所需的细胞数量
。在质量上,
T细胞分选效率、T细胞转染阳性率是制备出合格有效CAR-T细胞的关键指标
。
通过严格的检验标准后,产品方可放行用于临床治疗。
随着技术的
不断进步和市场竞争的加剧,各大企业和研究者们纷纷致力于缩短CAR-T疗法的
工艺开发周期,降低成本,以提高CAR-T的可及性
。
诺华T-charge平台
删减了传统CAR-T细胞生产环节中在生物反应器中的扩增部分,而是将该环节置于患者体内
。
此平台能有效维护T细胞的原始干性,赋予CAR-T产品更强劲的增殖能力及更低的T细胞耗竭率,从而可能为患者带来更佳的预后效果,并显著降低严重不良事件的风险。
诺华公布了其基于T-charge平台设计的一款在研的靶向CD19的CAR-T细胞疗法YTB323(rapcabtagene autoleucel)的数据,其
door-to-door时间大约为10天左右
(door-to-door时间定义为从提取白细胞分离材料到将最终产品送回治疗地点的时间);在DLBCL患者中CR(Month 3)可达到73%。
亘喜生物(阿斯利康集团成员)的FasTCAR平台,
将自体CAR-T的三个主要生产步骤“激活、转染和扩增”缩短为“同步激活-转染”一步完成,
将自体CAR-T细胞生产时间从行业标准的1到6周,显著缩短到24小时内生产完毕
。
艺妙神州基于高效快速
CAR-T制备平台开发了自研产品InstanCAR-T细胞
,用于治疗复发或难治性多发性骨髓瘤。
该临床数据显示展现出良好的安全性、有效性以及抗肿瘤效率,回输后的最佳客观缓解率ORR达到100%,并以更低的给药剂量显示更强的肿瘤抑制效率和体内扩增效率。
重要的是,将
自体CAR-T细胞生产时间从行业标准的
9到14天,显著缩短到3日
以内生产完毕
,提高了该产品的临床疗效和患者可及性。
CARcelerate是科济药业开发的专有平台,可将
生产时间缩短至30小时左右
,因此相较于传统生产过程可制造出更年轻且可能更强效的CAR-T细胞。
邦耀生物的Quikin CART平台只需一步即
可同时实现T细胞内源基因的调控和CAR的持续性表达
,利用CRISPR/Cas9基因编辑技术对T淋巴细胞中PD1位点精确编辑,定点插入针对肿瘤细胞的靶向CD19的CAR分子,使用非病毒生产工艺能减少复杂的工艺和生产检测成本,快速生产通用型CAR-T细胞。
目前基于Quikin CART平台开发的“靶向CD19非病毒PD1定点整合CAR-T细胞注射液”(管线代号:BRL-203)已开展了针对复发难治性非霍奇金淋巴瘤的IIT临床研究,展现了出色的安全性和有效性。
北卡罗来纳大学教堂山分校和北卡罗来纳州立大学的研究人员开发出一种可植入的支架MASTER,由具有生物相容性的海绵状材料制作,可将
CAR-T的制备时间缩短至1天,
并在体内快速有效地释放CAR-T细胞来攻击肿瘤。
通过手术将移植物植入体内后,能够将T细胞激活、重编程、扩增步骤整合在体内完成。
在临床前试验中,体内制备的CAR-T疗法展现出了更强的持久性。
宾夕法尼亚大学研究团队在
Nature
上发表了文章,开发了一种新型的CAR-T细胞制备方法,可以在
24小时内制
备好CAR-T细胞,且不影响治疗效果。
研究人员
通过慢病毒载体转染非活化静止T细胞,从患者体内提取T细胞之后能够直接被制备成CAR-T细胞,提升速度的同时也保证了T细胞具有良好的活力
。
Precigen的UltraCAR-T平台通过非病毒睡美人系统革新自体CAR-T制造,实现
一日
内快速给予患者,缩短治疗等待时间,并以内在检查点阻断机制应对肿瘤微环境,降低成本。
mRNA载体是使用较少的一类非病毒载体,机制是把
CAR基因通过体外转录成mRNA,再通过电穿孔转染到T细胞。
将mRNA载体应用于CAR-T治疗的最大优势是:T细胞无需激活,仅需
1天即可快











