今天是2017年7月14日
农历六月二十一
医麦客:联合疗法是大势所趋
2017年7月14日/医麦客 eMedClub/--近期,肿瘤免疫疗法领域的热度一再飙升,其中被以PD-1/PD-L1为代表的检查点抑制剂尤为火爆。
但事实上,抗癌神药并没有那么“神”,因为单一的治疗药物只能抑制肿瘤生长的一条信号通路,而肿瘤作为是一种多通路、多靶点的疾病,它的逃生渠道是有很多的。所以“孤军奋战”可能会徒劳而返,“团灭”才是王道!
检查点抑制剂单药治疗
位于免疫疗法尖端的免疫检查点阻断剂,其实令很多癌症闻风丧胆,尤其是对于那些恶性且化学药物耐受性癌症的治疗,有着显著疗效。其中效果最显著的是CTLA-4以及PD-1两类免疫检查点阻断剂。
1.PD-1阻断剂
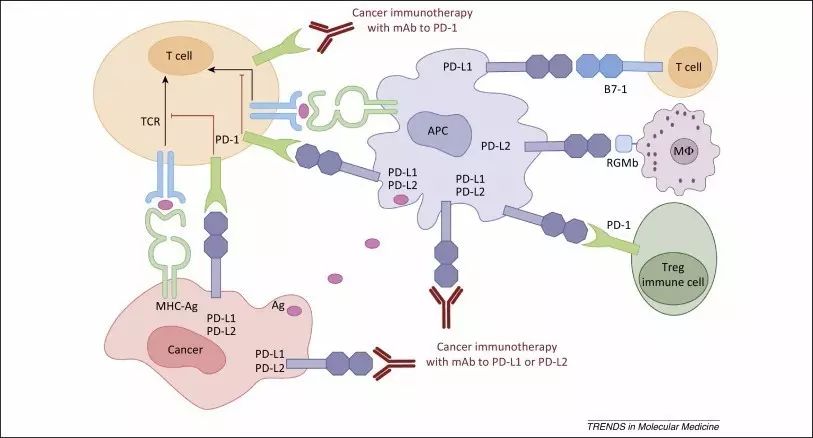
PD-1细胞内通路及作用机理(图片来源:blogs.shu.edu)
程序性死亡受体-1( Programmed death-1,PD-1),是T细胞上的一种抑制性受体。PD-1能够与配体(Programmed death-1 ligand,PD-Ls)PD-L1、PD-L2相互作用,可以抑制T细胞增殖使其活化同时促进细胞因子的分泌,是调节T细胞反应的重要免疫开关。而在肿瘤患者体内,PD1、PD-Ls信号通路却也能通过抑制T细胞的免疫反应,从而促进肿瘤免疫逃逸的发生。
以下是它的临床进展汇总:
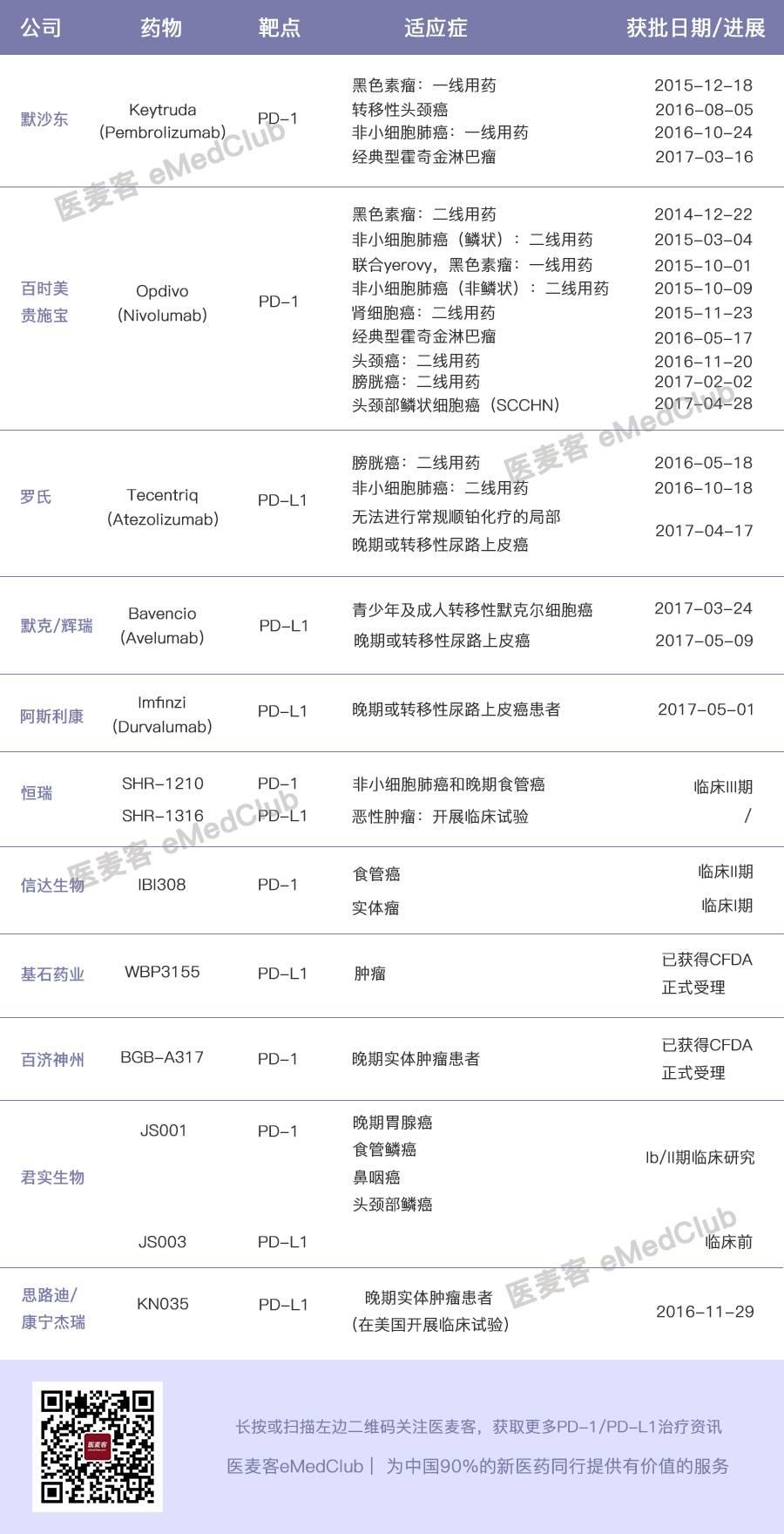
尽管抗PD-1/PD-L1抗体治疗取得了良好的效果,但是大部分患者对治疗并不敏感,且部分敏感患者在治疗后并没有达到完全缓解。例如,在不同进行性实体瘤患者的治疗中,nivolumab 的总体反应率为31%,反应持续时间约2年,中位数总生存期是16.8个月。
2.CTLA-4阻断剂
CTLA-4是第一个用于临床的免疫检查点阻断剂靶点,CTLA-4表达于T细胞表面,与其配体B7.1、B7.2结合后,可抑制T细胞活化的早期阶段,导致肿瘤细胞免疫逃逸。
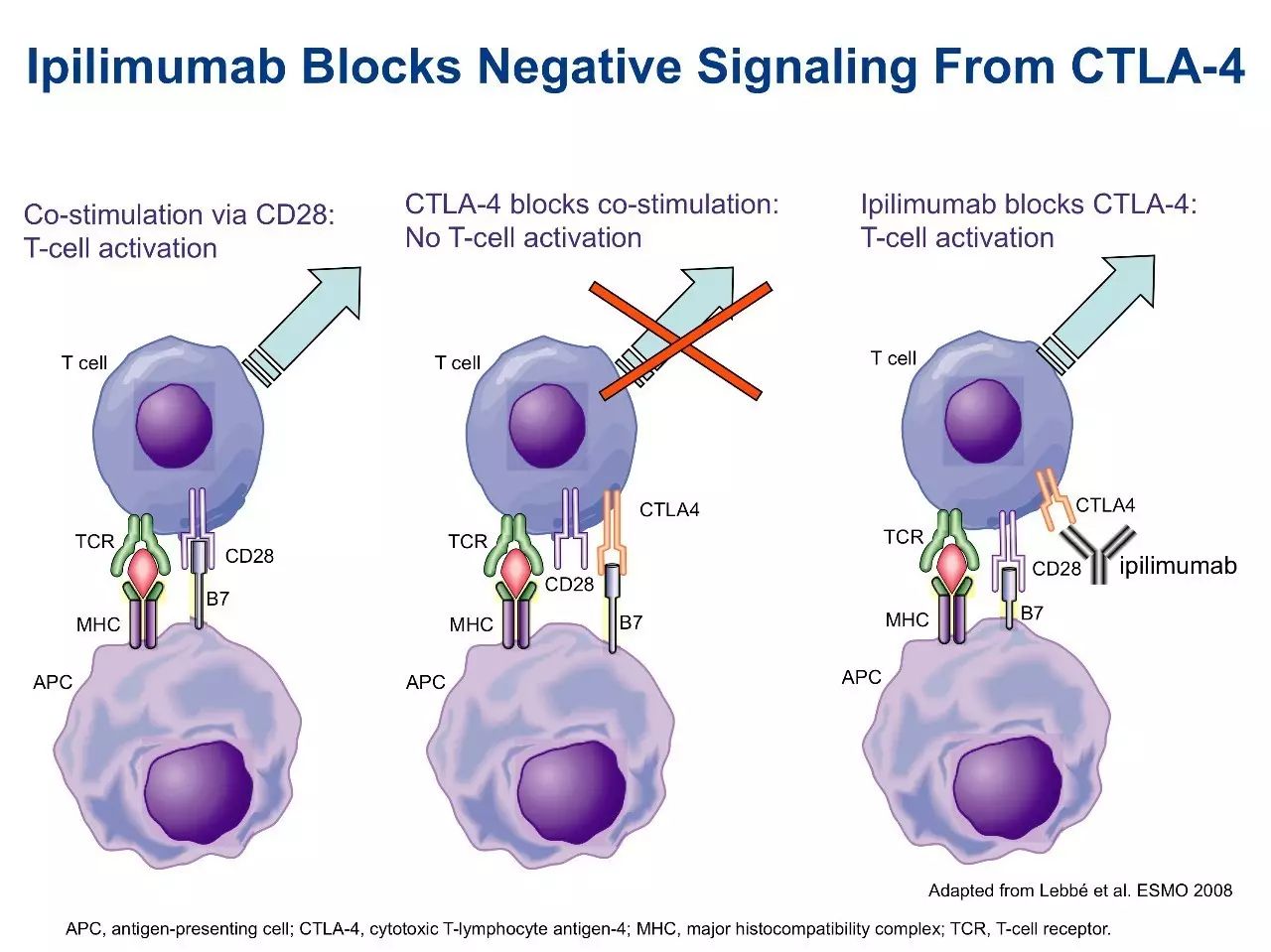
Ipilimumab作用机理(图片来源: cancergrace.org)
免疫检查点阻断剂与CTLA-4结合后,使其T细胞活化并增殖,同时免疫功能增强,从而发挥抗肿瘤作用。
之前的临床研究表明,小鼠动物模型中阻断CTLA-4显示出对肿瘤的控制率提高。这就促使了CTLA-4抗体的产生,CTLA-4抗体能偶通过以下两种方式将肿瘤细胞杀死:
干扰肿瘤特异性效应细胞如CD8细胞,导致其克隆扩增
去除肿瘤诱导的调节性T细胞(Treg),Treg细胞可抑制肿瘤相关抗原的免疫反应
YERVOY(图片来源:cancernetwork.com)
目前,有两种靶向CTLA-4的抗体Ipilimumab和Tremelimumab,已广泛用于治疗黑色素瘤、肾癌、前列腺癌、肺癌等。Ipilimumab在NSCLC的一线治疗中与化疗药物配对使用,(紫杉醇/卡铂)具有可控的毒副反应且患者耐受性良好。此外Ipilimumab联合紫杉醇/卡铂一线治疗广泛期小细胞肺癌(ED-SCLC),使患者的总体生存期得到明显改善。
但是,对于这些药物治疗过程中出现的一些不足的确无法视而不见,比如,在使用Ipilimumab的临床试验中,10%~20%的患者在开始治疗的三个月后出现了肿瘤增大现象,但随后在没有任何其它干预的情况下使肿瘤消退时间发生延长,在其他肿瘤类型,比如前列腺癌,在多发性阶段发现用ipilimumab治疗的患者生存率并没有得到改善。
此外,2016年,tremelimumab在一个治疗间皮瘤的二期临床试验中,也因为没有改善患者的总生存期而失利。
3.LAG-3阻断剂
LAG-3三级结构(图片来源:en.wikipedia.org)
淋巴细胞活化基因3(LAG-3),是一种在效应T细胞和调节T细胞(Treg)表面表达的免疫检查点受体蛋白,它可以控制T细胞的应答、活化与生长。临床前研究显示,抑制LAG-3可以让T细胞重新恢复细胞毒作用,从而限制肿瘤的生长。
LAG-3抑制剂已经开始在人类中进行临床的I / II期试验,结果表明该药物对于肾细胞癌和转移性乳腺癌患者都有一定的改善作用。
4.TIM-3阻断剂
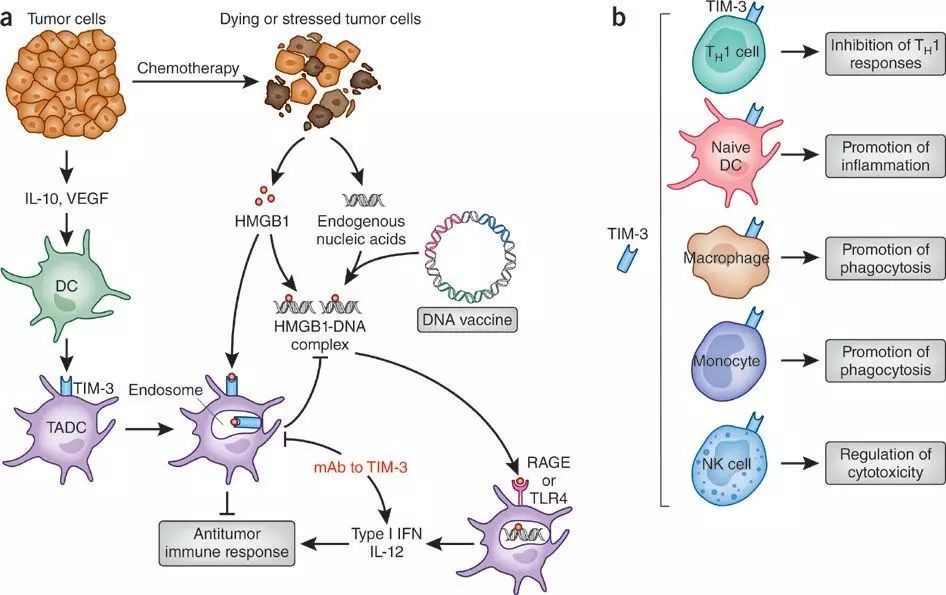
TIM-3抗体作用机制(图片来源:nature.com)
TIM-3(T cell immunoglobulin domain and mucin domain-3)是一类T细胞表面抑制性分子,能够引起癌症与慢性病毒感染过程中T细胞的衰竭。与其他免疫检查点分子不同的是,TIM3 并非在所有 T 细胞激活后得以上调,仅在 CD4+ 辅助 T 细胞 1(Th1)和 CD8+ 细胞毒性 T 细胞中上调,并参与协同抑制作用。在由其配体 galectin-9 激活后,TIM3 会抑制效应 T 细胞的活性。因而在 T 细胞在肿瘤中的损耗中起着关键作用。
检查点抑制剂单药治疗的障碍
肿瘤的抑制性是在肿瘤治疗的途中的第一大阻碍。越来越多的肿瘤针对抗体出现了更多的突变可能性,抵抗药物,逃避免疫系统的监视。在免疫治疗中,优先存活的细胞是那些有能力在周围创造免疫抑制环境的肿瘤细胞。
在使用PD-1 / PD-L1阻断剂时,会使免疫细胞对肿瘤的攻击重新激活。根据早期的临床数据,单克隆抗体阻断剂治疗骨肉瘤既可作为单一药物,也可用作单克隆抗体与另一种单克隆抗体阻断疗法联合使用时效果更为显著。 可见,为了防止这种逃逸的发生,组合治疗方法显然是首选,对于治疗持续性病毒感染也是如此。
在一项有关慢性淋巴细胞性脉络丛脑膜炎的小鼠模型中,研究者首先观察到有大量的T细胞耗竭病毒(LCMV)存在,这导致小鼠体内耗竭的T细胞无法迅速增殖,更无法产生抗肿瘤细胞因子或发挥细胞的毒性功能杀死病毒。 研究中同时发现,在一例中发现,PD-1阻断性药物能够将感染了慢性LCMV的小鼠中的T细胞激活,但是,这种PD-1 / PD-L1阻断作用并不完全,无法将所有耗尽的T细胞的功能恢复,最终使病毒逃脱。尽管T细胞耗尽现象在许多患有慢性病毒感染的艾滋病毒,乙型肝炎病毒或丙型肝炎病毒的人中频频出现,也观察到免疫检查点阻断剂能够在体外恢复T细胞的功能。但是,艾滋病毒从这种免疫应答中逃脱,从而导致持续的无免疫控制的病毒血症。医生正在研究一种与抗逆转录病毒疗法结合的联合疗法,以减少病毒抵抗和逃脱的机会。
检查点抑制剂联用临床进展
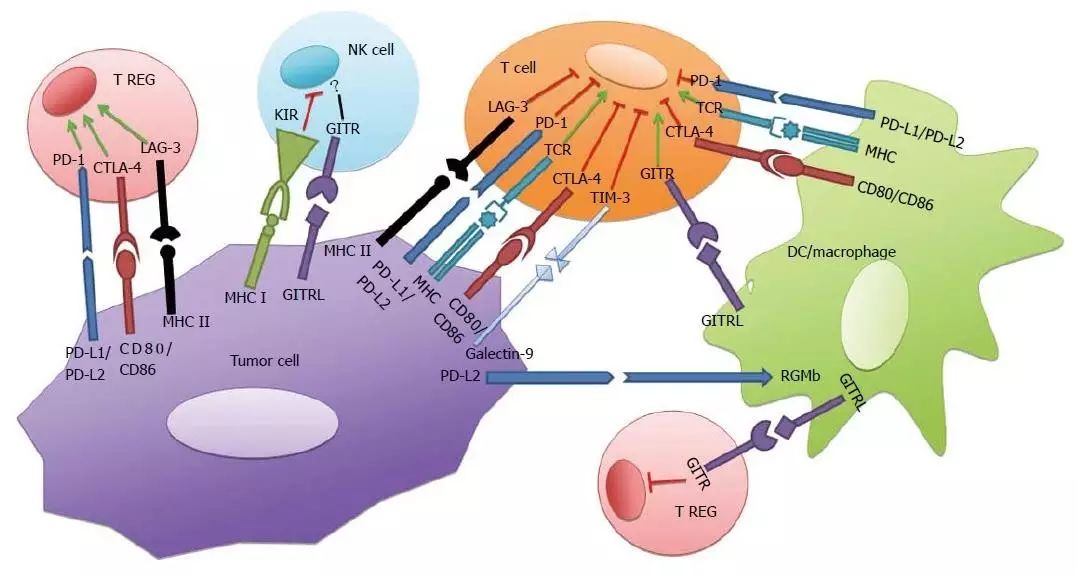
阻断靶点一览(图片来源:wjgnet.com)
抗CTLA-4与抗PD-1/PD-L1联用
治疗黑色素瘤
2011年,FDA批准了CTLA-4抗体(Ipilimumab,Yervoy)用于治疗转移的黑色素瘤患者;2014年,FDA批准PD-1抗体用于治疗CTLA-4无效的晚期黑色素瘤患者。而二者联用后效果令人惊艳。
2013年6月2号的《新英格兰医学杂志》,公布了关于Opdivo(BMS的PD-1抗体)和Yervoy(BMS的CTLA-4抗体)联合使用治疗黑色素瘤的临床数据。该试验招募了53名患者进行联合用药,总的1年和2年生存率是82%和75%,17%的患者完全缓解,36周之后,42%的患者肿瘤减少80%,BRAF突变对结果无影响。虽然副作用明显(3/4级副反应达53%)但是疗效真的令人吃惊。
2015年的4月20号《新英格兰医学杂志》公布了BMS的Opdivo和Yervoy的第二次的联合用药的临床数据,招募了142名之前未经治疗的转移的黑色素瘤患者。数据表明,联用组的ORR为61%,CR为22% VS Yervoy单用组的ORR为11%,CR为0;三到四级副作用联用组是54% 而Yervoy单用是24%。根据统计的患者的肿瘤大小情况,发现联用组的患者肿瘤平均缩小68%。
5月31号,新英格兰又公布了一个数据,包含945名患者,比较Yervoy单用、Opdivo单用和二者联用的临床效果。从肿瘤缩小的程度来看,Opdivo单用缩小34%,联用缩小51%,Yervoy缩小6%,联用比任何的单用效果都要好。
治疗非小细胞肺癌
2016年,ASCO公布了MERK的Keytruda和Yervoy联用治疗NSCLC的一期数据:11名患者(都是3B期或是4期)在接受不同浓度的Keytruda(10mg/kg或2mg/kg)和Yervoy(3mg/kg或1mg/kg)治疗后的临床数据显示,根据完全缓解+部分缓解+病情稳定6周算,100%的患者都能够达到这个标准。
效果这么好,用“惊艳”真的一点不为过!
抗TIM3 和 抗PD-1联用
Hammerman和他的同事曾经在《自然》发表了一项研究结果,其中指出,适应性耐药造成TIM-3和其它免疫检查点上调。研究人员用2个临床恶性肺癌基因突变模型,如EGFR和KRAS基因,用完全免疫感受态小鼠做实验。在PD-1阻断抗体治疗前、中、后分析肿瘤免疫微环境。结果发现,TIM-3在用抗PD-1治疗产生耐药性的动物的T细胞中高表达。而在这项独立实验中,当抗TIM-3抗体与抗PD-1药物联用时,可抑制抗PD-1治疗耐药性的产生。这也说明了,使用抗PD-1疗法治疗失败与限制抗肿瘤免疫反应的免疫检查点的上调有关。
在黑色素瘤患者中,可检测到 TIM3 与 PD-1 共表达,这一共表达表明肿瘤中 CD8+T 细胞的大量损耗。在 NSCLC 患者中,仅 CD4+ 和 CD8+ 的 TILs 中的 TIM3 表达上调,外周血 T 细胞不出现这一变化。CD4+T 细胞中 TIM-3 的表达与淋巴结转移和肺癌晚期相关。其他相关研究也表明,联合抑制 TIM3 和 PD-1 的效果优于单独抑制疗法。
在黑色素瘤患者中,检测到 TIM3 与 PD-1 共表达,而在另一项基于小鼠模型的实验中发现,将 TIM3 阻断剂与 PD-1阻断性抗体联合使用,可以提高小鼠生存率,在实体瘤结肠癌的小鼠模型中,发现TIM-3和PD-1阻断性单克隆抗体的联合使用,可以显著减缓小鼠体内的肿瘤生长。但是单独使用TIM-3单克隆抗体疗效并不明显,这可能与两种阻断行抗体的协同效应有关。
抗LAG-3与抗TIM-3联用
此外,其他临床关注的共抑制受体包括LAG-3和TIM-3 。在Sa1N纤维肉瘤模型和MC38结肠腺癌中,阻断LAG-3和PD-1阻断剂联合使用,对于肿瘤控制效果与单剂治疗相比似乎相同,而对于B16黑素瘤的效果并不明显,可能存在着其他调节机制。
在阻断性甲基胆素诱导的纤维肉瘤中,TIM3和PD-1都抑制了肿瘤的生长,甚至在一小部分小鼠中,它们体内的肿瘤能够完全被清除。
总之,组合治疗能够更好的对抗肿瘤,可能是由于组合疗法中有效克服了肿瘤细胞的逃避免疫的障碍。而耐药性依旧是癌症治疗中最困难的挑战之一,也是未来治疗癌症需要不断努力的方向。 通过不同的阻断性抗体的联合使用,有效地避免了肿瘤细胞逃避免疫的难题,也让我们看到癌症治疗的新曙光,让我们共同期待后续的新突破!
参考出处:
http://dx.doi.org/10.5772/67687
https://endpts.com/astrazenecas-shares-spike-on-positive-phiii-lung-cancer-data-but-its-not-mysmys/
http://www.biospace.com/News/bristol-myers-squibbs-next-big-bet-after-opdivo/451640/source=TopBreaking
http://investors.linkp.com/releasedetail.cfm?ReleaseID=1020059
https://clinicaltrials.gov/
http://www.cornerstonepharma.com/index.php/clinical-trials
http://www.beigene.com/?lang=zh-hans
http://www.junshipharma.com/
http://www.innoventbio.com/default.aspx
医麦客 丨出品
为生物医药发声的专业媒体人
转载请联系:[email protected]
☟ 阅读原文 免费加入「个人会员」



















