光动力疗法(PDT)
通过光敏剂产生活性氧(ROS)杀伤病变细胞,但其应用受限于传统光引发剂的毒性、依赖紫外线或需有毒助引发剂等问题。此外,术后组织修复需个性化支架材料,而兼具光引发、光敏功能且可3D打印的智能水凝胶仍亟待开发。
因此,
如何实现高效、安全的光动力治疗与组织再生一体化
,成为生物医学材料领域的重要挑战。
鉴于此,来自
阿根廷国家科学技术研究委员会(CONICET)的Rodrigo E. Palacios团队与西班牙巴斯克大学的Miryam Criado-Gonzalez团队
联合开发了一种基于聚(3-己基噻吩)半导体纳米颗粒(P3HT SPNs)的智能光响应水凝胶。该材料
兼具光引发剂和光敏剂功能
,可用于3D打印个性化支架并实现光动力治疗。相关研究以
“Poly(3-hexylthiophene) nanoparticles as visible-light photoinitiators and photosensitizers in 3D printable acrylic hydrogels for photodynamic therapies”
为题发表在
《Materials Horizons》
上。

以下是对本论文创新点的简要概述:
(1)双功能纳米粒子设计:
P3HT SPNs首次实现“一材双用”:既作为可见光引发剂诱导水凝胶聚合,无需有毒助剂;又作为光敏剂触发ROS生成。其高生物相容性与光响应特性突破了传统光引发剂局限,为可植入医疗材料提供了新思路。
(2)高精度3D打印支架:
通过数字光处理(DLP)技术,结合P3HT SPNs的光引发效率,成功打印高分辨率水凝胶支架。该支架可定制形状与力学性能,贴合术后组织缺损,为个性化再生医学提供技术基础。
(3)时空可控ROS疗法:
可见光(λ=467 nm)可精准激活水凝胶局部产生活性氧(12-15 μM H₂O₂),实现癌细胞(50%杀伤)和细菌(99%灭活)的高效靶向清除,同时避免对健康组织的非特异性损伤,显著提升治疗安全性。
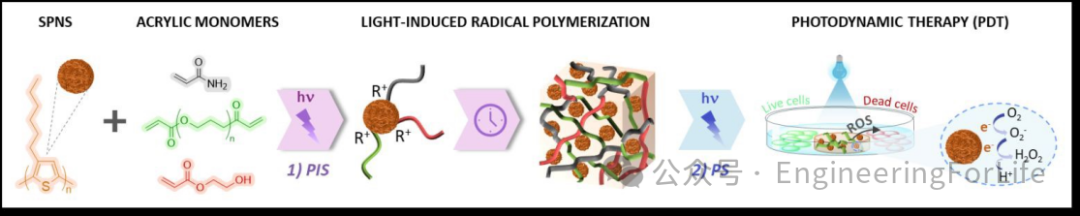
图1 光响应水凝胶的双功能P3HT SPNs机制
该研究不仅为光动力治疗提供了新型智能材料,更将3D打印技术与精准医学结合,推动癌症治疗与组织修复的一体化发展。
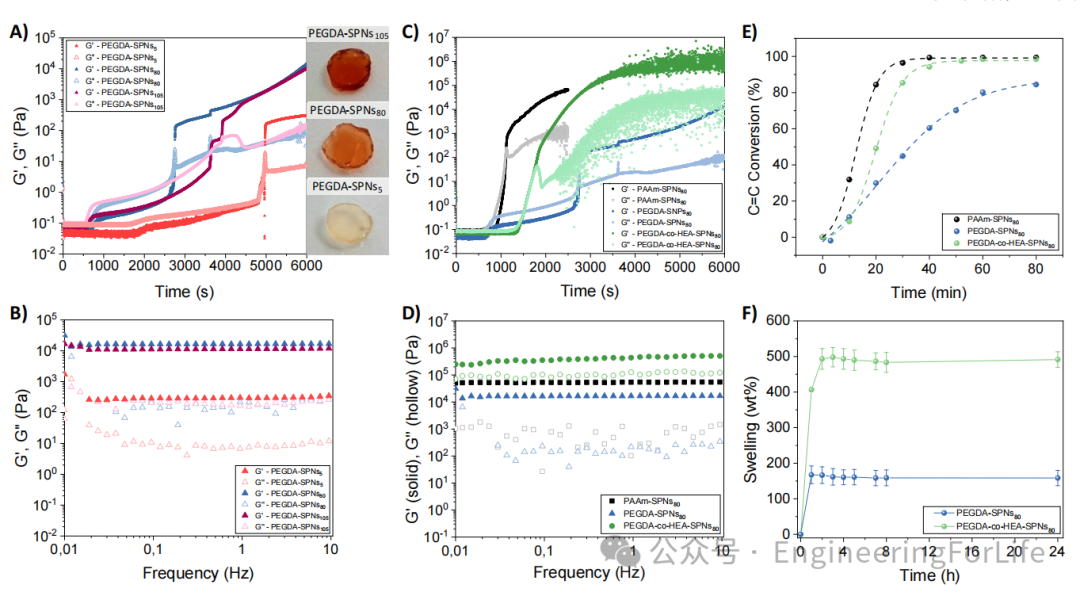
1. 双功能P3HT纳米粒子实现光引发与光敏协同作用
本研究首次利用聚(3-己基噻吩)半导体纳米颗粒(P3HT SPNs)同时作为可见光引发剂和光敏剂。在可见光(λ=467 nm)照射下,P3HT SPNs无需毒性助引发剂即可高效诱导丙烯酸单体(如丙烯酰胺、聚乙二醇二丙烯酸酯)的光聚合,形成稳定水凝胶。通过光流变学与傅里叶红外光谱分析,发现SPNs浓度显著影响水凝胶的凝胶化时间和力学性能。例如,SPNs浓度为80 mg/mL时,凝胶化时间缩短至45分钟,且弹性模量(G')高达1×10⁴ Pa。同时,嵌入水凝胶的P3HT SPNs保留光敏特性,可在光照下产生活性氧(ROS),实现光动力治疗(PDT)的双重功能。