

2017 Antibody Engineering & Therapeutics 现场速递二
美国当地时间2017年12月14-15日,2017 Antibody Engineering & Therapeutics会议进入第三天和第四天,AET 2017会议精彩继续。第三天的会议主要包含三个大的主题:1)Fc受体参与的生物学效应研究;2)抗体药物的新适应症;3)抗体药物在肿瘤微环境调节中的应用研究。第四天的会议仍然延续前面几天主题,关注创新抗体和T细胞相关的免疫检查点疗法。
纵观本届AET的相关报告,虽然近些年抗体药物取得长足的进展,特别是PD-1/L1为代表的抗体药物开启新的药物研发方向,但创新仍然是当前抗体药物开发的主题,抗体偶联药物、双特性抗体、神经退行性疾病抗体、血脑屏障透过抗体甚至其他免疫疗法仍然在探索中艰难前进,期待明年的AET这些领域能够传来更多捷报。
同时华人抗体协会第二届年会主题也已确定为Therapeutic antibodies: frontiers and opportunities (抗体药:前沿与机遇),届时(2018年4月29日, 即2018 PEGS US会议召开的前一天)会带来属于华人抗体药物在创新方面的成果
(
长情的等待--2018年华人抗体协会年会筹办工作全面启动
)。
前文已经对本届AET的前两天内容做过报道速递(
2017 Antibody Engineering & Therapeutics 现场速递一
),本文仅对
AET 2017后两天的
会议中的几个重点报告进行报道。
Tregs的耗尽(depletion)在抗体药物肿瘤治疗中的作用逐渐被证实
调节性T细胞(Regulatory cells,简称Tregs)是一群具有免疫抑制功能的T细胞,是肿瘤浸润性淋巴细胞中起到免疫抑制作用的关键细胞,主要包括天然型Treg(CD4+CD25+Treg)和诱导型Treg(iTreg)两大类。天然型Tregs直接由胸腺细胞经历阴性和阳性选择发育而来,iTreg在外周组织器官中由Foxp3+T细胞在诱导下转化而来。Tregs在慢性免疫应答中可以限制自身免疫造成的组织损伤,但却给肿瘤逃避机体的免疫创造了条件。
研究表明:Tregs可以通过多种途径抑制机体免疫反应,促使肿瘤细胞发生免疫逃逸:1)Tregs通过分泌多种抑制性细胞因子,如转化生长因子-β(TGF-β)、IL-10、IL-35等,发挥免疫抑制效应;2)Tregs表面组成性表达CD25(IL2Rα链),能与效应T细胞竞争性结合并大量消耗IL-2,从而抑制效应细胞(如CD4+和CD8+T淋巴细胞)的增殖;3)Treg表面组成性表达细胞毒性T淋巴细胞抗原(CTLA),能与DC表面配体CD80和CD86相互作用,从而阻断它们的共刺激功能和随后的T细胞活化;4)在肿瘤微环境中Treg可以表达颗粒酶B,以颗粒酶B/穿孔素依赖的方式使自然杀伤细胞(NK)、细胞毒性T淋巴细胞(CTL)等溶解,抑制机体抗肿瘤免疫。具体作用机制如下图所示。
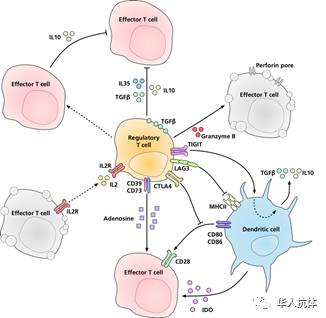
基于以上理论,在本次会议中,多位科学家阐述了Tregs的耗尽在抗体药物肿瘤治疗中的重要作用,以下分别予以介绍。
IL-2是具有多向性作用的细胞因子,能促进淋巴细胞的生长、增值和分化,对机体的免疫应答和抗病毒感染等有重要作用,目前已成为肿瘤免疫治疗研究的热点之一。最早曾有临床直接使用IL-2治疗肾癌的先例,7-8%的病人在治疗后的几十年内病情没有进一步发展,但同时也出现了4%左右的致死率以及严重的副作用,此治疗方法被放弃。之后,抗体与IL-2的连用被发现有很好的抑制肿瘤效果。其中的好处之一是延长IL-2的半衰期(单独使用IL-2的副作用很可能是因为IL-2本身的半衰期只有5分钟,因此需要长时间大剂量输液给药)。
业界由此开始研究IL-2/抗体连用抑制肿瘤的机理。最初的假设是,抑制肿瘤是因为IL-2/抗体连用以后,抗体阻断了IL-2与CD25的结合,同时大大增加了CD8+ T细胞的数量,以及NK细胞的数量,因此机理被认为是CD8+ T 细胞以及 NK 细胞的增加。而在这次会议中,来自Garvan医学研究所的Daniel Christ教授则给我带来了他的新发现。
Christ教授的工作分为两个部分,第一部分,他将IL-2上与CD25结合的氨基酸位点进行突变,同时以两个IL-2分别代替一个Fab,做成两个突变IL-2加一个Fc的融合蛋白。理论上,此融合蛋白应该具有IL-2/抗体连用的全部有利性质。体内实验的结果也与此假设相符:突变IL-2/Fc融合蛋白在体外实验中可以大量增加CD8+ T细胞的数量以及NK细胞的数量,被认为是潜在的治疗药物。Christ教授的第二部分工作是将此融合蛋白用于小鼠中观察其抑制肿瘤的效果,其对照实验是用未被突变、依然与CD25结合的IL-2与Fc的融合蛋白。这个wt IL-2/Fc融合蛋白在第一步体外实验中,增加CD8+ T细胞以及NK细胞数量的能力极差,很好的完成了对照试验的任务。但是,在小鼠的体内实验中,wt IL-2/Fc融合蛋白抑制肿瘤的效果却大大高于突变IL-2(不结合CD25)与Fc的融合蛋白(具体实验结果如下图所示)。
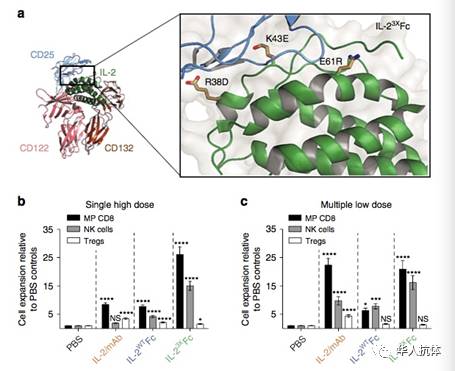
由此,Christ教授转向研究IL-2抗体连用的真正机理。上述体内实验已经证明在融合蛋白中IL-2与CD25结合的能力是抑制肿瘤的必要条件。进一步,Christ教授通过突变去掉了融合蛋白中Fc与FcγR的结合能力,并发现小鼠中抑制肿瘤的效果也大打折扣。综上所述,此报告说明对于IL-2/抗体连用来说,抑制肿瘤的效果并不一定是基于增加了CD8+ T细胞以及NK细胞的数量,而是基于IL-2与CD25结合的能力,以及Fc与FcγR的结合。此发现揭示,Treg细胞的耗尽很可能是IL-2/抗体连用或融合蛋白的抑制肿瘤的真正机理,而并不是CD8+ T cell以及NK细胞数量的增加。
上节中我们看到,Tregs的耗尽可能是IL-2/抗体联用或IL-2/Fc抑制肿瘤的真正原因。来自Genentech的Ernst博士同样认为,Tregs的耗尽在PC61抗体药物中的作用也至关重要。Ernst博士先从两个已经被批准的CTLA-4抗体药开始,尝试解释CTLA-4抗体的作用机理。简单来说,Ernst认为:CTLA-4抗体的作用机理有两个,一是ADCC功能,二是Tregs在肿瘤中的耗尽(如下图所示)。
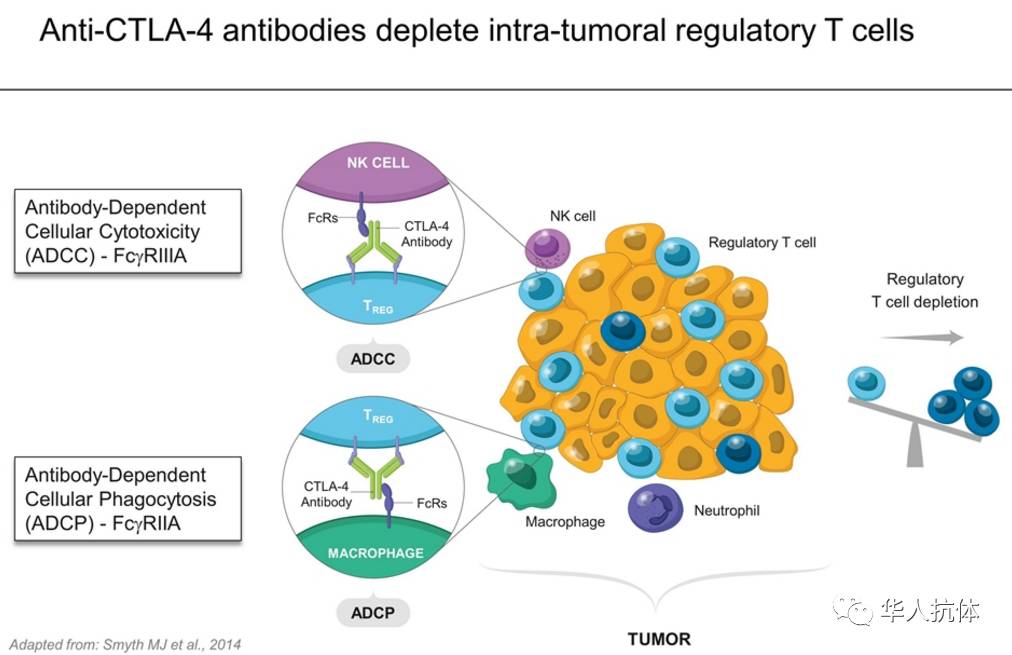
这里有几点值得大家注意:最初,在小鼠中使用PC61并没有抑制肿瘤的效果,而此时血液中的Tregs的确已经被耗尽,如何解释这个现象?Ernst博士后来发现,虽然血液中的Tregs被耗尽,但在肿瘤微环境中,Tregs所占T细胞的比例并没有发生变化。但是理论上,所有可以提高CD4 CD8 T细胞数量,同时减少Tregs细胞数量,也就是减少Tregs细胞所占比例提高Effector T细胞比例的方法都可能有抑制肿瘤的作用,机理与CTLA-4抗体类似。因此,分析并找到在Effector T细胞表面少数表达,而在Tregs表面大量表达的抗原(比如:CTLA-4)也许是找到潜在靶点的方法之一。
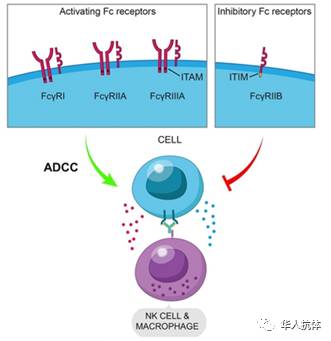
PC61在小鼠肿瘤微环境中没有耗尽Tregs的原因,很可能是因为PC61对于活化性的FcγR以及抑制性的FcγR有着相同的作用,同时Tregs表面同时大量表达活化性FcγR以及抑制性的FcγR,导致PC61作用于Tregs时,Activation/Inhibition Ratio 接近于1,此时,PC61在肿瘤微环境中无法起到耗尽Tregs的效果。Ernest教授把PC61的背景从IgG1换到IgG2a以后,改变了Activatin/Inhibition Ratio,增强了PC61耗尽Tregs的效果,与PD-1联用时,出现了明显的肿瘤抑制效果。同时,在设计抗体时,需要注意人的IgG与不同的FcγR结合的亲和力与小鼠中不同。
与前面两个报告稍有不同,来自Gilead的Wilson博士观察到,在肿瘤微环境中的Tregs过度表达(overexpress)OX40以及GITR,在血液中的Tregs则没有这个特性。Wilson博士尝试理解OX40抗体以及GITR抗体的作用机制。
报告中的以下几点值得关注:第一,Wilson博士发现,临床上表现比较好的两个OX40以及GITR抗体,都可以在细胞表面产生clustering,Wilson博士认为,clustering导致的进一步信号传导是这些抗体起作用的可能机理之一。第二,他认为OX40和GITR抗体起作用的另外一个可能机理是基于Tregs的耗尽,因为在受过OX40、GITR抗体处理后的肿瘤微环境中也观察到了Tregs耗尽。但是,真正的机理到底是抗体导致的细胞表面的clustering激活细胞内部信号通路,还是通过Tregs耗尽从而产生肿瘤抑制效果,Wilson教授认为现在业界并没有达成一致。此外,Wilson教授展示的体内数据显示,抗体的亲和力并不一定是越高越好,当亲和力达到一定程度,临床上需要的剂量反而随着亲和力的增加而同时增加。因此抗体的亲和力很可能有一个sweet spot。对于产生此现象的具体原因,Wilson教授表示并不明确,也许是因为亲和力强到一定程度单臂与抗原的结合产生了影响,也可能与内吞有关,并无定论。
双特异性抗体可通过其两个或多个结合区域的协同作用,使其疗效超过两个或多个单抗联用时的情况。目前,在研的新型抗体药物中,双特异性抗体已占到约20%,成为抗体研究领域的热点。然而,在研的双抗大多(约68%)集中在肿瘤治疗领域,而其中又有50%的双特异性抗体都是针对CD3靶点的,创新性略显不足。这次,来自Genentech的Junichiro Sonoda博士则为我们介绍了一种治疗肥胖症的双特异性抗体,而其研发过程和实验结果也相当离奇。
起初,Sonoda博士了解到,人体荷尔蒙FGF21与肥胖症有关,FGF21激活受体以后,可以加强身体代谢,治疗肥胖症。但是,问题来了,FGF21本身是小分子,在体内半衰期很短,需要剂量很大且长期给药。他想到的解决办法是,筛选激活性抗体(Agonistic Antibody)。如果能找到一个可以与FGF21受体结合的抗体,就能起到与FGF21一致的效果,同时有半衰期长的优势。后来,Sonoda也的确找到了他想要的FGF21受体结合抗体,但是该抗体在体内的作用效果并不是很好,而且副作用严重,这主要是因为FGF21受体广泛表达于体内多个器官,并不仅仅是脂肪细胞。为了解决这个问题,Sonoda老师就设计了双抗,一端结合FGF21受体,另一端结合FGF21受体的共受体(co-receptor)KLB,从而模拟了FGF21促进降低机体血糖血脂、改善胰岛素抵抗、保护胰岛β细胞等多种糖脂代谢调控的功能(如下图所示)。因为KLB只在脂肪细胞中表达,因此,该Anti-FGF21/KLB抗体可以有效的防止FGF21抗体在脂肪细胞外其它器官的作用。后来的动物实验证实了他这一想法,该双抗的确可以加强代谢,提高基础体温,一次注射后效果可持续一个多月。
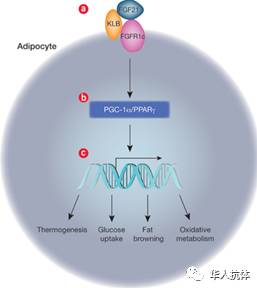
对于Anti-FGF21/KLB治疗肥胖症的作用机理,一个假设是该双抗作用于脂肪细胞上,激活脂肪细胞。但是当体细胞中的FGF21受体被敲除后,依然观察到了治疗效果。而当把神经系统中的FGF21受体敲除后,结果消失了。因此,目前认为,Anti-FGF21/KLB抗体是通过神经系统中表达的FGF21受体与KLB共受体来发挥作用的。
最后,Sonoda也展示了该双抗在人体中的一期临床结果,一次给药,在之后的几周内都观察到了与肥胖症相关的各种指数的降低,同时伴随一些轻微的不良反应。另外一个有意思的现象是(初步结果),通过调查问卷,给药组的人与对照组的人相比,有明显的倾向变得不想喝酒。当被问到,你觉得你想吃肥的东西,或者你想吃咸的东西时,给药组与对照组的回答没有显著差异。但是,当被问到,你想吃甜的东西吗,给药组的人与对照组相比明显对甜的东西失去了兴趣。考虑到这个双抗是通过神经系统起作用,以及可能的对吃甜食欲望的影响,具体机理还需要进一步研究。
另外,此研究为抗体开发提供了一个新的思路:对于知道受体的荷尔蒙或其他半衰期短的活化性物质,可以找到受体的激活性抗体从而提高荷尔蒙的体内半衰期。
众所周知,Bcl-2基因家族成员细胞凋亡过程起着至关重要的作用。BAG3是BCL2重组人BCL2相关永生基因3。意大利的克耶地-佩斯卡拉邓南遮大学的Vincenzo De Laurenzi博士介绍,在细胞和小鼠胰腺癌模型中,已经发现胰腺导管腺癌细胞(pancreaticductal adenocarcinoma,PDAC)会分泌BAG3。同时在胰腺癌患者的血清中也可以检测到BAG3。BAG3结合到单核细胞/巨噬细胞,进而激活巨噬细胞。干扰素诱导蛋白IFITM-2是BAG3 的受体,BAG3和IFITM-2受体结合,诱导p38 磷酸化和Akt的磷酸化。也就是说,BAG3激活巨噬细胞,随后诱导胰腺导管腺癌细胞生长。

















