
“馆长,现在是不是生信分析已经落伍啦!”,“馆长,是不是生信分析不结合实验验证就发不了高分文献了”,近期,有很多小伙伴私信馆长提出相关疑问。不得不说,现在生信领域已经卷到飞起,纯生信分析确实没有之前那么好发文献了,但是馆长想告诉大家,只要想法新颖,不做实验只做生信分析照样也能发高分文献。什么?你不相信,那快和馆长一起往下看吧~
馆长今天要向大家分享这篇发表在《Journal of Translational Medicine》(IF=6.1)的题为“The integration of single-cell and bulk RNA-seq atlas reveals ERS-mediated acinar cell damage in acute pancreatitis”文章。在这篇文献中,研究人员基于内质网应激在腺泡细胞中发挥着重要作用这一发现,通过对多个数据集样本进行生信分析得出内质网应激介导急性胰腺炎腺泡细胞损伤。咱没看错!就是没有实验,仅凭独特的选题结合生信分析就拿到了这样的高分!所以说思路和选题是多么的重要!
PS:单细胞与bulk RNA测序联合分析,是生信文章中最佳怕档,如果对单细胞测序感兴趣的小伙伴可以联系馆长哦!馆长这里不仅有新鲜出炉的生信热点方向,还有一大波的可复现的创新思路呦!
定制生信分析
云服务器租赁
加好友
备注“99”
领取试用

题目:单细胞和bulk RNA-seq图谱的整合揭示ERS介导的急性胰腺炎腺泡细胞损伤
杂志:Journal of Translational Medicine
影响因子:IF=6.1
发表时间:2024年4月
研究背景
急性胰腺炎(AP)是急诊科常见且可能致命的胃肠道疾病,具有较高的发病率和死亡率。目前的治疗方法主要是基于症状的早期液体复苏、营养支持、抗感染和器官功能支持,仍然缺乏特异性治疗。尽管提出多种假说,如胰蛋白酶原过早激活、钙信号异常、内质网应激和自噬受损等,但AP复杂的发病机制仍未阐明。腺泡细胞被认为是AP的起始位点。然而,目前缺少对AP早期胰腺腺泡细胞的病理事件的描述。
研究思路
研究人员首先使用单细胞测序数据集鉴定AP小鼠胰腺中的细胞类型,并描绘腺泡细胞的转录组图谱。接着通过基因集富集分析(GSEA)和单细胞基因集变异分析(GSVA)评估这些途径的活性,时间分析描述腺泡细胞的发育轨迹。此外,还构建了蛋白-蛋白相互作用(PPI)网络,并鉴定枢纽基因。最后,在AP小鼠胰腺样本的另一个独立单细胞测序数据集和AP患者外周血样本的RNA测序数据集中对研究结果进行确证。
研究结果
1.
胰腺组织单细胞转录谱概述
经过初始质量控制和去除双链后,研究人员得到15819个GSE181276细胞的单细胞转录数据(包括野生型小鼠胰腺组织中的5732个细胞和CER诱导的AP组小鼠胰腺组织中的10087个细胞)。根据遗传图谱和典型标记,研究人员将这些细胞分为12个簇,如腺泡细胞、导管细胞、星状细胞、内皮细胞和内分泌细胞并通过UMAP图可视化(图1A)。点图显示每个集群的标记基因(图1B)。结果显示,
AP样本中腺泡细胞的比例低于WT样本
(图1C),这可能与细胞程序性死亡有关。同时,
在AP样品中,星状细胞的比例显著增加,提示这些细胞在AP中的重要作用
。GSEA结果显示,
“泛素蛋白转移酶活性调控”、“伴侣蛋白介导的蛋白折叠”、“mTOR信号通路”和“糖酵解糖异生”等途径被显著激活
(图1D)。
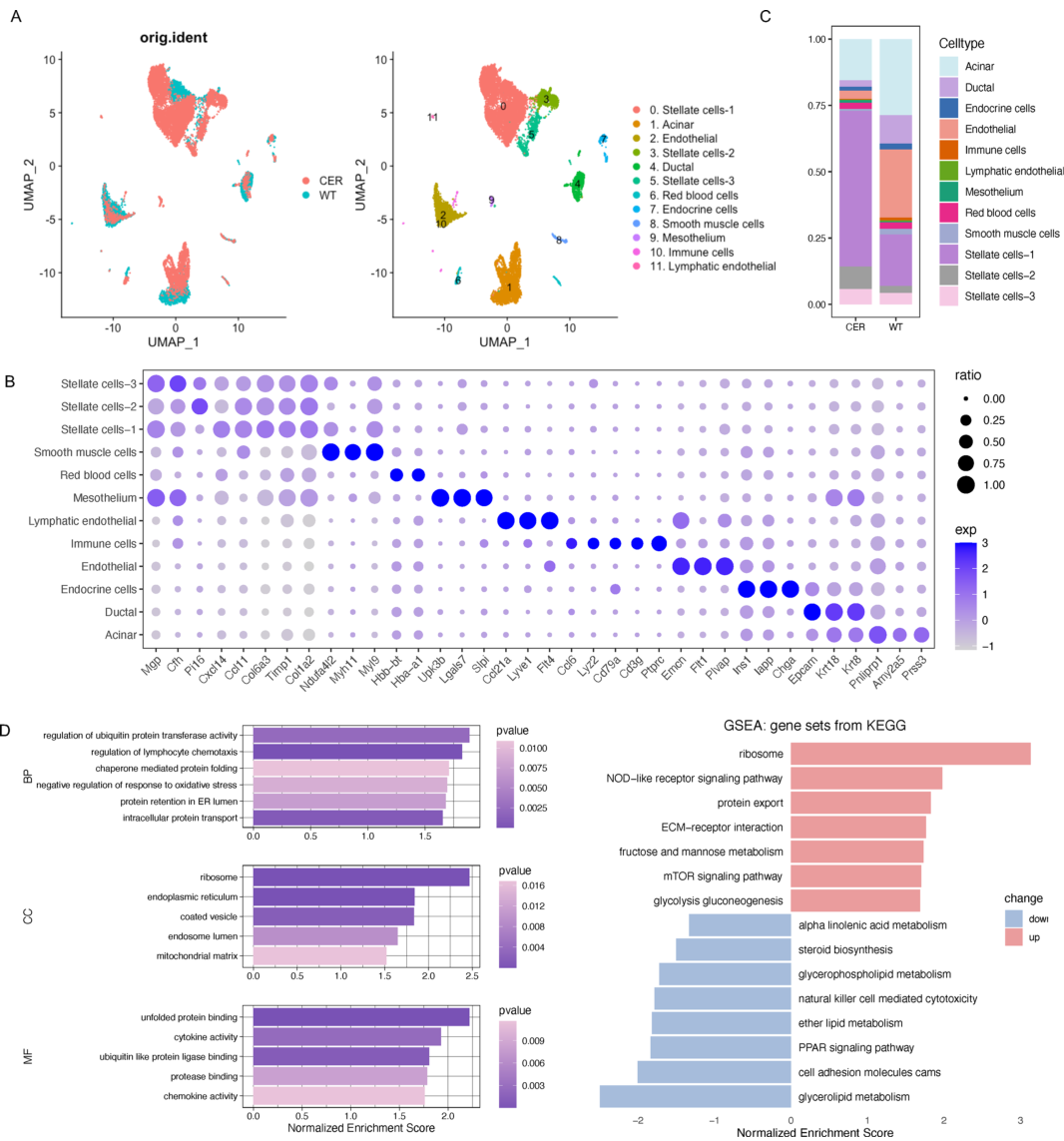
图1 胰腺组织单细胞转录谱概述。
2.scRNA-seq分析揭示腺泡细胞中转录程序的改变
腺泡细胞被认为是AP的发病部位。因此,这些细胞被进一步提取并分成四个亚群(图2A)。
WT样本中的大多数细胞高度表达Pida2,而AP样本中的大多数细胞属于以下三个亚群:高Prss1,高Map1lc3a和低Sox4,高Map1lc3a和高Sox4
(图2A)。散点图显示AP和WT样本之间DEG的相对转录水平,并标记前10个上调和下调的基因(图2B)。GSEA表明,
这些DEG主要富集在溶酶体、自噬、ROS、内吞作用和细胞凋亡等途径中
(图2C)。根据单细胞GSVA评分,
包括凋亡、ROS应答、NOD样受体、抗原等通路的活性,糖酵解糖异生的加工和呈现以及糖酵解糖异生,在高Map1lc3a和低Sox4以及高Map1lc3a和高Sox4集群中显著增加
(图2D)。研究人员以WT腺泡细胞预设为起点,使用monocle3进行时间轨迹分析。实验结果显示
高Map1lc3a和高Sox4集群分布在分化轨迹的后期
(图2E)。编码转录因子的DEGs的时间变化在热图中显示(图2F)。接下来进一步确定结合基序并构建一个表达调控网络(图2G)。
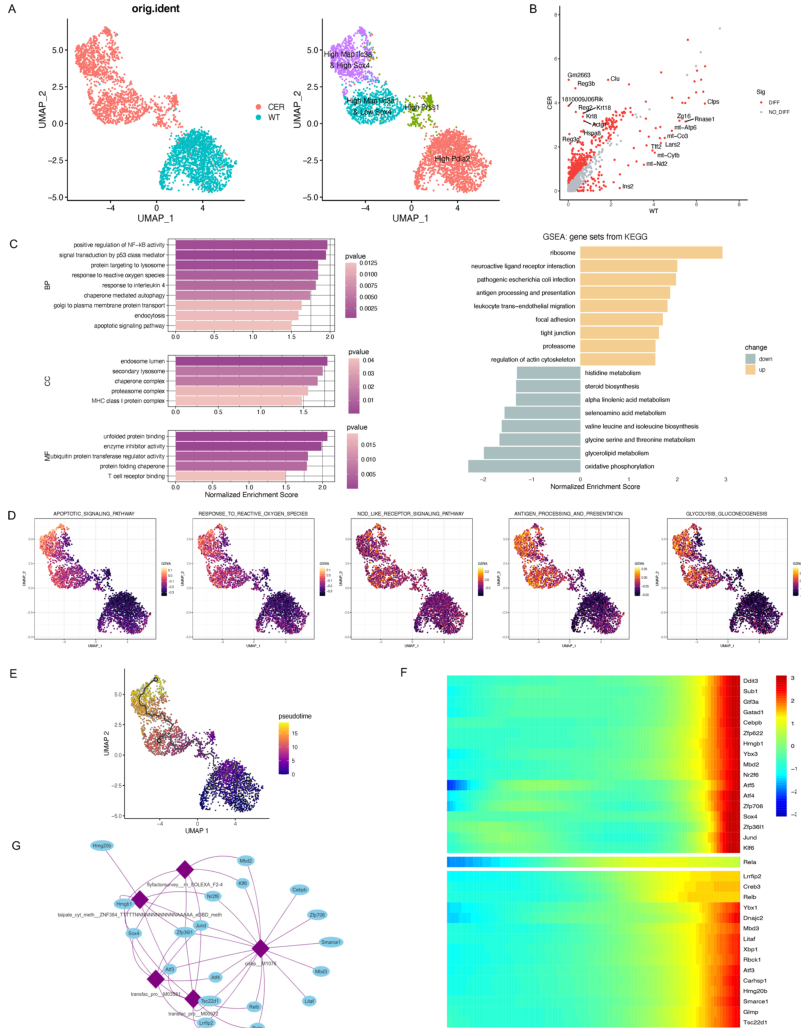
图2 scRNA-seq分析揭示腺泡细胞中转录程序的改变。
3.AP的腺泡到导管化生(ADM)
腺泡细胞在一定程度上具有可塑性,在炎症或损伤后可迅速发生反分化过程。在AP样品中,除胰蛋白酶原Prss1和Prss3外,
大多数编码胰腺消化酶的基因(Ctrc、Cela1、Amy2a5、Pnliprp2、Pla2g1b、Cel、Klk1)和酶原颗粒膜组分(Gp2、Cuzd1、Sycn、Zg16、Dmbt1)的表达均下调
(图3A),与此同时,
Muc1、Cldn3、Cldn7、Epcam、Krt8、Krt18和Krt19等导管标记物的转录显著增加
(图3B)。有趣的是,丝氨酸蛋白酶抑制剂的变化似乎取决于它们的亚细胞位置。
腺泡细胞外分泌的成员(serpin2)表达下调。其他位于细胞质或内质网管腔的基因,如Serpinb1a、Serpinb6a、Serpinb6b和Serpinh1上调
(图3A)。这可能表明
由于胰蛋白酶原在细胞内活化而引起的自消化引起的腺泡损伤
。此外,
参与细胞增殖和分化的再生家族成员也有所增加
(图3C)。
腺泡标记物的缺失和导管标记物的增加揭示AP中腺泡细胞的ADM过程
。
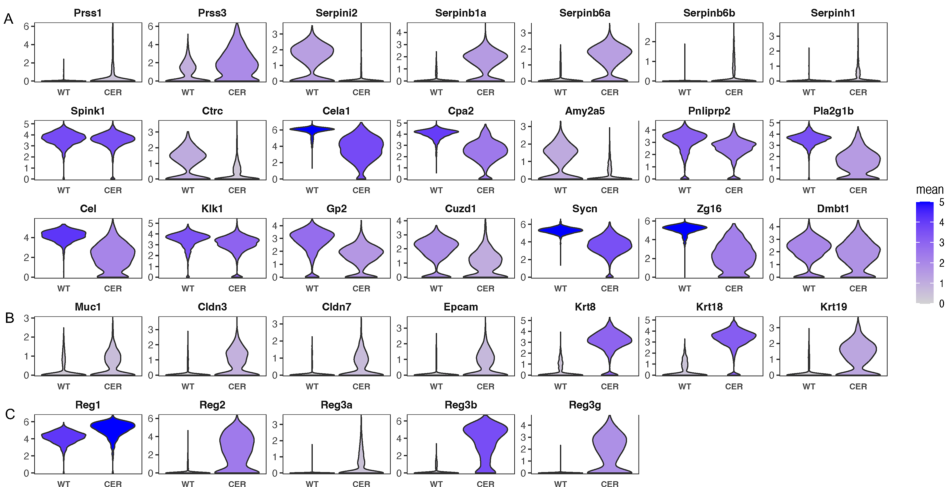
图3 AP的腺泡到导管化生(ADM)。
4.
促进内吞作用和内体循环
外分泌胰腺的关键功能是通过胞吐分泌消化酶。同时,腺泡细胞进行内吞作用和内体循环。研究人员发现,
AP中胞饮作用和囊泡运输标志物(Rab2a、Rab7、Rab11a、Rab25、Clta、Ap1s1、Atp6v1g1、Atp6v0e)的表达增加,多泡体成分(Cd63、Chmp2a、Chmp4b、Mvb12a)和内体循环转运库的表达也增加
(图4A)。
内吞作用所必需的细胞骨架相关基因(Actg1, Actb, Cdc42, Cfl1)的转录增加
(图4B)。此外,
“内吞作用”和“跨上皮运输”途径的活性显著升高,特别是在高Map1lc3a和低Sox4以及高Map1lc3a和高Sox4集群中
(图4C-D)。总之,
AP促进了内吞作用和内体循环
。

图4 促进内吞作用和内体循环。
5.
内质网应激(ERS)显著升高
内质网(ER)是细胞内加工蛋白质和脂质的工厂。
参与二硫键形成,协助蛋白质形成正确空间构象的多个基因(Pdia2, P4hb, Erp27, Ero1lb),在AP中表达明显下调
(图5A)。
这种下调可能导致错误折叠/未折叠蛋白质和ERS的积累
(图5G)。泛素-蛋白酶体系统是降解内质网中错误折叠/未折叠蛋白的一种方法,这个系统涉及蛋白质泛素化和从内质网到细胞质的运输。
相关基因(Bcap31, Derl1, Ufd1, Stub1)转录的增加反映了腺泡细胞中的ERS
(图5B)。研究人员发现,
ERS的关键标记,包括Xbp1、Serp1、Eif2s1、Ddit3、Atf4的表达
(图5C)
和各种分子伴侣
(图5D)
显著上调
。此外,
AP组错误折叠/未折叠蛋白结合途径的GSVA评分更高
(图5E-F)。这些结果表明,
在AP期间,腺泡细胞的ERS增加
。
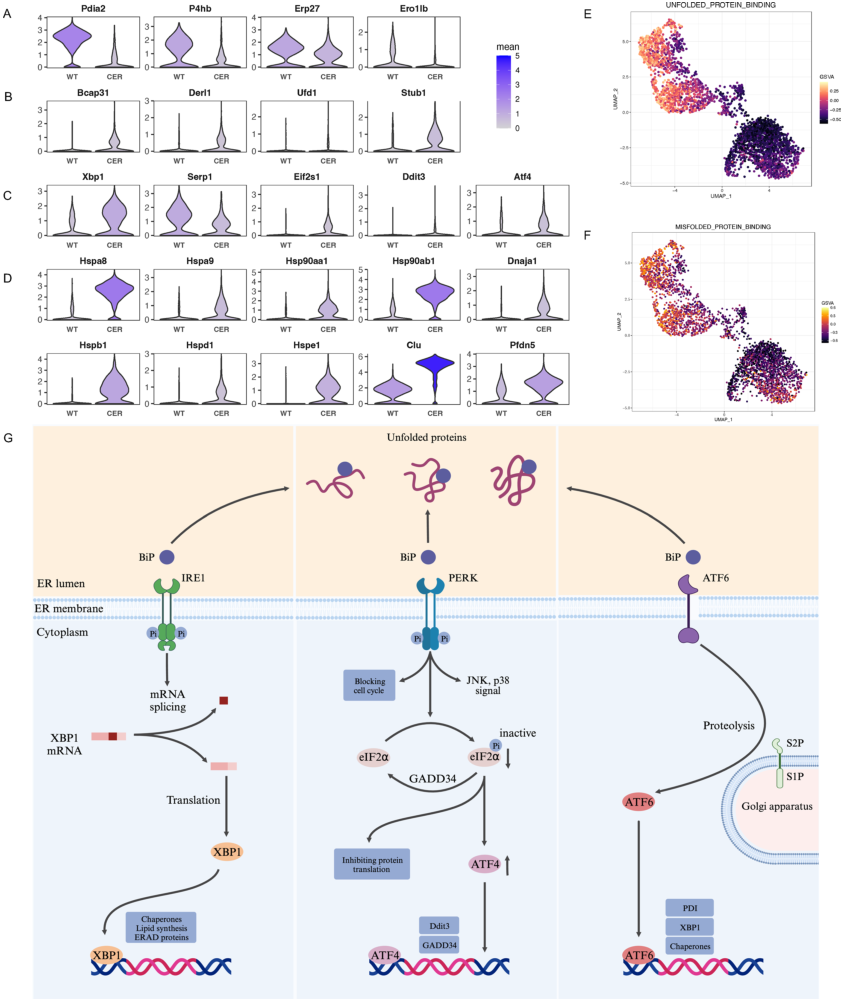
图5 内质网应激显著增加。
6.
泛素-蛋白酶体通路被激活
泛素-蛋白酶体系统可以降解内质网中错误折叠/未折叠的蛋白质;该系统也被称为内质网相关降解I途径(eradi)。单细胞数据显示,
泛素(Ubb,Ubc)和相关酶(Ube2d3, Ube2l3, Stub1, Uchl3)在AP样本的腺泡细胞中升高
(图6A)。同时,
促进蛋白酶体组装和成熟的蛋白酶体亚基和Pomp的表达上调
(图6B)。泛素-蛋白酶体系统也负责内源性抗原加工。经过加工的抗原肽需要在TAP(转运蛋白)的帮助下穿过内质网膜与抗原加工相关),然后结合MHC I类分子。TAP结合蛋白(由Tapbp编码)介导新组装的MHC I类分子与TAP之间的相互作用。研究发现
MHC I类分子和Tapbp的转录显著增加
(图6C)。此外,单细胞GSVA结果(图6D-F)也提示
泛素蛋白酶体途径被激活
。
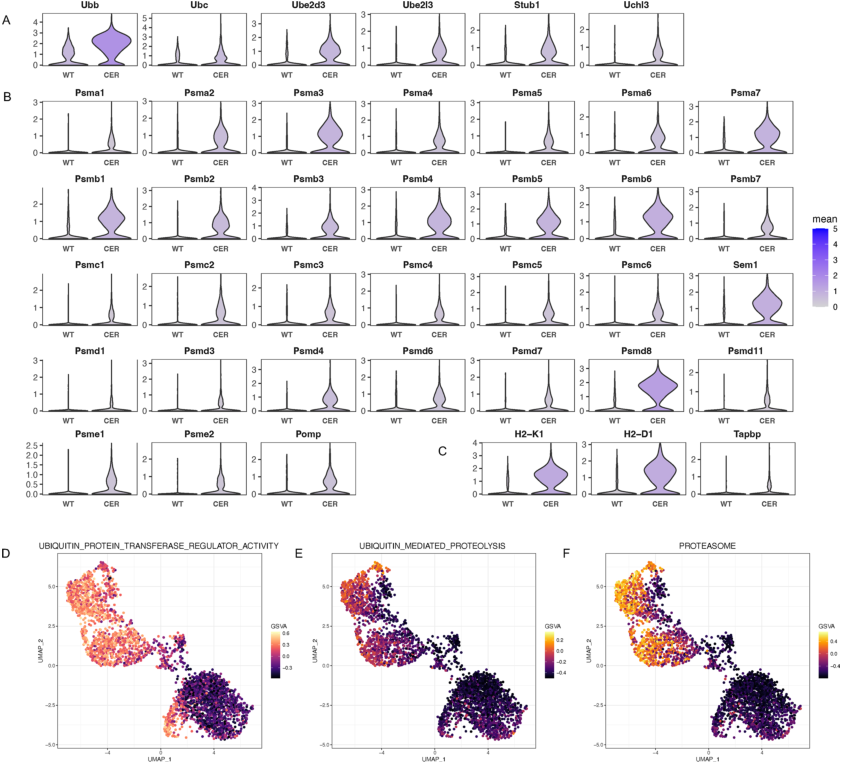
图6 泛素-蛋白酶体通路被激活。
7.
自噬-溶酶体途径相关蛋白转录增加
自噬-溶酶体系统是另一种用于降解内质网中错误折叠/未折叠蛋白的EARD-II途径,在AP过程中也被激活。
AP组自噬相关基因(Sqstm1、Map1lc3a、Map1lc3b、Gabarap、Gabarapl2、Tex264、Stbd1)的转录增加
(图7A)。
溶酶体膜组分
(图7B)
和溶酶体酶
(图7C)
的表达上调
。此外,
基于GSVA检测到自噬和溶酶体相关途径的活性增加
(图7D-G)。这些数据表明
自噬-溶酶体途径可能在AP的发病机制中发挥重要作用
。
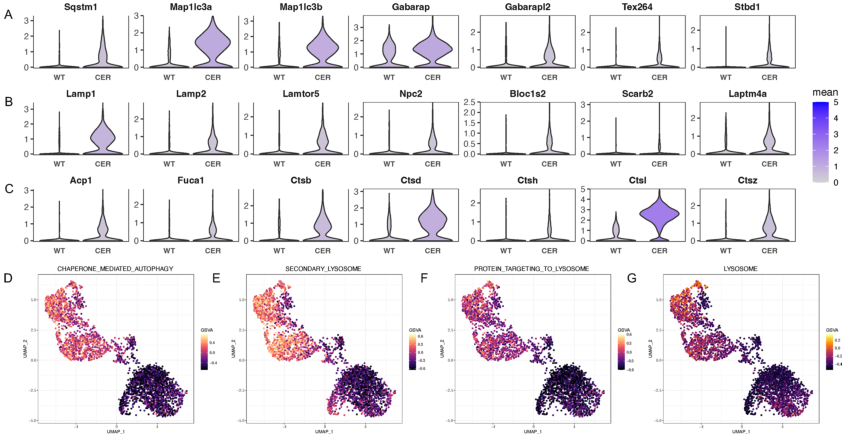
图7 PKCδ在脂肪脑中表达上调,并与高脂血症进展相关。
8.
另一个scRNA-seq和大量RNA-seq数据的集成分析
对来自GSE188819的小鼠胰腺样本的另一个scRNA-seq数据集和来自GSE194331的人外周血样本的大量RNA-seq数据集进行分析。
GSE181276和GSE188819的腺泡细胞的共同基因
(图8A)
主要富集于自噬、溶酶体、蛋白酶体、ERS和内吞作用等途径
(图8B)。此外,通过Cytoscape生成PPI网络,将最大团团中心性(MCC)指数前18位的基因鉴定为枢纽基因,并用红点标记(图8C)。有趣的是,
枢纽基因都编码蛋白酶体的成分
。研究人员还分析来自GSE194331的32名健康志愿者和10名SAP患者的外周血样本。
GSE181276和GSE194331之间的共同DEG
(图8D)
同样在涉及内吞作用、蛋白酶体、溶酶体、自噬和凋亡的途径中富集
(图8E、F)。这些结果与基于GSE181276数据集的发现一致,突出
AP中ERS、泛素-蛋白酶体途径和自噬-溶酶体途径的重要性
。
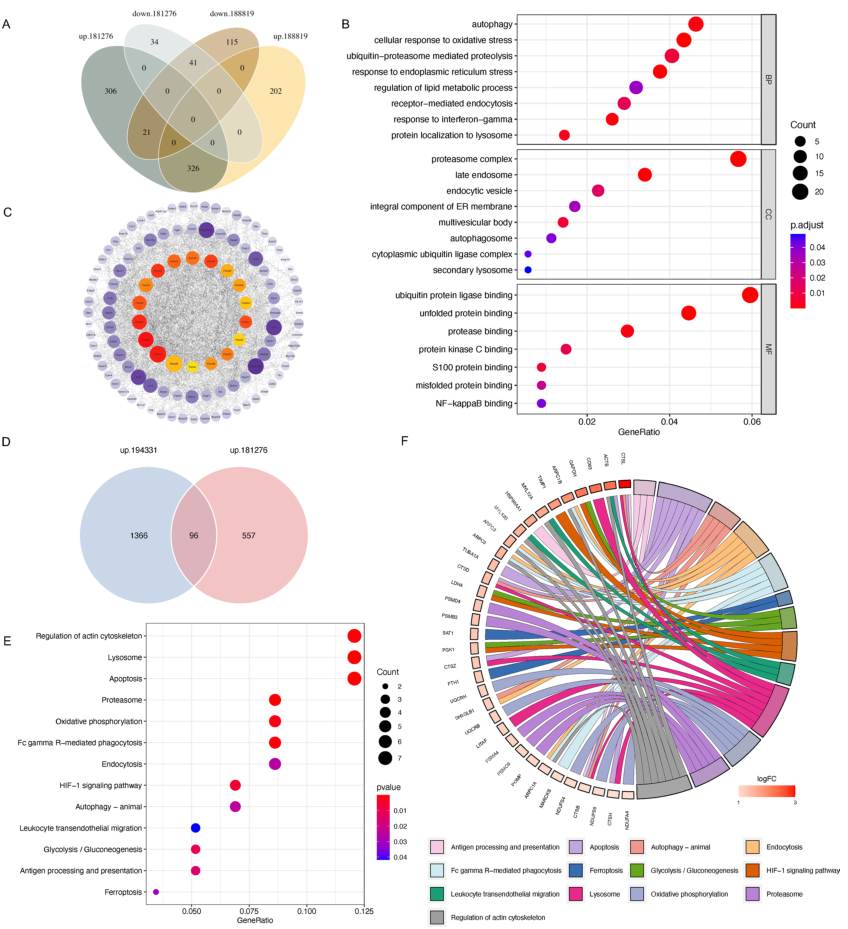
图8 另一个scRNA-seq和大量RNA-seq数据的集成分析



















