共晶在纯溶剂中的溶解度
(S
CC
)
会受到
API
本身溶解度
(S
API
)
的影响,若
S
CC
> S
API
,则共晶溶解过程中可能会有
API
析出,因此溶解平衡时测得的
API
浓度并不能准确反映共晶的溶解度。通过测定共晶共溶点
(eutectic point,
共晶固体、
API
固体及溶液三相平衡
)
时的共溶常数
(eutectic constant, K
eu
)
,利用
K
eu
可以有效确定共晶的溶解度并预测共晶的溶解行为。
达到共溶点的方法是将过量的
API
固体加入共晶形成体的溶液中,平衡
24
小时以上后测定固体的
XRPD
,确认其中同时存在
API
固体(某一种晶型或无定性)与共晶。此时分别测定溶液中
API
与共晶形成体的浓度。
以摩尔比为
1:1
的双组分共晶
AB
为例,在纯溶剂中,达到共溶点时
(
不考虑
A
、
B
组分在溶液中的解离或缔合
)
:
A
solid
↔
A
solution
=> S
API
= [A] (2-1)
AB
solid
↔
A
solution
+ B
solution
=> K
sp
= [A][B] = (S
CC
)
2
(2-2)
定义共溶点时
B
与
A
两种组分的浓度比为共溶常数
(K
eu
)
:
K
eu
= [B]/[A] = K
sp
/(S
API
)
2
= (S
CC
)
2
/(S
API
)
2
= (S
CC
/S
API
)
2
(2-3)
因此共溶常数
K
eu
等于共晶与
API
溶解度之比的平方。
若
K
eu
≤ 1
,即
S
CC
≤ S
API
,则共晶在纯溶剂中达到溶解平衡时不会有
API
固体析出,此时溶液中
API
的浓度即为共晶的溶解度。
若
K
eu
> 1
,即
S
CC
> S
API
,则共晶在纯溶剂中溶解时可能有
API
固体析出,达到溶解平衡时测得的
API
浓度并不是共晶的溶解度,此时需要测定共晶的溶度积常数,以准确反映共晶的溶解度。
共晶溶解度的影响因素
在纯溶剂中,共晶的溶解行为主要受
API
溶解度影响。在非纯溶剂中,共晶的溶解行为会进一步受到其他因素
(
如表面活性剂浓度、
pH
值变化等
)
的影响。
表面活性剂对共晶溶解度的影响
表面活性剂分子中含有亲水和疏水部分,当其浓度大于临界胶束浓度
(critical micelle concentration, CMC)
时,在水溶液中会形成胶束
(micelle)
,胶束浓度会随着表面活性剂浓度的增大而增大。在水中形成的胶束具有疏水内核,对于疏水性药物具有增溶作用。
图
2
显示了疏水性药物
R
及其共晶
RHA
的溶解度随表面活性剂浓度增大的变化曲线(不考虑胶束对于共晶形成体
HA
的增溶作用)。当表面活性剂浓度小于
CMC
时,溶液中不存在胶束,因此对药物
R
及其共晶
RHA
都没有增溶效果,两者的溶解度不随表面活性剂浓度的增大而改变。当表面活性剂浓度大于
CMC
时,溶液中会形成胶束并增大药物
R
及其共晶
RHA
的溶解度,且溶解度随胶束浓度
(
一定范围内对应于表面活性剂浓度
)
的增大分别呈线性和非线性增大。对于两者交点所对应的表面活性剂浓度称为临界稳定浓度
(critical stabilization concentration, CSC)
,此时药物或共晶的溶解度表示为
S*
。
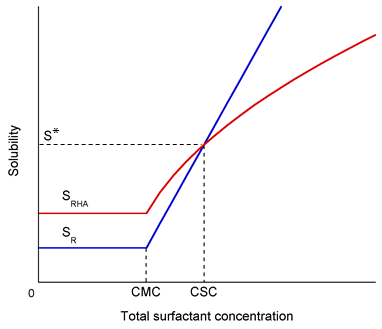
图2 表面活性剂浓度对疏水性药物R及其共晶RHA的溶解度的影响
对于疏水性药物
R
,它在水相及胶束内核的分配平衡可以表示为
(K
s
R
代表分配平衡常数,
[M]
代表胶束浓度,
[R]
aq
和
[R]
m
分别代表处于水相和胶束内核的药物浓度
)
:
R
aq
+ M
↔
R
m
=> K
s
R
= [R]
m
/[R]
aq
[M] (3-1)
此时药物
R
的溶解度可以表示为:
S
R
= [R]
T
= [R]
aq
+ [R]
m
= [R]
aq
+ K
s
R
[R]
aq
[M]= [R]
aq
(1+K
s
R
[M]) (3-2)
因此药物
R
的溶解度随胶束浓度增大而线性增大。
对于双组分共晶
RHA
,其在胶束水溶液中的溶解平衡可表示为
(
不考虑
R
、
HA
组分在溶液中的解离或缔合,不考虑胶束对于
HA
组分的增溶作用
)
:
RHA
solid
↔
R
aq
+ HA
aq
=> K
sp
= [R]
aq
[HA]
aq
(3-3)
R
aq
+ M
↔
R
m
=> K
s
R
= [R]
m
/[R]
aq
[M] (3-4)
此时共晶
RHA
的溶解度可以表示为:
S
RHA
= [R]
T
= [R]
aq
+ [R]
m
= [R]
aq
+ K
s
R
[R]
aq
[M]= [R]
aq
(1+K
s
R
[M]) (3-5)
由于
[R]
aq
= K
sp
/[HA]
aq
且
S
RHA
= [HA]
aq
,代入上式可得:
S
RHA
= (K
sp
/S
RHA
)(1+K
s
R
[M]) => S
RHA
= [K
sp
(1+K
s
R
[M])]
1/2
(3-6)
因此共晶
RHA
的溶解度随胶束浓度增大而非线性增大。
根据公式
3-2
和
3-6
,还可进一步计算两条溶解度曲线的交点
S*
。由于
S*= S
R
= S
RHA
,代入公式
3-2
和
3-6
后可以得出:
S*= [R]
aq
(1+K
s
R
[M]) = [K
sp
(1+K
s
R
[M])]
1/2
(3-7)
将公式
3-7
变换后得到:
1+K
s
R
[M]= S*/[R]
aq
= (S*)
2
/K
sp
(3-8)
进一步可以算得:
S*= K
sp
/[R]
aq
= (S
RHA,aq
)
2
/S
R,aq
(3-9)
根据公式
3-9
,交点处的溶解度
S*
只与共晶
RHA
和药物
R
在水中的溶解度相关,而与表面活性剂的种类和浓度无关。
溶液pH值对共晶溶解度的影响
对于由弱碱性药物和弱酸性共晶形成体形成的共晶,它在水溶液中可能会发生离子化,因此其溶解行为会受到
pH
值的显著影响。图
3
显示了弱碱性药物奈韦拉平
(NVP)
及其与马来酸
(MLE)
、糖精
(SAC)
和水杨酸
(SLC)
所形成的共晶的溶解度随溶液
pH
值的变化曲线。当溶液
pH
值从
1
逐渐增大时,
NVP
的溶解度会逐渐降低并趋于不变;
NVP
共晶的溶解度则先降低后升高,呈现出
U
型的溶解度曲线。
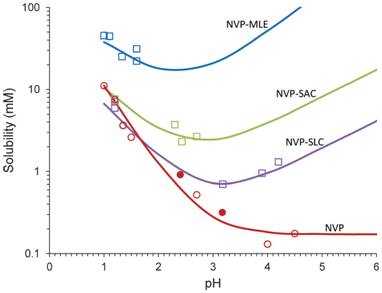
图3 溶液pH值对奈韦拉平及其共晶的溶解度的影响
对于弱碱性
API
,当溶液
pH
值较小时,大部分
API
发生离子化,对应的溶解度较高;随着溶液
pH
值增大,
API
离子化的程度降低,导致溶解度逐渐下降;当溶液
pH
值增大至一定程度后
(pH> pKa,
API
+ 2)
,
API
离子化的程度很低,因此其溶解度趋于不变。
对于弱碱性
API
和弱酸性共晶形成体形成的共晶,当溶液
pH
值较小时,大部分
API
发生离子化,对应的共晶溶解度较高;当溶液
pH
值较大时,大部分共晶形成体发生离子化,对应的共晶溶解度也较高;当溶液
pH
值介于
API
与共晶形成体的
pKa
之间时,
API
与共晶形成体的离子化程度均较低,对应的共晶溶解度最小,因此呈现出
U
型的溶解度曲线。
结论
综上所述,药物共晶的溶解行为与
API
的溶解度相关,也与溶液中的其他影响因素
(
如表面活性剂浓度、
pH
值等
)
相关,溶解行为中的平衡溶解度由热力学平衡决定
(
固液平衡
+
溶液平衡
)
。正确和准确地理解共晶的溶解行为及其影响因素,对于解释和预测共晶的形成条件以及在不同条件下的溶解度变化趋势和转化关系具有重要的意义。
参考文献
-
S. J. Nehm, B.Rodriguez-Spong and N. Rodriguez-Hornedo. Crystal Growth & Design, 2006, 6, 592-600.
-
D. J. Good and N.Rodriguez-Hornedo. Crystal Growth &Design, 2010, 10, 1028-1032.
-
N. Huang and N.Rodriguez-Hornedo. Crystal Growth &Design, 2010, 10, 2050-2053.
-
N. Huang and N.Rodriguez-Hornedo. J. Pharm. Sci., 2011,100, 5219-5234.
-
G. Kuminek, N.Rodriguez-Hornedo, S. Siedler, H. V. A. Rocha, S. L. Cuffinibd and S. G.Cardoso. Chem. Commun., 2016, 52,5832-5835.


共晶专家
-
以超分子化学与晶体工程概念为前提,制定了以分子机理方法为基础的研究计划
-
目前任职于FDA药品科学咨询委员会
-
《Crystal Growth and Design 》《 Molecular Pharmaceutics 》《 Journal of Pharmaceutical Sciences 》杂志编辑委员会成员
-
2005年,因在the Journal of Pharmaceutical Sciences发表了有重大价值的文章而获得艾伯特奖
现场视频 |
Nair Rodriguez-Hornedo - How not to be wrong about cocrystals: properties and insights that really matter






