主要观点总结
本文介绍了黄胜雄课题组对膜荚黄芪的基因组和转录组进行分析,挖掘出负责AG IV生物合成的基因簇,并解析了AG IV的生物合成通路。研究发现了黄芪三萜生物合成基因簇是目前自然界报道的最大天然产物基因簇,为后续的中药新品种选育及黄芪三萜创新药物研发奠定了坚实的药源基础。
关键观点总结
关键观点1: 研究背景
中药黄芪具有2000多年的用药历史,其主要活性成分黄芪甲苷(AG IV)具有多种药理活性。尽管之前有多篇文章鉴定了负责AG IV生物合成的部分酶,但其合成通路一直尚未被完整解析。
关键观点2: 研究成果
黄胜雄课题组通过分析膜荚黄芪的基因组和转录组,挖掘出负责AG IV生物合成的基因簇,包括多个修饰酶和合成酶。通过异源体内体外功能验证,确定了这些基因的具体功能。此外,该研究还实现了AG IV的异源合成,并在烟草叶片中检测到了AG IV的产生。
关键观点3: 研究亮点
1. 完整解析了AG IV的生物合成通路,这是首次在自然界中报道的完整天然产物基因簇。2. 研究发现的基因簇中包括多个修饰酶和合成酶,其中AmOGD1的参与说明植物不仅利用CYP450,还利用2-OGD家族的成员修饰三萜骨架。3. 在烟草叶片中实现了AG IV的异源合成,为后续的中成药新品种选育及黄芪三萜创新药物研发提供了药源基础。
关键观点4: 研究影响
这项研究对中药黄芪的活性成分AG IV的生物合成通路进行了全面解析,为后续的中药研究和药物研发提供了重要的参考和依据。
正文

中药黄芪是蒙古黄芪(
Astragalus membranaceus
var.
mongholicus
)或膜荚黄芪(
Astragalus membranaceus
)干燥的根,始载于《神农本草经》,距今已经有
2000
多年的用药历史。其中的主要活性成分黄芪三萜,—黄芪甲苷(
Astragaloside IV
,
AG IV
)具有多种药理活性,包括免疫调节、抗病毒等。前期虽然有多篇文章鉴定了黄芪中负责
AG IV
生物合成的糖基转移酶和
2
,
3-
氧化角鲨烯环化酶(
J. Adv. Res.
,
2022
,
43
,
247–257
;
Acta Pharm. Sin. B
,
2023
,
13
,
271–283
;
Angew. Chem. Int. Ed.
,
2021
,
61
,
e202113587
),但是关于其合成通路一直尚未被完整解析(
图1
)。
2024
年
10
月
21
日,
Nature Plants
在线发表了中国科学院昆明植物研究所
黄胜雄
课题组题为“
Total biosynthesis of the medicinal triterpenoid saponin astragalosides
”的研究论文。该研究通过分析膜荚黄芪的基因组和转录组挖掘到负责
AG IV
生物合成的基因簇,完整解析了
AG IV
的生物合成通路。



图
1. AG IV
的结构及其在膜荚黄芪中的推测的生物合成通路;
a.
黄芪全株及根部切片;
b. AG IV
的结构与其推测的生物合成通路。
该团队构建了膜荚黄芪的染色体水平基因组。膜荚黄芪基因组有
9
条染色体,组装大小为
1.44 Gb
,
contig N50 2.82 Mb
,
BUSCO
完整度为
92.44%
。除此之外,
2023
年中国农业大学董学会教授和孙连军教授(
Plant Communications
,
2022
,
4
,
100469
)通过测定蒙古黄芪(膜荚黄芪的变种)基因组推测蒙古黄芪
7
号染色体上可能存在黄芪三萜合成的基因簇(
BGC
),包括一个环阿屯醇合成酶,一个细胞色素氧化酶(
cytochromeP450
,
CYP450
)和一个尿苷二磷酸糖基转移酶(
uridine diphosphate glycos-yltransferase
,
UGT
)。同样,黄胜雄团队通过分析膜荚黄芪基因组,发现环阿屯醇合成酶(
AmOSC3
)附近也存在一个
CYP450
和一个
UGT
,但是通过异源体内体外功能验证,发现基因组上
AmOSC3
附近的
CYP450
和
UGT
不参与
AG IV
的生物合成。因此初步认为负责
AG IV
生物合成的基因在膜荚黄芪中不以簇的形式呈现。进一步对膜荚黄芪不同组织的转录组数据结合系统发育树分析,挖掘到催化环阿屯醇
C-16
羟化的氧化酶(
AmCYP88D25
)和
C-3-OH
糖基化的糖基转移酶(
AmGT11
和
AmGT72
)(
图2
)。并通过基因的组织特异性表达和酶动力学初步推测
AmGT11
更有可能参与
AG IV
的生物合成。
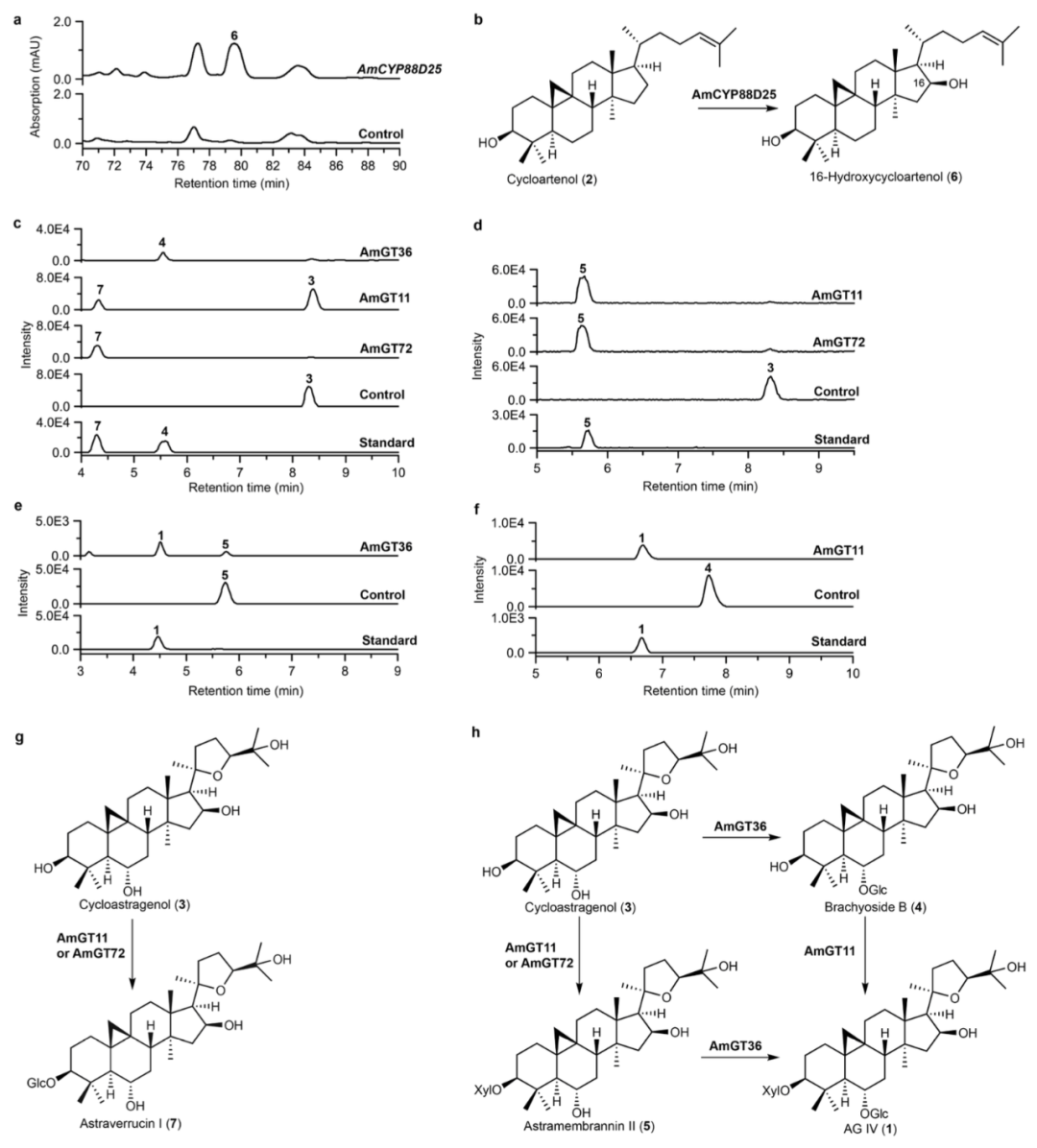
图
2. AmCYP88D25
、
AmGT11
、
AmGT72
和
AmGT36
的功能验证
通过分析膜荚黄芪的基因组,该团队发现
AmCYP88D25
和
AmGT11
都位于
1
号染色体上,且这个区域(约
4Mb
)的范围内包含另外
2
个
CYP450s
(
AmCYP88D7
和
AmCYP71D756
)和两个糖基转移酶(
AmGT36
和
AmGT37
)(
图3
)。这个潜在的
BGC
在蒙古黄芪中也存在,更加印证这些基因可能参与黄芪属植物
AG IV
的生物合成。通过体外酶促反应证实
AmGT36
负责
C-6-OH
的葡萄糖糖基化(
图2
)。异源体内证实导入
AmCYP88D25
和
AmCYP88D7
的酵母菌株生产化合物
6
,
16-dihydroxycycloartenol
,从而说明
AmCYP88D7
负责
AG IV
生物合成过程中的
C-16
羟化(
图
3
和图
4
)。同样,导入
AmCYP88D25
和
AmCYP71D756
的酵母菌株经验证生产1
6
,
24
,
25-trihydroxycycloartenol
,由于酵母中存在环氧水解酶,因此猜测
AmCYP71D756
可能是催化1
6-hydroxycycloartenol
的
C-24
,
25
环氧化(
图
3
和图
4
)。通过
AmCYP71D756
的酵母微粒体体外实验证实这一猜想。但是同时导入
AmCYP88D25
、
AmCYP88D7
和
AmCYP71D756
的酵母菌株的发酵产物中虽然化合物1
6
,
16-dihydroxycycloartenol
和1
6
,
24
,
25-trihydroxylation
的峰面积降低,但是没有新的化合物出现,猜测可能是酵母内源的酶可能催化相应的产物,从而没有检测到新的化合物峰。因此,该团队进一步在烟草中验证这
3
个基因的功能,经过检测发现导入这
3
个
CYP450s
后,烟草中产生了化合物
cyclocantogenin
,—
24
,
25-epoxy-6
,
16-dihydroxycycloartenol
的水解产物。为了进一步证实
AmCYP88D7
和
AmCYP71D756
的活性,该团队通过体外酵母微粒体实验,分别以
24
,
25-epoxy-16-hydroxycycloartenol
和
6
,
16-dihydroxycycloartenol
为底物,经过检测证实
AmCYP88D7
和
AmCYP71D756
都能催化
24
,
25-epoxy-6
,
16-dihydroxycycloartenol
的产生。这些结果表明,
AmCYP88D7
和
AmCYP71D756
发挥协同作用,将化合物
16-hydroxycycloartenol
氧化为
24
,
25-epoxy-6
,
16-dihydroxycycloartenol
(
图
3
和图
4
)。
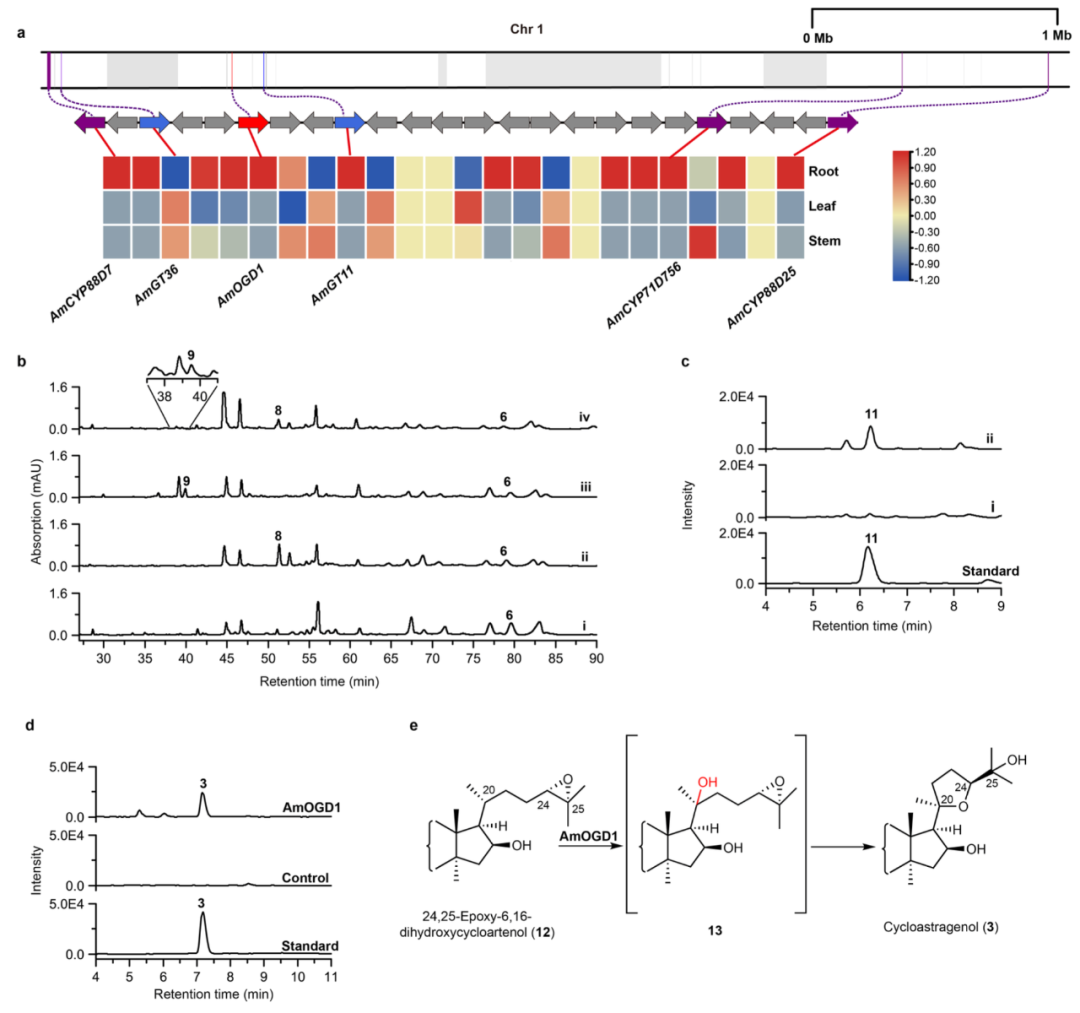
图
3.
位于膜荚黄芪
1
号染色体的基因簇以及
AmCYP88D7
、
AmCYP71D756
以及
AmOGD1
的功能验证;
a. 1
号染色体上负责
AG IV
生物合成的基因簇;
b.
酵母体内验证
AmCYP88D7
和
AmCYP71D756
功能;
c.
烟草瞬时表达验证
AmCYP88D25
、
AmCYP88D7
和
AmCYP71D756
功能;
d.
体外验证
AmOGD1
功能;
e. AmOGD1
可能的催化机制。
虽然通过体内体外功能验证了这个
BGC
上
5
个基因的功能,但是仍未完整解析
AG IV
的生物合成通路。该团队继续分析这个
BGC
中的其他类型的基因,发现该
BGC
中存在另外一类氧化酶—
α
-
酮戊二酸依赖的双加氧酶(
OGD
)。对
AmOGD1
体外功能验证,证实其负责催化
AG IV
生物合成过程中
20
,
24-
四氢呋喃(
THF
)环的形成(
图
3
和图
4
)。随后,该团队选择了原人参三醇作为模型,推测
AmOGD1
可能催化
24
,
25-epoxy-6
,
16-dihydroxycycloartenol
的
C-20
的羟化,从而形成黄芪皂苷中的
20
,
24-THF
环。除此之外,该研究团队通过
RNA
干扰(
RNA interference
,
RNAi
)技术进一步在黄芪毛状根中证实了这
6
个基因参与膜荚黄芪中
AG IV
的生物合成。该团队还在烟草中进一步验证
AmGT11
和
AmGT36
的催化先后顺序,但是根据实验结果证实
AmGT11
和
AmGT36
存在底物宽泛性(
图
4
),没有严格的底物特异性。该团队在挖掘到完整负责
AG IV
生物合成的基因后(
图
4
),将其通路重构在烟草中。正如预期的那样,在烟草中表达
AmOSC3
、
AtCPR1
以及本研究中鉴定的
6
个修饰酶,最终该团队在烟草叶片中检测到了
AG IV
的产生(产量为
0.293 mg/g
;干重),并通过过表达上游三萜前体合成通路基因
NbtHMGR
成功地将烟草叶片中
AG IV
的产量提高至
2.224 mg/g
(干重。)
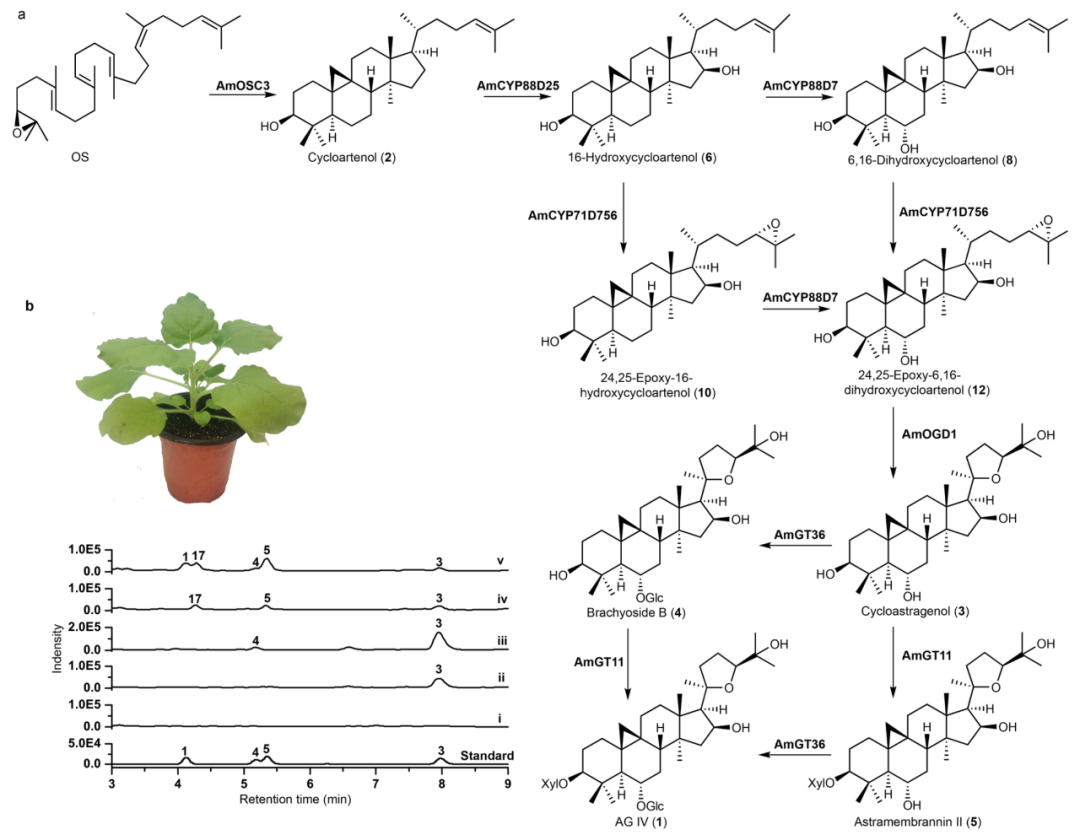
图
4.
在烟草中进行瞬时表达重构
AG IV
的生物合成
黄胜雄课题组通过对膜荚黄芪基因组和转录组进行分析,挖掘出膜荚黄芪中
AG IV
生物合成的
BGC
(
图
3
和图
4
),并通过在烟草叶片中瞬时表达,实现了
AG IV
的异源合成
。
该研究发现的黄芪三萜生物合成基因簇是目前自然界报道的最大天然产物基因簇。与之前报道的三萜类基因簇不同,这一基因簇缺少骨架合成酶,为其他萜类天然药物的生物合成解析提供了重要参考。除此之外,基因簇中
AmOGD1
参与
AG IV
的生物合成说明了植物似乎不仅利用
CYP450
,还利用
2-OGD
家族的成员修饰三萜骨架。同时,这些基因的挖掘和全合成途径的解析为后续的中药新品种选育及黄芪三萜创新药物研发奠定了坚实的药源基础。
黄胜雄课题组的
徐冰艳
博士研究生、
黄建萍
研究员、
彭国情
和
曹文颖
硕士研究生为本论文的共同第一作者,
黄胜雄
研究员为通讯作者,成都中医药大学
陈士林
院士和鲁南制药基团合作者为本研究提供了大力支持。上述工作得到了国家合成生物学重点研发计划、国家自然科学基金、云南省“兴滇英才支持计划”等项目资助。
感谢黄胜雄教授课题组对本号的支持,感谢该课题组提供本文稿件支持!

合成生物学/天然产物生物合成
姊妹号“生物合成文献速递”




