
概要:
长期以来,癌症一直被按照其开始生长的组织而定义—— 肺、结肠和乳房,等等。但是,2017年5月23日FDA加速批准全球首款不区分肿瘤组织的抗癌疗法,表明抗癌药物的测试和使用发生了划时代的巨大的变化。该广谱适应症的批准针对的是拥有特定的遗传特征的所有人,无论肿瘤细胞是在哪个组织中被发现的。 请继续阅读,了解科学技术与药物开发如何协同作用实现“个性化医学”的承诺。
Credit: Yang H. Ku/C&EN/Shutterstock
2013年初,Adrienne被诊断患有壶腹癌,这是一种罕见的胃肠道肿瘤。对于Adrienne来说,这不是一个始料不及的晴天霹雳的噩耗。近十年来,她已经认识到她自身的基因对她不利。庆幸的是,她不知道她的基因也帮助指出治愈的方向和方法。
Adrienne患有Lynch综合征,这是由错配修复(mismatch repair,MMR)基因缺陷引起的遗传性疾病,错配修复基因对DNA复制过程中负责发现和修复错误的蛋白质进行编码。Lynch综合征患者发生结肠癌的风险高达70%。具有这种缺陷的妇女在早期患有子宫内膜癌的几率也很高。
Adrienne首次听说这种综合征是在2004年年底,那时她的姐姐被诊断为结肠癌、卵巢癌和子宫内膜癌,这些是与Lynch综合征有关的三联症。事实证明,Adrienne、她的姐姐和她们的母亲都是有缺陷的MMR基因的携带者。
一年的时间里接受了两种类型的化疗,Adrienne对化疗开始时有响应,后来不再响应。这时,她的肿瘤学家建议她考虑参加正在Johns Hopkins Kimmel癌症中心进行的一项创新性新药试验。那里的临床医生正在测试一种被称为Keytruda的药物,参加的都是和她一样患有这种基因缺陷的癌症患者。
由美国默沙东公司开发的Keytruda是一种被称为检查点抑制剂的新型癌症免疫治疗药物,可帮助免疫系统识别和攻击癌细胞。
尽管在治疗皮肤癌和肺癌方面取得了显著的成功,但是检查点抑制剂并没有在结肠癌方面产生相同的效果。关于为什么只有少数结肠癌患者受益,霍普金斯大学团队有一个理论:像Adrienne一样,这些患者的MMR基因中存在缺陷。研究人员说服默沙东公司给他们提供药物,并找到一个非营利组织资助,开启了一项临床研究来测试他们的假设。
每两周一次,Adrienne从她位于纽约州Larchmont的家乘坐火车到巴尔的摩,在那里她被输注Keytruda。
不到三个月的时间,她进行了一次活检以评估药物是否让其自身的免疫系统加足马力去攻击癌细胞。活检完成后,外科医生走了进来,带给Adrienne一条令人难以置信的消息。Adrienne回忆道,医生看着她,瞪大了眼睛说:“您知道吗,如果没有人告诉我您患有壶腹癌,我根本不会知道,因为什么也检测不到。”
Adrienne不是唯一一个能够体验到医生的这种戏剧性反应的病人。临床医生后来报道说,免疫疗法适用于各种以MMR缺陷为特征的癌症或被称为高微卫星不稳定性的相关病症。
在对149例对常规癌症药物不响应的患者进行的临床试验中,大约40%的结肠癌患者和48%的其它类型癌症患者的肿瘤都缩小了。

Luis Alberto Diaz, Jr., MD
“结果令人难以置信!” Luis Diaz医学博士说,他当初在霍普金斯时设想了这个临床试验,现在他是Memorial Sloan Kettering Cancer Center的实体肿瘤部门负责人。 “事情永远不会如此发生。我的意思是80%的想法都以失败告终。”
2017年5月23日,基于Keytruda强有力的临床试验数据,美国食品药品监督管理局(FDA)首次批准了对具有特定分子特征的患者的广谱癌症疗法。这个“不分组织”的批准可能是目前正在重新定义如何治疗癌症患者的最公开的例子。

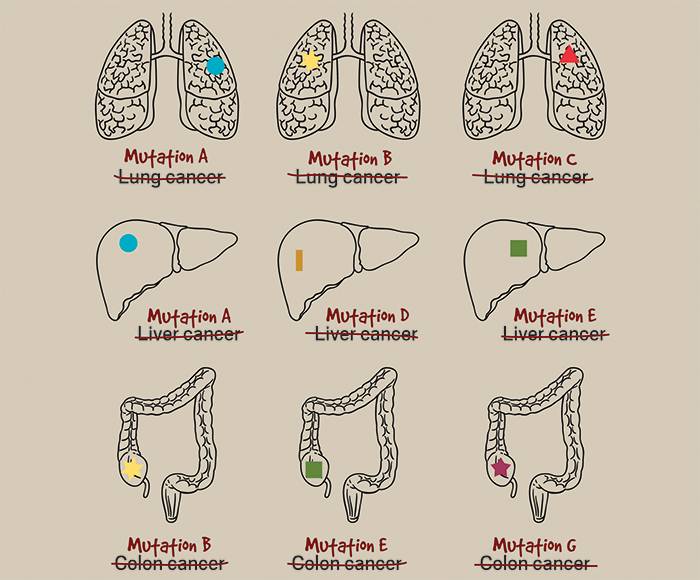
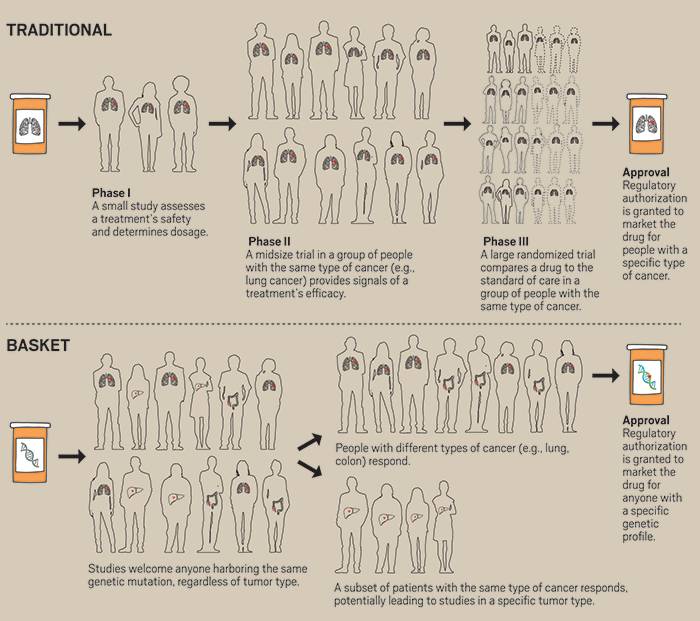
癌症治疗一直围绕着肿瘤产生的器官——肺、乳房、结肠,等等。即使在这个“个性化医学”广为人知的时代,靶向遗传畸变的药物仍然被批准用于特定器官。此外,新药研发公司仍然需要进行单独的试验以证明药物在每个器官中的疗效。
现在,更便宜和迅捷的基因测序不断更新迭代,借助这些新技术,研究人员正在对癌症进行与以往完全不同的思考和探索。高新技术在手,他们可以更容易地对具有特定分子结构的患者进行靶向治疗或癌症免疫治疗,从而使患者获益。
越来越多的早期和中期临床试验,被称为“篮子研究”,正在超越原发器官,适合具有特定遗传特征的任何人参加。现在FDA似乎接受以遗传学为重点的开发路径,专家们预计肿瘤领域将从对肿瘤位置的关注发生重大转移。
不分组织这一方法的首要目标是使癌症药物开发更有效率。超越肿瘤位置的研究为加快Adrienne等患者的治疗方案提供希望,否则她们可能不知道她们会从药物中获益。
重新定义
美国加利福尼亚大学圣地亚哥摩尔斯癌症研究中心的个性化癌症治疗中心主任Razelle Kurzrock医学博士说:FDA对默沙东药物的不分组织的批准是医药研发历史上的“分水岭事件”。

Razelle Kurzrock,MD
Kurzrock博士解释说,肿瘤学多年来一直用显微镜观察来界定癌症细胞,导致今天以器官为中心的分类。现在,不再只看细胞的表面,肿瘤学家更多的是在细胞内部找出究竟什么使它变得异常。
“科学地讲,这是非常有道理的,” Kurzrock博士说。“你正击中驱动癌症的根本改变,而不是癌症的表面外观。” 不再是治标,而要治本。
尽管如此,对于原发器官的关注仍然存在,即使当医药研发公司们转而设计药物来阻止在许多肿瘤类型中发现的致癌遗传突变。默沙东公司全球临床开发高级副总裁Roy Baynes医学博士、博士表示:“精准医学的理念实际上正在发挥作用,但到目前为止,它主要是局限于肿瘤领域。真正的希望是这种基于机制的方法能够更广泛地转化。”
但挑战比比皆是。虽然肿瘤学家盛赞Keytruda的不区分肿瘤来源的获批,他们也警告不要将遗传学作为灵丹妙药过度渲染。

Igor Puzanov, MD, MSCI, FACP
Roswell Park癌症研究所早期临床试验主任Igor Puzanov医学博士评论道:“这绝对是向前迈进的一步,但不等于所有癌症的确定性的解决方案。”
Puzanov博士等癌症研究人员看来,BRAF基因是不区分肿瘤来源的药物开发的一个美中不足的例子。BRAF突变在癌症中普遍存在,最常见于黑素瘤、结肠癌和甲状腺癌。当BRAF抑制剂维莫拉本(vemurafenib)被发现时,研究人员希望该分子能够杀死这三种癌症患者中的任何一种癌细胞。
结果呢,没有!特异性阻断BRAF V600E突变的维莫拉本在皮肤癌方面表现非常出色,罗氏在2011年获得了该药物治疗黑色素瘤的批准,但几乎没有任何结肠癌患者对此药有响应。研究人员花了好几年的时间来理解这个差异。即使他们提出了合理的理论,BRAF抑制剂无法同时治疗两种肿瘤也都阻碍了这一领域向前推进。
UCSD的Kurzrock博士认为,基于BRAF“故事”而放弃不分组织癌症疗法是短视的。没有癌症药物是万能的。即使是维莫拉本,也只对BRAF突变黑素瘤患者中的一半有效果。针对另一半患者,还需要阻断其它的突变。
结肠癌没有什么不同的,Kurzrock博士说,关键在于找出所涉及的其它途径,从而可以尝试适当的组合疗法。例如,在BRAF抑制剂中添加EGFR抑制剂,可引起结肠癌患者的响应。
改变医疗机构对癌症的看法意味着克服持续数十年的心态。
“我们生活在一个研究性世界,我们对每个肿瘤进行600个基因测序,如果您患有乳腺癌,不是肺癌,您将接受不同的诊断,” 诺华生物医学研究所下一代诊断主管Wendy Winckler博士说。比如,乳腺癌的患者通常不测试EGFR突变,这个突变通常在肺癌中被发现。

Wendy Winckler, PhD
此外,对于药物公司来说,获得针对黑色素瘤患者的批准更容易,30-45%的患者具有BRAF V600E突变,相比之下,非小细胞肺癌患者中只有1-2%的人携带这种突变。为了在肺癌中进行临床试验,需要筛选100位患者才能找到一名可以入组的患者。“这在以前没有发生过,” Winckler说。
欢迎欣赏同期发布的视频!
视频 | 诺华公司瞄准癌症基因组学,目标精准医学!
变革临床试验
临床医生希望通过改变一些临床试验的方式来使药物开发更高效。
Credit: Yang H. Ku/C&EN/Shutterstock
广泛筛选的可及性正在改变这种范式。Loxo Oncology首席执行官Joshua Bilenker博士说:“从历史上看,世界上进行这种药物开发的速度有限,主要是由于诊断。” 他指出,就在五年前,可以测试癌症分子驱动因子的下一代基因测序仪甚至不存在。

Joshua Bilenker, PhD
“广泛的测试就是如何找到你甚至根本不知道你在寻找的东西,” Bilenker博士说。 这正是Loxo公司最先进的在研药物候拉罗替尼(larotrectinib)靶向罕见突变的情况。
Loxo公司正在开发拉罗替尼,作为任何携带TRK基因融合的癌症患者的治疗方法,TRK基因融合在染色体分裂后在错误的地方重新结合时发生。Loxo公司估计,每年新诊断为晚期癌症的患者中的1500至5,000名患者携带TRK基因融合,意味着遗传性错误出现在所有癌症的几率不到1%。

抑制基因融合的拉罗替尼于上个月在芝加哥举行的美国临床肿瘤学会年会上成为耀眼的焦点。研究人员展示了一项临床研究的结果,该临床试验的患者是携带TRK融合的患有17种癌症类型的50位儿童和成人,从罕见肿瘤到常见的结肠癌、肺癌。惊人的是:76%的患者的肿瘤缩小,该药物对有响应的患者在一年后依然有效。
Bilenker博士说:“我们所看到的真正的不分肿瘤的活性对我们来说有点令人吃惊。Loxo计划在2018年年初申请FDA批准其药物用于TRK融合的所有患者。”
上个月,该生物技术公司也开始试验下一代TRK抑制剂LOXO-195。虽然许多患者已经表现对拉罗替尼的持续反应,但癌细胞不可避免地会产生对靶向药物的耐药性。LOXO-195旨在通过做成一个大环将TRK的构象锁定以克服耐药性。
另外一家公司,Ignyta Inc.,也将在明年寻求TRK融合药物的获批。

Ignyta对其主要化合物entrectinib采用略微不同的方法,其药物阻断TRK、ROS1和ALK中的融合。它计划尝试在2018年获得针对TRK融合的不分组织的新药批准和针对ROS1突变肺癌患者的新药批准。

寻找信号
Loxo和Ignyta选择的不分组织的开发途径目前还是小众。尽管还有其它几个大型篮子试验正在进行之中,但大多数都是为了在公司进入特定器官或组织的试验之前找到一些疗效信号。当然,研究人员希望其中的一些研究能够揭示具有广泛功效的药物。
美国国家癌症研究所(NCI)最近宣布已经对6,000人的肿瘤进行了测序,作为治疗选择分子分析(Molecular Analysis for Therapy Choice,简称NCI-MATCH)的一部分。该研究于2015年8月开始招募患者,目的是将肿瘤具有特定分子特征的任何一位患者与21种药物或药物组合中的一种进行匹配。

Barbara A. Conley, MD
NCI癌症诊断计划副主任Barbara Conley医学博士负责监督NCI-MATCH研究。她表示,到目前为止,招募的患者中约有19%的人已找到了匹配的药物或药物组合,其中半数以上有罕见的癌症。
试验的目的是找出判断靶向疗法是否有效的信号。还有待观察的是,这些信号是表明拥有共同突变的患者中的广泛应用还是建议在特定器官中的功效。 Conley博士说:“将会有一些驱动要素如此强大,以致于他们能够对各种肿瘤促使响应并使患者获益,” 但是她预期对个别器官的响应可能更为普遍。
与此同时,诺华公司在过去的几年的时间里一直在运行它所谓的签名试验(Signature trials),类似地将患者与其中一种靶向治疗相匹配。
诺华公司北美肿瘤临床研究主管Richard Woodman先生说,签名试验自2013年推出以来,诺华公司研究了超过600例患有15种癌症并接受了一系列实验化合物的患者。
下一波浪潮
展望未来,研究人员看到不分组织药物批准的几个机会。每个人都指出,高肿瘤突变负担,对癌细胞中基因突变数量的一种量度,据信与对Keytruda等检查点抑制剂的阳性反应有关。
研究人员还有兴趣探索PARP抑制剂,该类抑制剂阻断有助于修补肿瘤DNA的酶,已被批准用于治疗BRCA突变型卵巢癌,可广泛有效地对抗所有BRCA突变的癌症。进行中的试验研究靶向HER2的乳腺癌疗法是否可以对其它HER2突变肿瘤有效。
Loxo公司的Bilenker博士说:“未来世界里,广泛的测序分析将被用于几乎所有常规的癌症治疗,以找到可以帮助发现正确治疗选择的任何信息。”
FDA似乎为基于遗传学开发药物的新途径开辟道路。局长Scott Gottlieb医学博士上个月在向参议院小组委员会作证时说,该机构今年将出台一项新政策,“将解决针对靶向药物的问题,以及如何简化针对遗传变异导致的罕见病的药物开发,这些疾病都具有相似的遗传指纹,即使临床表现略有不同。”

不管接下来发生什么,Adrienne等罕见突变患者都感谢最近的医药研发进展。Adrienne于2016年4月停止使用Keytruda治疗,一年多了仍然无肿瘤复发。鉴于她的基因组成,她知道她的癌症可能会“卷土重来”。 但是,她很放心,无论什么疾病,她都可以得到已获批的有效药物的帮助。

















