在所有真核细胞中,染色质是遗传物质的主要载体,核小体则是染色质的基本结构单元。组成核小体的组蛋白除了为DNA提供结构支持以外,还参与与DNA相关的细胞调控。其中,组蛋白的翻译后修饰(posttranslational modifications, PTMs)是一种参与细胞调控的重要途径。目前已被报道的组蛋白翻译后修饰不少于30种,例如:甲基化、乙酰化、磷酸化等,并且在组蛋白上的修饰位点不少于70种【1】。赖氨酸琥珀酰化(succinyl-lysine)是组蛋白修饰的一种,
最早于2011年被两个课题组独立发现【2,3】。
近年来围绕组蛋白赖氨酸琥珀酰化修饰陆续有不少研究,总的来说更多的是基于研究催化去除修饰的酶SITR5的研究,当然近日来自MD Anderson肿瘤中心
Zhimin Lu
课题组在
Nature
上报道了催化H3琥珀酰化修饰的酶KAT2A及其生物学功能的研究又一次将琥珀酰化的研究推向了新的高度【4】。
然而,
领域内对这一修饰是否会影响,以及如何影响核小体和染色质结构却知之甚少。
12月14日,香港大学化学系
李祥
( Xiang David Li)课题组在
Cell Chemical Biology
杂志发表了题为 “Site-Specific Installation of Succinyl Lysine Analog into Histones Reveals the Effect of H2BK34 Succinylation on Nucleosome Dynamics”的文章。 该文章利用硫醇-烯烃加成反应(thio-ene addition)首次得到了特异位点琥珀酰化修饰的组蛋白,并突破性的揭示了琥珀酰化对于核小体动态结构的影响。

为研究赖氨酸琥珀酰化对于核小体结构的影响,研究人员需要制备高纯度并且带特定位点琥珀酰化修饰的组蛋白。目前,普遍采用的制备手段包括:1)利用表达蛋白连接技术的化学合成手段;2)非天然氨基酸插入的生物手段。由于以上两种方法过程繁琐以及产率较低,因此并不能满足大量制备组蛋白以及修饰位点多样化的要求。
为解决上述问题,李祥课题组利用硫醇-烯烃加成反应得到琥珀酰化硫代赖氨酸(Kcsucc)以模拟组蛋白上赖氨酸的琥珀酰化修饰。核小体的晶体结构显示组蛋白H2B的第34位赖氨酸 (H2BK34) 位于组蛋白和核小体DNA的静电相互作用界面上,而琥珀酰化修饰会将正电的赖氨酸侧链转变为负电荷。因此H2BK34位点的该修饰可能会对组蛋白和核小体DNA之间的库仑力产生破坏影响,进而影响核小体的动态结构。为得到该修饰蛋白(H2BKc34succ),研究人员将组蛋白H2B上第34位赖氨酸被突变为半胱氨酸(H2BK34C);组蛋白H2BK34C与氮-乙烯基琥珀酰氨酸叔丁酯(tert-butyl N-vinylsuccinimate)进行硫醇-烯烃加成反应,得到叔丁基保护的H2BKc34succ前体(H2BKc34succ-tBu),然后利用三氟乙酸(TFA)脱去叔丁基保护基得到特定位点修饰的H2BKc34succ。
不仅是H2BKc34succ,利用该方法,研究人员可以快速、高产率地制备出任意位点的琥珀酰化修饰的组蛋白
。
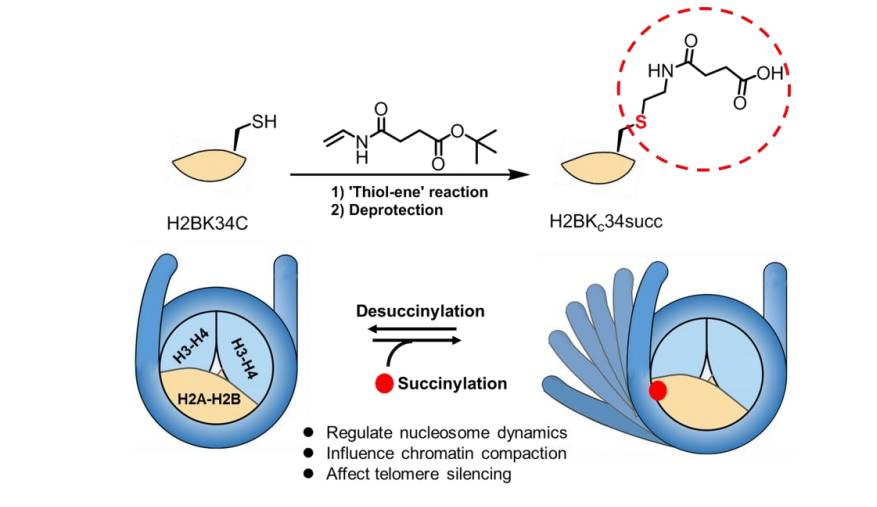
利用得到的琥珀酰化修饰的组蛋白(H2BKc34succ),研究人员通过组装核小体,并利用荧光共振能量转移方法(Fluorescence resonance energy transfer,FRET),定量研究该位点的琥珀酰化修饰对核小体结构的稳定性的影响程度。
实验结果突破性的揭示了琥珀酰化修饰会影响组蛋白与DNA之间的相互作用从而影响核小体结构的稳定
。
FRET实验显示,
相比于不含修饰的组蛋白构成的核小体,带有琥珀酰化修饰的组蛋白构成的核小体结构稳定性降低,核小体DNA和组蛋白的相互作用大大被削弱,核小体在更低的盐浓度条件下就开始解聚
。在芽殖酵母中,研究人员将赖氨酸突变为谷氨酸来模拟琥珀酰化修饰,发现该突变会导致端粒区域的基因转录水平上升,同时酵母细胞的染色质聚集程度也相比野生型降低。进一步的实验证明,此突变可增强组蛋白二聚体从核小体的解离来影响染色质的聚集及基因的转录。
据悉,李祥课题组长期从事开发化学工具以研究组蛋白翻译后修饰的功能,识别蛋白以及鉴定参与该调控的因子和其功能。该文章的共同第一作者分别是该课题组的博士研究生敬艺行和刘政。
参考文献:
1、H. Huang, B.R. Sabari, B.A. Garcia, C.D. Allis, Y. Zhao. SnapShot: histone modifications
Cell
, 159 (2014), pp. 458–458.e1
2、
Z. Zhang, M. Tan, Z. Xie, L. Dai, Y. Chen, Y. Zhao.Identification of lysine succinylation as a new post-translational modification.
Nat. Chem. Biol
., 7 (2011), pp. 58–63
3、Du, J., Zhou, Y., Su, X., Yu, J. J., Khan, S., Jiang, H., ... & He, B. (2011). Sirt5 is a NAD-dependent protein lysine demalonylase and desuccinylase.
Science
, 334(6057), 806-809.
4、Wang, Y., Guo, Y. R., Liu, K., Yin, Z., Liu, R., Xia, Y., ... & Hawke, D. (2017). KAT2A coupled with the α-KGDH complex acts as a histone H3 succinyltransferase.
Nature
, 552(7684), 273.
















