退行性膝骨关节炎(OA)
是一种以软骨退变、能量代谢障碍为特征的疾病,患者常因软骨细胞内ATP耗竭导致修复能力下降。传统人工细胞系统虽能模拟部分生命活动,但存在体积大、运动能力不足、生理环境适应性差等瓶颈,难以实现精准靶向治疗。
因此,如何
在复杂生理条件下开发兼具智能运动与能量供给功能的人工细胞微马达
,成为生物医学领域的重要挑战。
鉴于此,来自
中山大学的彭飞团队与南方医科大学的涂盈锋团队
联合开发了一种
光驱动人工细胞微马达(Vesical@MoS₂-ATPase)
,通过光控质子梯度实现定向运动与ATP原位合成,有效修复退变软骨细胞并抑制骨关节炎进展。相关研究以
“Light-Driven Artificial Cell Micromotors for Degenerative Knee Osteoarthritis”
为题发表在
《Advanced Materials》
上。

以下是对本论文创新点的简要概述:
(1)光控质子梯度驱动定向迁移:
研究团队将MoS₂纳米颗粒封装于磷脂囊泡内,利用其光水解特性产生质子(H⁺),形成局部电场驱动微马达向光源定向迁移。这种光控电渗机制突破了传统微马达在离子环境中的运动限制,速度达4.95 μm/s,且可在小鼠关节腔中穿透至软骨深层,实现精准靶向。
(2)跨膜ATP合成与能量修复:
通过整合植物来源的F-ATP酶,微马达利用跨膜质子梯度催化ADP合成ATP,光照下30分钟生成17.2 μM ATP。在炎症软骨细胞中,该体系显著提升ATP水平(接近正常细胞90%),恢复胶原Ⅱ和蛋白聚糖表达,降低ROS水平。
(3)体内外协同治疗骨关节炎:
小鼠模型显示,光驱动微马达可穿透关节腔,减少软骨磨损和滑膜炎,MRI显示治疗后软骨面积恢复至85.7%(对照组仅42.5%)。磷脂包裹保护MoS₂免受离子干扰,且生物相容性良好,未引发肝肾毒性。
研究首次将光合作用与人工细胞运动结合,为退行性骨关节炎提供了“能量修复+靶向递送”的一体化解决方案。
1. 人工细胞微马达的结构设计与制备
研究团队设计了一种基于磷脂囊泡、二硫化钼(MoS₂)纳米颗粒及植物来源F-ATP酶的人工细胞微马达(Vesical@MoS₂-ATPase)。通过水热法合成MoS₂纳米颗粒,并将其封装于磷脂囊泡内,同时在囊泡表面整合F-ATP酶,形成具有光响应和能量代谢功能的复合结构。磷脂囊泡的封装保护了MoS₂在复杂生理环境中的稳定性,而F-ATP酶的引入实现了跨膜质子梯度驱动的ATP合成。该设计首次将光合作用与人工细胞运动结合,为精准靶向治疗提供了基础。
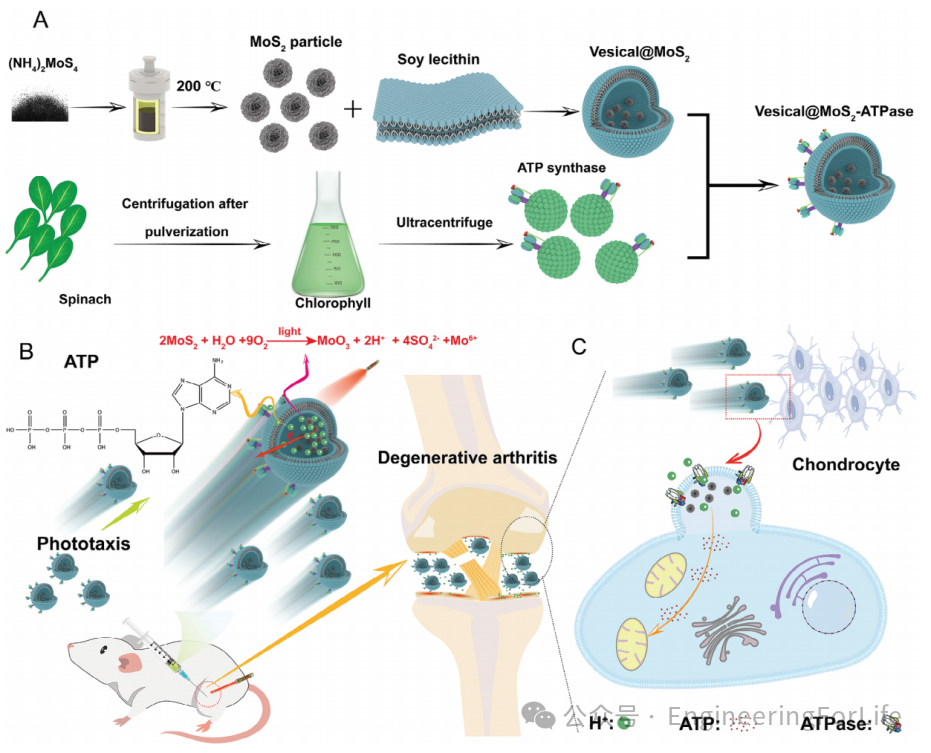
图1 光驱动人工细胞微马达的结构设计及工作机制示意图
2. 光控质子梯度驱动的定向运动机制
在光照条件下,MoS₂纳米颗粒发生光水解反应,产生质子(H⁺)并在囊泡内形成局部电场。由于MoS₂表面带负电,电渗流驱动其向光源方向迁移,微马达运动速度可达4.95 μm/s。这一机制突破了传统微马达在离子环境中运动受限的瓶颈,实现了小鼠关节腔内对软骨深层的穿透。模拟分析进一步验证了局部质子浓度梯度与电场的协同作用,揭示了光控定向运动的关键原理。
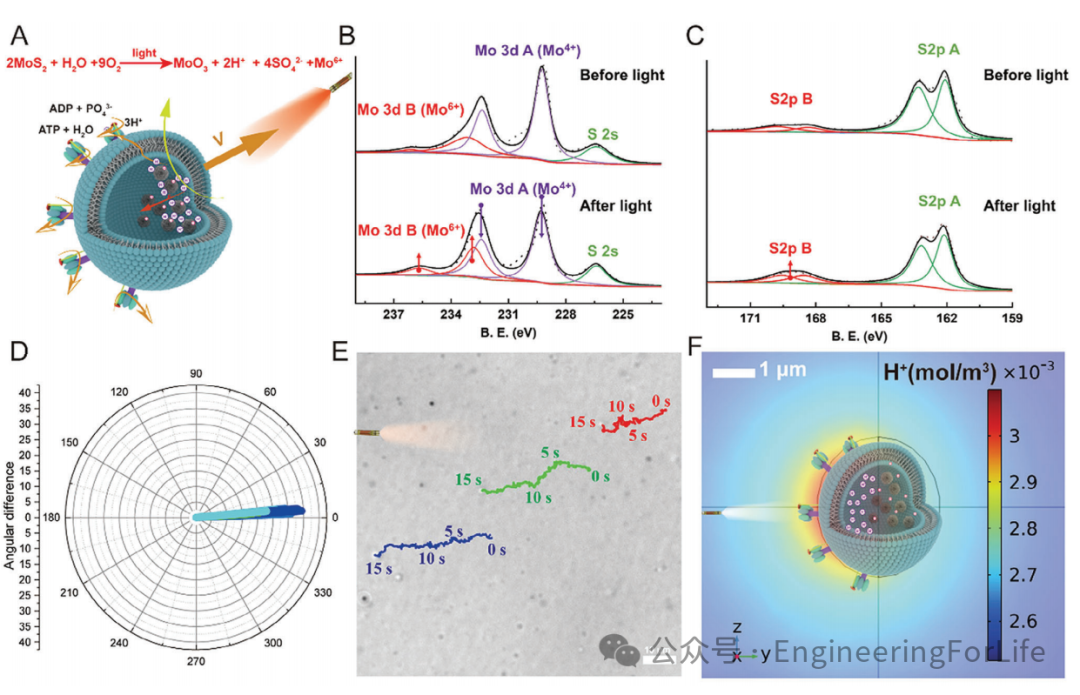
图2 微马达光控定向运动机制及迁移轨迹分析
3. 跨膜ATP合成及体外抗炎效应
微马达通过跨膜质子梯度激活F-ATP酶,在光照30分钟内催化生成17.2 μM ATP。在炎症软骨细胞模型中,该体系显著提升ATP水平至正常细胞的90%,恢复胶原Ⅱ和蛋白聚糖表达,并降低活性氧(ROS)水平。实验表明,微马达优先与软骨细胞融合,而非巨噬细胞,减少了免疫排斥风险,为体外抗炎治疗提供了高效能量补充策略。
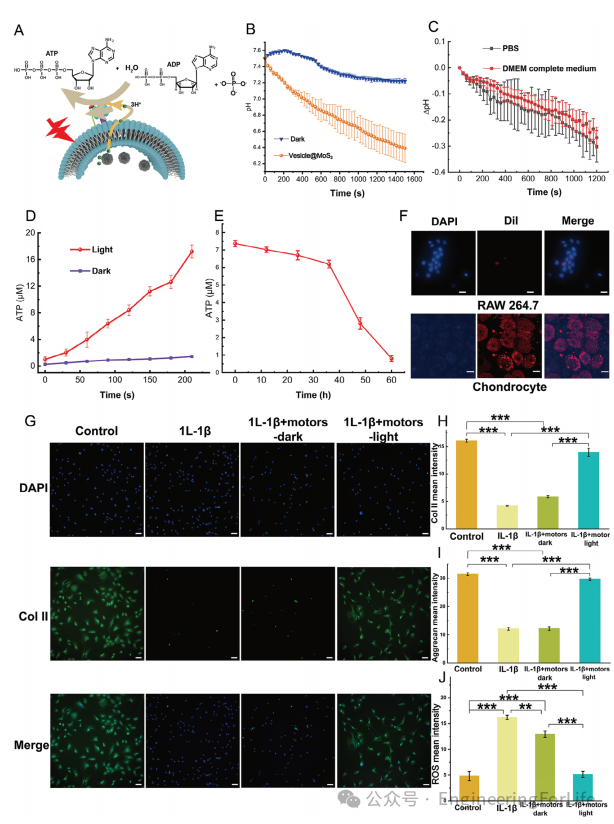
图3 微马达体外ATP合成及抗炎效应评估
4. 体内骨关节炎治疗的效果验证
小鼠模型实验显示,光驱动微马达可穿透关节腔,显著抑制软骨磨损和滑膜炎。MRI定量分析表明,治疗后软骨面积恢复至85.7%(对照组仅42.5%),组织学染色显示胶原Ⅱ和蛋白聚糖表达接近正常水平。磷脂包裹的润滑作用进一步减少了关节摩擦,验证了微马达在体内协同修复能量代谢与机械保护的双重功能。
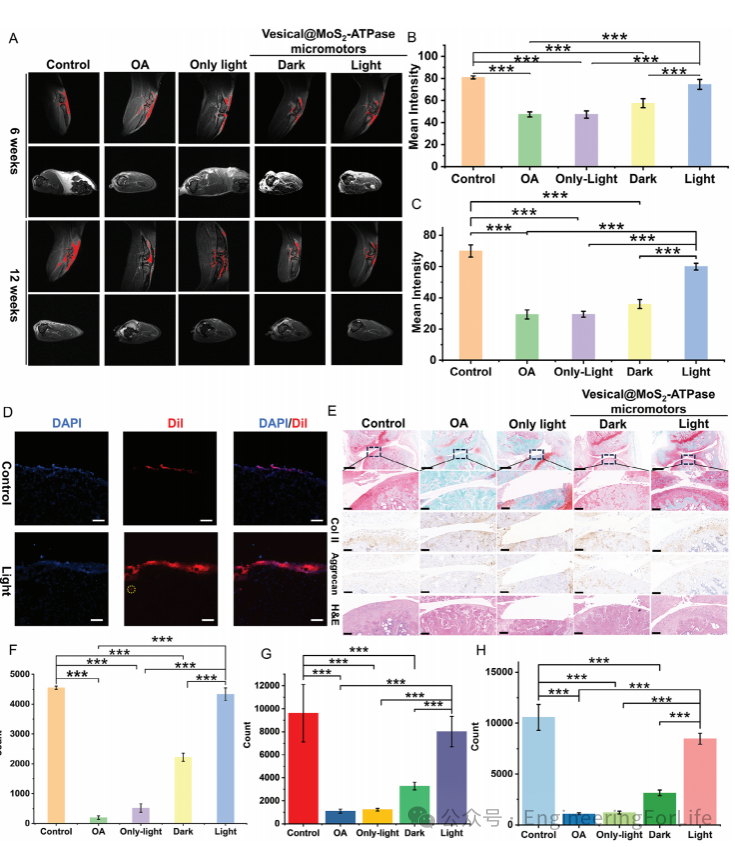
图4 微马达体内治疗骨关节炎的MRI及组织学证据
5. 生物相容性与系统安全性评估
研究通过血清生化指标和器官组织学分析验证了微马达的安全性。在治疗剂量下(MoS₂浓度0.58 μg/mL/g),肝肾功能指标(ALT、AST、尿素氮等)与对照组无显著差异,且未引发氧化应激损伤。高剂量(2.32 μg/mL/g)虽导致轻微毒性,但远高于实际治疗需求,表明系统在临床应用剂量范围内具有优异生物相容性。
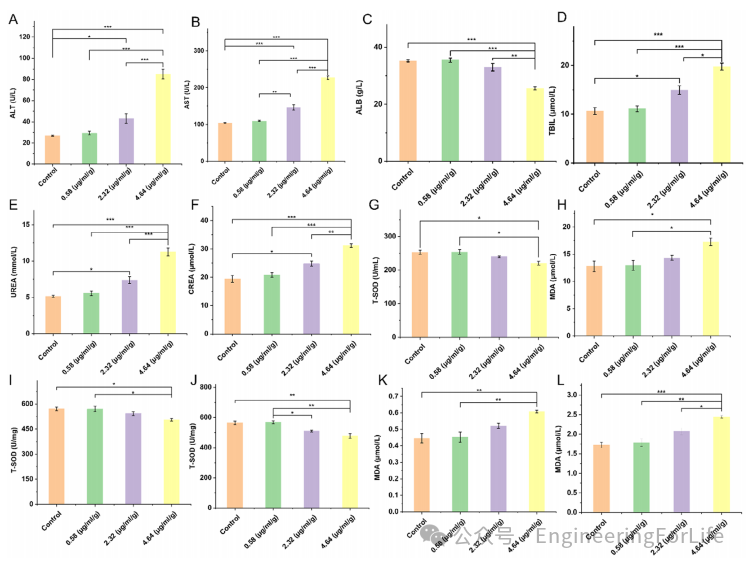
图5 微马达生物相容性及系统毒性检测
综上所述,本研究通过
仿生设计构建了光驱动人工细胞微马达
,解决了传统人工细胞在运动能力与代谢功能上的局限性。其光控定向迁移特性突破了生理环境对微纳米马达的束缚,而原位ATP合成机制为能量耗竭疾病(如骨关节炎、心血管疾病)提供了创新治疗策略。
未来可
进一步优化微马达的长期稳定性
(当前ATP酶活性72小时下降至10%),探索其在神经退行性疾病或组织再生中的应用。此外,结合多模态成像技术或智能响应材料,有望实现更精准的个性化医疗。这一成果为生物-无机杂化系统的临床转化开辟了新路径,标志着人工细胞技术向“动态生命模拟”迈出关键一步。
参考资料:
https://doi.org/10.1002/adma.202416349
来源:
EngineeringForLife
声明:仅代表作者个人观点,用于研究用途,作者水平有限,如有不科学之处,请在下方留言指正!






