正文
最近,《自然·生物(Nature Biotechnology)》刊载了一篇论文。英国伦敦帝国理工大学(Imperial College London)的研究人员宣布,通过基因编辑技术,在实验蚊子中传播“绝育”基因,最快只用7代蚊子,就完全消灭了一个蚊子种群。

消灭蚊子就是实验预期的目的。冈比亚按蚊传播疟疾,所以研究人员想发明一种快速灭蚊方法。但是,仅仅通过自发繁衍,就能让人为编辑的特定基因迅速扩散,最终消灭整个种群,这种技术展示的技术潜力可不仅仅是防治疟疾那么简单。
经过郭德纲和网民的演绎,“祖传不孕不育症”已经成了著名的互联网段子。这个笑话背后隐含了一个几乎无可辩驳的进化论原理——如果某种基因会影响生殖能力,它必然会在自然界迅速灭绝。所以,在自然生物种群中插入先天不孕个体,对整个种群影响不大。
但英国科学家恰恰要把这条看似“不可能”的路走通,通过扩散一种不孕基因,让族群中的母蚊子不能生育,达到种群灭绝的目的。
实验用到了两项当前最火的基因编辑技术:“基因剪切”和“基因驱动”。简单来说,“基因剪切”可以剪掉不要的基因,还可以粘贴上需要的基因;而“基因驱动”能够大大增加某个基因被继承的概率,让指定基因在有性生殖中传给下一代的可能性远大于1/2。
两者结合,就能让某个特定的基因,以最快速度扩散。
实验分为两部分:第一步,剪掉蚊子胚胎中的一段基因,看看胚胎长大后是否不孕。第二步,设法让所有蚊子都带上这种基因。
在第一步实验中,科学家通过“基因剪切”得到了4种蚊子:半残公蚊子、半残母蚊子、全残公蚊子和全残母蚊子。
他们和正常蚊子的对比图如下:

6种蚊子当中,
只有全残的母蚊子不能生育,所以目标是让全残母蚊子占据足够高的比例。
为了实现这个设想,科学家设计了第二步实验:
他们模拟自然投放环境,把1200只蚊子分成两组,安置到两个完全一样的实验箱中。每个箱子里有300只正常母蚊子、150只正常公蚊子和150只半残公蚊子。这里的半残公蚊子比第一步的更甚一筹。科学家运用“基因驱动”技术,
让他们更容易生出残疾子女。残疾的子女继续生出残疾的孙子辈、残疾的曾孙……直到生不出来。
复习下高中生物教给我们的孟德尔原理,正常情况下基因传递概率是这样的:
正常X正常 ——> 正常
半残X正常 ——> 正常:半残=1:1
半残X半残 ——> 正常:半残:全残=1:2:1 正常蚊子有1/4。
全残公X正常母 ——> 半残
任何公X全残母 ——> 绝后
根据这个规律,用不了几代,正常蚊子就会淘汰半残种群
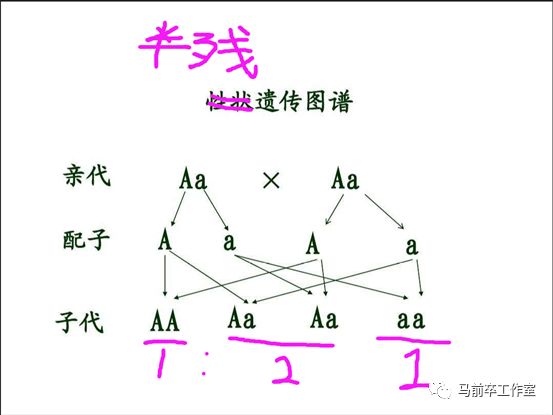
还记得被孟德尔遗传支配的恐惧吗
但这些半残蚊子都经过基因驱动技术的改造,实际发生的情况是:
正常X正常 ——> 正常
半残X正常 ——> 半残:正常=9:1
半残X半残 ——> 正常:半残:全残(正常比例未知,但肯定不是四分之一)
全残公X正常母 ——> 半残
任何公X全残母 ——> 绝后
总之,只要父母有一方是半残蚊子,那后代有9成是半残蚊子。尤其是半残妈妈,几乎肯定不会生出半残子女。孟德尔看不懂的遗传公式出现了。
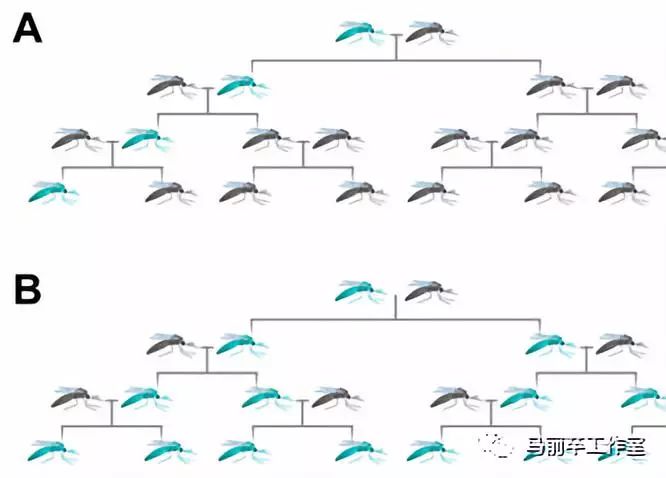
“基因驱动”参与后的遗传效果
这意味着半残蚊子固然容易绝后,但在绝后之前,总是在下一代中传播了更高比例的绝育基因。所以每一代蚊子都会生出更高比例的残疾蚊子,最终......
不难看出,致残基因扩散速度将轻松超过半残蚊子的死亡速度。而半残蚊子越多,全残母蚊子产生的概率就越大。
看下图:
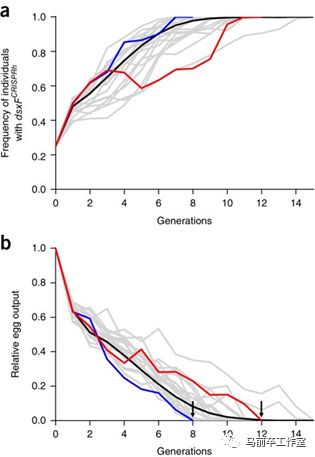
图一是致残基因在每一代的分布比例,图二是每代的产卵数量。红线和蓝线分别表示两个箱子。背景的灰色线条是在不同的偶然影响下,电脑拟合的种群曲线。
如图所示,红箱子里的第8代蚊子已经无法再产卵,蓝箱子繁衍到第12代也不再产卵,全都在拟合的预测范围内。人类第一套基因武器通过了测试。
不过,别急着扔掉你的蚊帐。因为这套武器还很不成熟。
“基因驱动”和“基因剪切”分别诞生于2002年和2012年。手持利器,科学家立刻就考虑如何花样“虐”蚊。
主要思路如下:
1)给蚊子注入抗传染病基因,让每只蚊子都成为“卫生”蚊子。
2)利用基因驱动,使蚊子只生某一性别的子孙,让蚊子种群性比失衡
3)设法让蚊子带上不孕不育基因,断子绝孙。
4)剪掉蚊子的其他基因,比如降低蚊子的视力和飞行能力,让他们无力传播疾病。
https://www.ixueshu.com/document/baa6cded372e4a80318947a18e7f9386.html#pdfpreview
以上每一项研究,都信誓旦旦“有望灭绝蚊子”,但这个在地球上生活了1亿年的昆虫,生命力异常顽强。这些方法要么需要反复投放,太麻烦;要么目前技术难以实现;要么是蚊子很快产生基因突变。即便某种手段对一种蚊子有效,换一个亚种,基因编辑又失效了。
比如本文的主角,伦敦帝国理工大学,也反复意识到自己的技术局限性:
“因为以字母M和S区分的冈比亚按蚊亚种在
外表上几乎一模一样,却存在大量深层基因差异,这些差异使它们的发育、进食和繁殖习性都不相同
,对其中一种蚊子有效的防治手段,未必对另一种蚊子有效。”
http://news.163.com/10/1025/11/6JRAT7I400014JB5.html
以往谈到基因武器的时候,人类总是想针对特定基因开发出一种病菌,感染包含指定基因的生物。至于病菌传播,还得靠其他工具抛入目标种群,和传统武器区别不大。但这次通过基因驱动技术,英国科学家成功地把生物的正常繁衍变成了传播工具,等于在种群内部投下了一颗“遗传炸弹”,杀伤半径随着蚊子的繁衍而不断扩大,最终消灭整个种群。
夏天被蚊子咬的时候,每个人都期盼能一挥手消灭所有蚊子。但当人类真的掌握了这种能力,却很少有人敢随手扔出基因炸弹——因为我们不知道爆炸的后果。不说在人类种群中释放基因炸弹会怎样,就算我们能把杀伤范围控制在蚊子一种生物,恐怕也不知道有多少食物链上的其他生物会被波及,会有多少地区的生态平衡发生不可逆的改变。所以,即便武器测试成熟,遗传炸弹也必须在无比严谨的考察下才能释放。
但基因编辑技术的扩散,却是不可逆的趋势。因为人类并不是一种为现代生活“定做”的生物。现代人希望“逆天而行”,希望活五百岁,又要生活精致,还要保持健康……这本身就不符合生老病死的自然规律,为基因编辑技术提供了强大的需求。所以,除了对付蚊子,很多国家已经在老鼠、狗、猪、羊……乃至人类身上开展试验。
韩国基础科学研究所基因工程中心的科学家们,刚刚使用CRISPR-Cas9对活鼠视网膜支撑组织进行了“基因手术”。2015年,中国科学家通过去肌肉生长抑制素基因基因创造了两个超级肌肉小猎犬。
http://tech.ifeng.com/a/20151020/41493436_0.shtml

超级肌肉狗大力神(左)和天狗
2016 年,四川大学的医疗团队开展了人体首例基因编辑(基于 CRISPR)的临床试验。
https://www.sohu.com/a/218322803_733985
还有商人开始兜售自行注射的基因编辑器。
最近由Do-It-Yourself (DIY)生物黑客发起的众筹活动引起了众多关注。
生物黑客初创公司Odin在其网站上销售DIY Bacterial CRISPR试剂盒,零售价为159美元。
2017年10月,Odin的首席执行官Josiah Zayner在于旧金山举行的合成生物学会议上为自己注入了CRISPR改造肌肉生长的基因。
https://baijiahao.baidu.com/s?id=1593190189780591649&wfr=spider&for=pc








