细胞在进化上一个至关重要的事件就是出现自主运动,这极大地扩展了生命体对其生存环境的探索范围和适应能力。纤毛
(cilia)
和鞭毛
(flagella)
就是这样一类重要的细胞器,它们赋予了真核细胞极强的自主运动、体外物质运输或环境信号感受能力。纤毛主要亚显微结构以微管
(microtubule)
为骨架,微管连接在基体
(basal body)
之上,在胞体外长约5-10微米
【1】
。高等生物几乎所有细胞都有纤毛,并且在功能结构上出现重要分化,使得其在信号转导、神经响应、及胚胎发育等诸多过程中都发挥着重要作用。从功能和结构上,纤毛可分为两大类:一种是原纤毛
(primary cilia)
,利用纤毛膜
(ciliary membrane)
上的特异受体完成与外界信息的交换,主要起感应作用;另一种是运动纤毛
(motile cilia)
,能够完成在时间和空间上高度协、具有高效能耗的节律运动
(rhythmic beating)
。运动纤毛在高等动物体内主要分布于气管、脑室管膜及输卵管等上皮组织,其周期性摆动可清洁气管病原物、驱动脑脊液流动和受精卵运动。此外,精子的尾巴是一种具有可调控的极强自主运动能力的长鞭毛,在受精过程至关重要。
绝大多数运动纤毛的都具有一个经典的 “9+2” 骨架,即9根二联管
(doublet microtubule,MTD)
围绕两根中心微管
(central pair)
,而所有的运动纤毛最终的动力源都来自一个被称为动力蛋白
(dynein)
的分子马达
【2,3】
。动力蛋白是一种特异向微管负极运动的蛋白,在胞质运输和细胞运动中扮演核心角色,其结构分为尾部和头部,尾部结合货物,头部负责在微管上行走。人体除了胞质动力蛋白1
(dynein-1)
,其余15种全部特异定位到纤毛上,负责纤毛运动和纤毛内物质运输。每一根MTD上都结合了两列特化的轴丝动力蛋白
(axonemal dyneins)
,即
外臂动力蛋白
(outer-arm dynein,
OAD
)
和
内臂动力蛋白
(inner-arm dynein,
IAD
)
。动力蛋白的尾部固定在MTD上,头部水解ATP释放能量并在邻近MTD上行走,这就使得相邻两根二联管相互滑动,以此驱动纤毛的节律性运动。外臂动力蛋白是纤毛运动的主要贡献者,可提供高达约85% 的能量。虽然外臂动力蛋白是第一个被发现的动力蛋白,但缺乏精细结构基础的局面使得其运动机制至今是个谜团,而于此同时各种基于宏观观测的假说却常常相互矛盾。自上个世纪60年代被发现以来,对于OAD沿着MTD如何以列的方式排布,以及相互之间是如何协同作业,最终使纤毛呈现节律性运动等问题一直备受争论。
2021年9月23日,耶鲁大学
张凯
课题组在
Nature structural & Molecular Biology
期刊上在线发表题为
Structures of outer-arm dynein array on microtubule doublet reveal a motor coordination mechanism
的文章, 首次解析了
外臂动力蛋白结合微管二联管
(OAD-MTD array complex)
的两种构象
(microtubule-binding state 1 and 2, MTBS-1 and MTBS-2)
以及自由状态的外臂动力蛋白
(free OAD)
的高分辨率结构
(图1)
,结合质谱分析和全基因组结构-序列匹配等鉴定了完整的OAD组成成分并,并辅助电子断层、体外生化重组装、计算模拟、以及微管滑动等实验,清晰地阐释了OAD是如何沿MTD上组装成列,以及以列排布的外臂动力蛋白
(OAD array)
是如何相互协同工作的分子机制。



图1-运动纤毛横截面示意图,OAD组成成分和活性检测结果,OAD-MTD array complex的总体结构,以及OAD的总体3.5埃的高分辨率冷冻电镜结构。
OAD-MTD array complex的结构清晰展示了外臂动力蛋白是通过两个相邻分子以“头-尾”相连的方式形成“联排动力臂”,结合在MTD上的所有OAD的头部呈现为平行构象
(parallel conformation)
,这也是动力蛋白处于活化状态的标志。这种头部平行构象可以提供一个稳定的凹槽,刚好能够与尾部爪形的凸起形成稳定的结合。而从解析出的free OAD的结构上来看,作者发现,free OAD头部处于松散的没有固定构象的状态,无法形成稳定的凹槽与另一分子尾部结合,而有一小部分可以通过动态平衡处于pre-parallel conformation。结合此前领域的证据,作者提出OAD在纤毛中的组装过程中,动态多构象的free OAD结合MTD导致的平行构象是形成OAD array的一个关键结构基础
(图2)
。

图2- OAD array “头-尾” 结合的结构基础以及组装成OAD array的机制。
特别地,作者发现与尾部结合的相邻OAD的头部区域正是动力蛋白水解ATP产生变构效应的最重要的位点
(AAA1附近)
,结构显示尾部存在抑制临近OAD水解ATP的作用,并得到了不同条件下MTD-OAD体外重建实验的支持。利用ATP 类似物ATPγS低水解速度的特性,作者们成功捕捉到了结合在MTD上的列式外臂动力蛋白是以末端释放
(end-release)
的方式逐个掉落,进一步证实了尾部的抑制作用。另外,局部范围内,OAD-MTD array complex的两种结合状态MTBS-1 和 MTBS-2各自呈现出高度的同步化,并发现这两种结合状态的主要区别是头部中的一条重链分子往负极方向走了一步,即8纳米,刚好是水解一个ATP后重新结合MTD的状态,这也就说明这MTBS-1 和 MTBS-2是OAD水解ATP循环中的相继的两个微管结合态。此外,结构分析发现除非打破“头-尾”结合,不然这两种构象无法同时出现在相邻位置。基于作者自己的结构发现并结合领域内几乎所有已知证据,作者提出了一个完整的OAD array 协同一致往MTD负极迈一步的分子模型
(图3)
。局部范围内,OAD array结合MTD的情况下,只有末端OAD处于自由水解ATP的状态,当其水解ATP成ADP.Pi时,尾部构象发生变化,其爪形凸起将从下游正极方向的OAD凹槽构象中分离,导致“头-尾”结合的破坏,这一过程释放了正极方向上OAD的抑制状态使其也可以自由水解ATP,以此类推,就可以完成协同化水解ATP的过程。
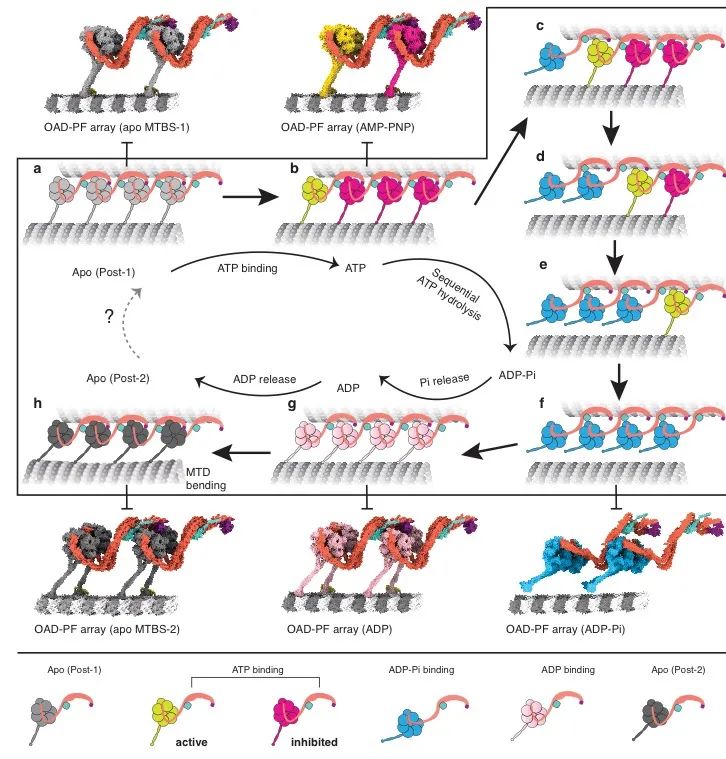
图3-OAD array 协同向MTD负极移动的机制模型。
鉴于dynein结构的复杂性和高度动态特性,其高分辨率结构研究完全可以用“举步维艰”来形容,而该论文一次性给出了一系列关于dynein自身、微管结合、变构效应、
联排
OAD组装机制、多个OAD之间协同机制等最完整的高分辨率结构信息,直击dynein领域若干核心问题。
由于该项工作涉及信息量极大,在评审阶段曾被dynein领域资深专家强烈建议拆分成两篇长文发表,以扩充可讨论范围。
此外,值得一提的是,本项研究工作得到了国际上dynein领域的高度认可,在
dynein 2021
国际会议上荣获Gibbons Award
(以纪念dynein发现者Gibbons夫妇)
,并受邀在会议上做了keynote报告。根据颁奖页面上显示,评选委员会从22个与动力蛋白领域相关的有力申请中选择了张凯实验室的工作,并做了以下评价:
“Th
e committee specifically noted that Zhang and Rao’s “beautiful work… provides a molecular basis for how large dynein arrays within the axoneme coordinate their chemomechanical cycles to produce movement within cilia and flagella.”
耶鲁大学博士后饶钦辉、韩龙、王玥,以及耶鲁大学二年级博士生柴鹏鑫为共同第一作者,耶鲁大学张凯是本课题的通讯作者。耶鲁大学Joe Howard教授实验室合作参与了该研究。耶鲁大学西校区电镜平台负责人吴申平为本研究提供了技术支持。
原文链接:
https://www.nature.com/articles/s41594-021-00656-9
1.D. R. Mitchell, Evolution of Cilia.
Cold Spring Harb Perspect Biol
9, (2017).
2.S. L. Reck-Peterson, W. B. Redwine, R. D. Vale, A. P. Carter, The cytoplasmic dynein transport machinery and its many cargoes.
Nat Rev Mol Cell Biol 1
9, 382-398 (2018).
3.S. M. King, Axonemal Dynein Arms.
Cold Spring Harb Perspect Biol
8, (2016).
【非原创文章】本文著作权归文章作者所有,欢迎个人转发分享,未经允许禁止转载,作者拥有所有法定权利,违者必究。






