
麻醉药的药代/药效学模型及其临床应用
许文妍1,董希玮2,张马忠1*
(1. 上海交通大学医学院附属上海儿童医学中心麻醉科儿童临床药理研究室,上海 200127;2. 新疆生产建设兵团医院麻醉科,新疆乌鲁木
齐 830002)
[ 摘要] 麻醉是药物诱导的一种或多种行为状态,包括意识消失、遗忘、镇痛及麻痹等,常需联合使用多种麻醉药物。与其他临床治疗药物不同,麻醉药给药后迅速分布于血液、脑或其他作用部位,数分钟内产生麻醉效应并可在数分钟或数小时内恢复。麻醉药的药理效应平行于效应位浓度,但无论是单次注射还是持续给药,效应位浓度及药物效应总是滞后于血浆药物浓度。为精确控制麻醉药物效应,需充分了解其浓度随时间的变化过程和特点。重点介绍静脉麻醉药的药代/药效学、建模、浓度-效应关系和药物相互作用研究情况,为麻醉医师优化药物临床使用方案及对其开展进一步相关研究提供参考。
[ 关键词] 药代学药效学;麻醉药;建模;药物相互作用;靶控输注
麻醉状态下,患者意识和记忆缺失、对手术和(或)麻醉操作等无反应。其中一些效应可定量评价,如脑电图、血压等随剂量增减而变化;意识消失、对手术或麻醉操作刺激的体动反应等则为定性评价,发生概率也随剂量增减而改变。此外,低血压、心动过缓和呼吸抑制等不良反应也与麻醉药的剂量相关,常发生于剂量较高情况下。因此,患者使用的药物剂量应维持在“治疗窗”内,即足以获得治疗效应同时避免恢复延迟或产生其他不良反应。显然,治疗窗越宽药物的安全性越大;但治疗窗与患者年龄、生理状态或合并用药等诸多因素有关,疾病状态下治疗窗可能变窄。麻醉医师应基于特定患者和手术以确定治疗窗,随后评估麻醉效应并实时调节。
大部分麻醉药为脂溶性,单次给药后其在体内分布速率不同,且遵循一定的规律。部分麻醉药进入并作用于中枢神经系统;大部分分布于血液、肌肉和脂肪组织;少部分通过代谢或分泌从体内不可逆消除。临床操作时间从数分钟到数小时不等,因而麻醉药在体内分布几乎不会达到稳态,与药物剂量相关的效应随时间而变化,但大部分情况下临床效应与效应位浓度变化一致。为控制麻醉药物的效应位浓度,满足临床手术需要,临床医师需充分了解麻醉药物药代学(PK)、药效学(PD)及药物相互作用,进而合理地、个体化用药。本文重点介绍静脉麻醉药(不含肌松药)的PK/PD模型相关研究进展及其临床应用情况。
1 药代学模型概述
给予一定剂量的某种麻醉药(单次或持续输注)并取血样分析浓度,药物血浆浓度随时间变化过程可用二室或三室模型精确描述。图1a 所示三室模型包括假想的中央室及2 个外周室,药物进入中央室(容积V1)后迅速均匀分布并以速率常数K12、K13 流向外周室(容积V2 和V3),同时以K21、K31 回流并以K10 从中央室排出体外,通常临床测定的血浆浓度相当于中央室浓度,显然药物离开中央室流向外周室分布及不可逆消除使血浆浓度降低,而进入体内的药物和从外周室回流入中央室的药物则增加血浆浓度。必须注意的是,房室间药物转运同步进行,无先后之分。药物在房室间转运和消除见图1b 所示,血浆浓度随时间的变化规律取决于药物种类,与剂量无关。线性药物剂量加倍则相应时间的血浆浓度也加倍;如给予2 个剂量(例如单次注射+ 持续输注),则血浆浓度将是两者之和,称之为“叠加法则”。
早期PK 建模多为二阶段法,分析每例患者的PK特点,随后将PK 参数平均。20 世纪90 年代后,PK建模均采用混合效应模型群体药代学方法,即整体考虑所有患者样本,模型提供PK 参数典型值以及参数和预测浓度的个体间和个体内变异性,这种建模方法所需病例总数和每例患者样本量也较少。此外,还可将患者个体资料,如体质量、LBM(lean body mass,瘦体质量或去脂体质量)、年龄等整合到模型参数中,以改善拟合效果并提高血浆和效应位浓度预测准确性。
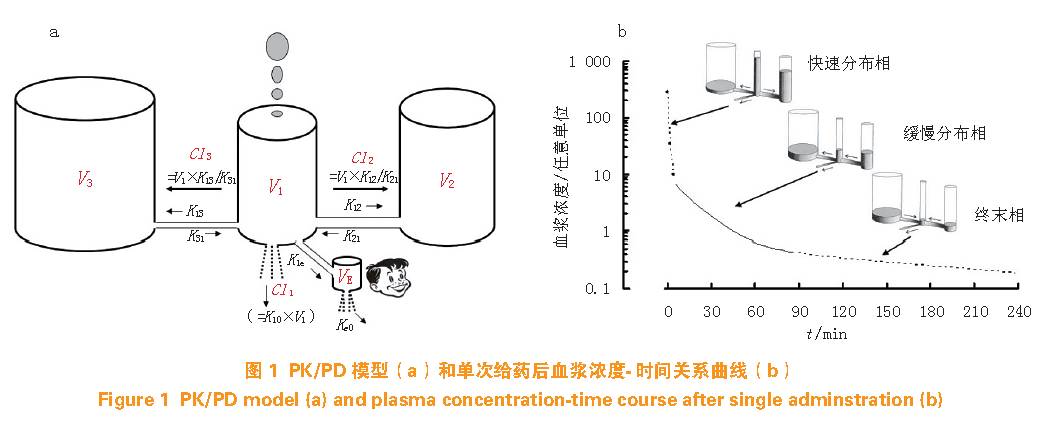
PK 模型根据药物剂量和患者资料等描述血浆浓度随时间的变化。但麻醉药作用部位(效应位)并非血浆,药物效应通常滞后于血浆浓度,因而人们提出了效应室模型的概念。效应室是经典模型中中央室和外周室以外的一个假想房室,容积为VE(见图1a),药物从中央室进入效应室的速率常数为K1e,从效应室消除的速率常数为Ke0(也称血浆效应室浓度平衡速率常数)。理论上,VE 和K1e 均很小,仅为V1 和Ke0 的十万分之一或更低,药物进出效应室不影响体内代谢过程。简单的PK 模型凭藉Ke0 得以扩展到PK/PD 模型,稳态时血浆浓度等于效应室浓度。
2 药效学与药效相互作用建模
2.1 药效学模型
药物效应位浓度与药物效应(治疗效应、不良反应等)相关。常用麻醉效应评价如意识消失、切皮反应等定性指标,描述的是其发生的概率;其他如神经肌肉阻滞、呼吸抑制程度及一些替代判断等为定量指标,可直接测量并描述。不论评价性质如何,这些指标与治疗效应高度相关,同样浓度总是产生同样水平的临床和治疗效应。大部分情况下,效应强度(或概率)均随浓度增加而增加并在高浓度时达到最大值,因此,效应位浓度和效应的关系可用S 型曲线(Hill 方程)表示,即药物在效应室浓度与药物效应的“X-Y”散点图,其数学表达和图形描述见图2 。
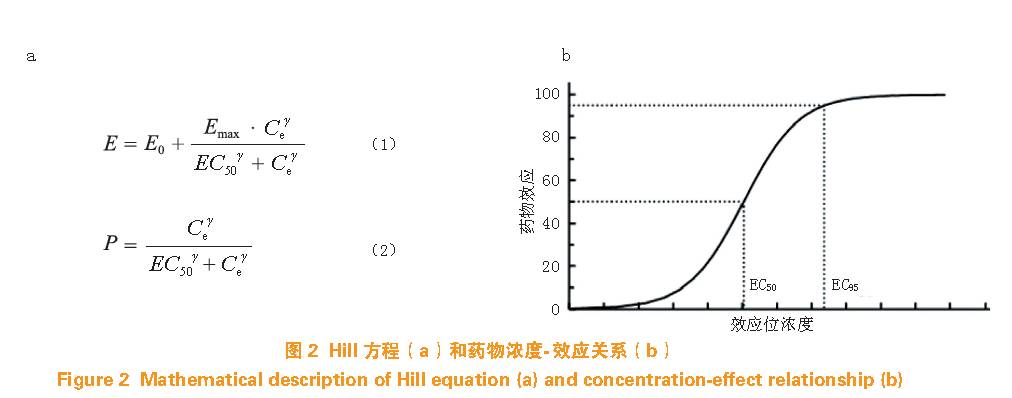
图2a 中E 代表预测效应,E0 是基础值(无药物作用),Emax 是药物最大效应,Ce 是药物效应室浓度,其变体可用于预测药物的浓度达到某值时,发生某种效应的概率(P)。EC50 是产生50% 最大效应时的效应室浓度;γ 是曲线斜率,γ 较大时浓度较小变化能引起效应的较大变化,浓度-效应曲线陡直。
2.2 药效相互作用模型
全身麻醉包括镇静、镇痛和肌松,其中肌松效应也可用Hill 方程描述。就镇静和镇痛而言,临床所用药物仅在某一方面具有优势,如阿片类(芬太尼、舒芬太尼、阿芬太尼和瑞芬太尼)主要作用是镇痛,高浓度时具有轻微镇静效应,但可中度增强镇静药的镇静作用;而异丙酚、硫喷妥钠、依托咪脂或咪唑安定等主要用于镇静催眠,几乎无镇痛作用,但与阿片类合用则明显协同增强镇痛效应(其导致的效应远高于两者单独作用之和)。
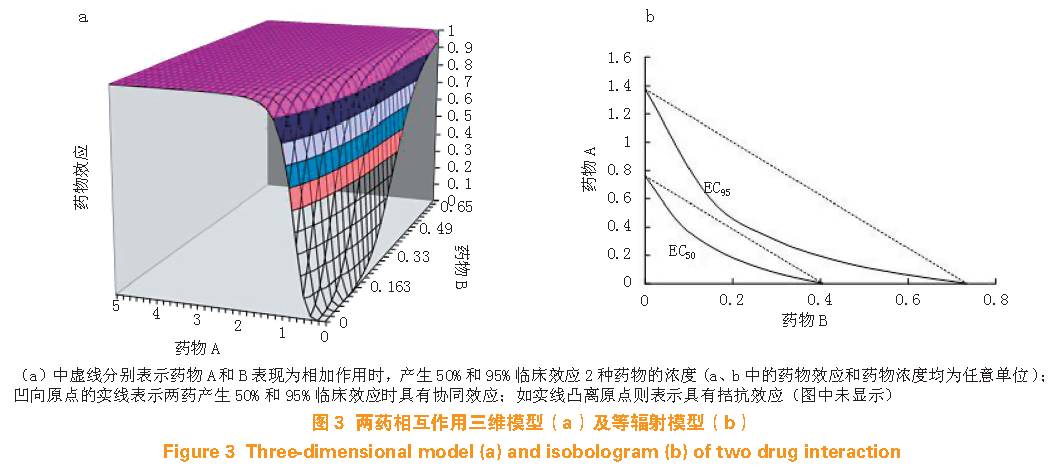
临床对上述两类药物合用后的镇静或镇痛效应分析主要关注的是EC50 和曲线形状。早期常用等辐射分析描述药物的相互作用,即药物A 和B 合用后的浓度-效应之间的线性关系:预测药效=α[A] +β[B]+γ[A][B]也称Greco 模型(其中α、β 和γ 为线性系数),根据γ 判断药物间是协同还是拮抗作用。Minto 等建议采用反应曲面模型,假想2 种药物的任意浓度组合为一种“新药”,新药浓度定义为单药浓度与其EC50的比值,产生的效应遵循S 型最大效应模型。Greco 和Minto 模型均可建立三维药效学模型图形,x 轴和y 轴表示药物A、B 的浓度,z 轴则表示药物的效应。从单独使用A 药、A 药和B 药合用,直至单独使用B 药,分别对应于一条径向S 型量效曲线(见图3a)。实际上,如从图3a 中50% 和95% 处横断,即可得到图3b类似于早期描述的二维等辐射EC50 和EC95 模型。药物相互作用模型建立基于测量浓度和效应,可采用群体分析方法描述所有浓度范围内的药物效应。
3 药代/药效学模型的临床应用
3.1 药代或药代/药效学模型
PK 模型在临床麻醉中的应用首推靶控输注(TCI)系统。该系统输注麻醉药物时,用户直接选择靶血浆或效应位浓度,计算机依据PK/PD 模型计算获得或维持靶浓度所需剂量并尽可能减少超射,并以5~30 s 间隙更新输注速度。如麻醉医师希望降低靶浓度,软件将停止输注并持续预测浓度,一旦达到设定的靶浓度即迅速恢复输注;更换注射器或静脉通路阻塞后恢复输注时,软件将计算并给予负荷剂量以重新获得靶浓度。TCI 软件可显示血浆浓度、效应位浓度随时间的变化,如单次给药后需多长时间达到最大浓度,以了解药物峰效应延迟,据此也可精确控制给药方法并使得多种药物峰效应同时达到最大,是一种绝佳的教学工具。对于仅有PK模型的药物,可基于药物峰效应时间,帮助估测Ke0 值,建立完整的PK/PD 模型。
部分厂商将TCI 系统与高速输注泵结合且获得欧洲统一认证(CE 认证),除北美外已广泛用于临床麻醉。1996 年TCI 系统首先用于异丙酚,随后逐步扩展到舒芬太尼、瑞芬太尼,2003 年用于阿芬太尼。异丙酚或瑞芬太尼TCI 输注,可快速控制切皮反应、血流动力学更稳定、自主呼吸控制良好,也有用于病人自控镇痛。采用TCI 麻醉输注期间患者药物浓度变化小,大幅减少麻醉医生的工作量,患者接受度较高。
TCI 系统也可计算输注时间敏感性半衰期(context-sensitive half-time, CSHT):即药物从停止输注即刻至血药浓度降低50% 时所需时间;或计算患者从当前血药浓度降至清醒时血药浓度时所需时间,据此可估测患者恢复时间。停止输注后,CSHT 取决于药物清除率及中央室和外周室再平衡。因为麻醉药向外周室分布很少达到稳态,因此药物再分布对患者恢复影响很大。CSHT 远快于药物消除半衰期,但随输注时间而延长。同时,合用2 种药物(如异丙酚+ 阿片类)时,系统显示的下降时间有助于麻醉医师适当权衡并调节,利于患者快速恢复。
3.2 药效和药效相互作用模型
临床浓度设定目标并非获得EC50 而是EC95(95%患者无反应)。但在EC95 附近曲线较平坦,若想获得更大效应需要非常高的药物浓度,那么不良反应和患者恢复延迟概率将明显增加;相反,在EC50 附近曲线陡直。麻醉时应权衡浓度-效应关系曲线帮助临床决策。EC50和γ 是临床用药的基础参数,可参照其用于确定多种临床情况下最合适的药物浓度,γ 较小时,浓度-效应曲线陡直,药物治疗窗狭窄,临床用药时充分了解相关知识可预防不良反应的发生。此外,药物效应不同则Hill曲线参数也不同,例如异丙酚在意识消失、切皮、气管插管时的EC50 分别为4、10 和17 mg · L-1。
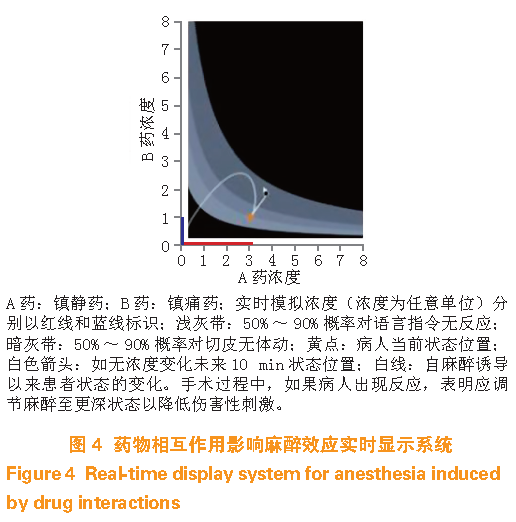
然而,临床麻醉至少包括镇静和镇痛2 个部分,须考量其间的相互作用。从临床应用角度看,反应曲面模型虽然描述全面但难于理解。为方便起见,可将反应曲面模型仅描述为二维EC50 和EC90(或EC95)等辐射曲线。基于TCI 系统预测或实测阿片类和镇静催眠药物浓度,直接屏显预测患者药理效应的可能状态,包括过去、现在和未来的趋势。图4 即为实现上述方法的示意图,有助于临床医师调整药物输注、预测伤害性刺激的反应,借助脑电图监测也可更好地预测镇静深度。
4 药代/药效学模型的局限性
几乎每种麻醉药均建有数种PK/PD 模型,其中多数以脑电图作为定量效应协助建立Ke0 参数,也有些药物仅提供了简单的PK 模型。PK/PD 模型可指导制定临床用药方案和设计临床试验,但模型仅能反映部分现实,临床应用需了解模型的局限性。
PK通常假设给药后瞬间药物在体内快速均匀分布,但实际上这是不可能的,因为药物在体内早期分布需要时间,且与给药位置和心输出量等有关。因此,用于描述给药初期浓度变化的模型准确性较差。几乎所有房室模型都假设药物仅从中央室消除,但瑞芬太尼等药物也从外周组织消除,这就有可能低估清除率并高估血浆浓度。此外,PK/PD 模型通常仅考虑母体药物浓度与效应,很少考虑其(比如吗啡)活性代谢产物也是局限性之一。
尽管可采用LBM 作为PK 参数协变量,但对于肥胖患者的应用争论很多。LBM 估算公式基于中度肥胖患者体质量和身高建立,外推至病态肥胖患者后其本身的准确性存在问题,可能低估患者LBM,进而导致瑞芬太尼用量相对较低或异丙酚过量。为避免此类风险,TCI 系统开发者建议其应用范围限制于男性LBM<42 kg · m-2,女性LBM<35 kg · m-2,并推荐逐步调整以补偿误差。即便模型考虑了患者的生理参数,个体PK/PD 依然有别于参数典型值,且PK/PD 也可能随时间变化,TCI 基于典型值运算是其不足之一。例如测量血浆浓度并与模型预测值比较,采用贝叶斯原理调整模型使之更接近患者个体,这可能特别适用于那些远离群体模型的患者(如心衰、肥胖或多器官衰竭患者)。部分麻醉医师通常随便选择一种模型或使用系统内嵌模型,但由于存在以上局限性,切不可盲目信任模型预测的准确性。
药效学或相互作用模型的局限性首先来自效应评价指标的可靠性,迄今为止麻醉深度、镇痛等效应缺乏一致性指标。即便是临床研究,采用的效应评价指标多为替代性指标,这给模型推广应用带来很大难题。其次,药物相互作用建立的数学模型缺乏理论基础,实际上无论是Greco 模型还是Minto 模型,均是建立在100 多年前Loewe 经验模型的基础之上,无法从药物作用机制上对其加以阐述。此外,尽管非线性混合效应模型具有强大的功能,但考察协变量对PK 参数影响的方法仍存在争论,也因此,小儿患者缺乏可靠的TCI系统。如此再综合考虑PD 的个体间和个体内变异性,情况将变得更为复杂。
麻醉领域已开发多种闭环控制系统,这些技术基于量化麻醉效应,反复比较效应测量值和目标值差异,并调整输注以获得和维持目标效应。部分研究表明,在估测麻醉深度方面性能合理,但定量镇痛及其特异性仍存在较大争论。有建议采用工业上的比例-积分-微分控制器规则(PID 控制规则),基于效应(测量-预测)误差及其随时间的变化调整输注,但受限于目前药理效应定量技术,其可行性较差。根据PK/PD 模型控制可能更为安全,在这种情况下效应误差改变模型参数,类似特定条件下贝叶斯过程。临床研究表明,闭环可改善目标控制时间(维持脑电双频指数在预设值附近的时间从70% 增至90%),控制质量也得到改善(血流动力学稳定)。
5 结语与展望
PK 是药物临床前和临床研究的重要组成部分;PD则进一步明确药物对机体产生的药理效应。PK/PD 模型的建立,有助于根据模型指导临床用药。就静脉麻醉药而言,基于PK/PD 模型在临床麻醉中已建立了更为合理的给药方法,也已实现计算机控制药物输注,并在临床广泛使用(美国除外)。但其仍存在一些局限性,主要包括:1)缺乏明确的生理解剖对应关系;2)模型假设存在局限性,例如通常假设药物注射后瞬间在体内均匀分布,但实际上这是不可能的;3)药物浓度实时检测困难,使得依据实测浓度进行模型的个体化改良更难;4)关于儿童PK/PD 究竟是如何随着年龄增加而发生改变依然存在较多争论。未来麻醉药PK/PD 的精确性和实用性研究,有赖于药物基因组学的发展、对药物代谢和效应器官生理基础的进一步研究阐明。
[ 专家介绍] 张马忠:医学博士、主任医师、博士生导师;上海交通大学医学院附属上海儿童医学中心副院长、麻醉科学科带头人。担任中国心胸血管麻醉学会理事、小儿麻醉学会副主委;中国麻醉医师协会青委会副主委;研究型医院学会麻醉学专业委员会常委;中国药理学会麻醉药理专业委员会常委;中国高等教育学会医学教育专业委员会麻醉学教育研究会理事;中华儿科学会临床药理学组委员;中华麻醉学会小儿麻醉学组副组长;上海市麻醉学会委员、小儿麻醉学组组长;上海市麻醉医师协会委员;哈尔滨市政府特邀专家。Paediatric Anaesthesia 杂志Associate Editor;《国际麻醉学与复苏》、《上海医学》、《儿科药学》等杂志编委;《中华麻醉学杂志》和《临床麻醉学杂志》通讯编委。国家自然科学基金、上海市自然科学基金和中国博士后基金同行评审专家。研究方向为发育与疼痛、发育药理学;研究成果曾获上海市科技进步三等奖(排名No.3)、上海市医学科技进步三等奖(排名No.5)及多项国家、省市级科研目资助,发表文章数十篇。

●感谢您阅读《药学进展》微信平台原创好文,也欢迎各位读者转载、引用。本文选自《药学进展》2017年第5期。
●《药学进展》是一本专注于医药领域前沿动态的专业媒体,月刊,铜版纸全彩印刷,全年360元,欢迎订阅!编辑部官网:www.cpupps.cn;电话:025-83271227。
















