中国科学院遗传与发育生物学研究所等机构使用
CRISPR/Cas9
编辑技术在食蟹猴胚胎中打靶
SHANK3
基因,获得了三只带有
SHANK3
基因突变的食蟹猴后代。
►
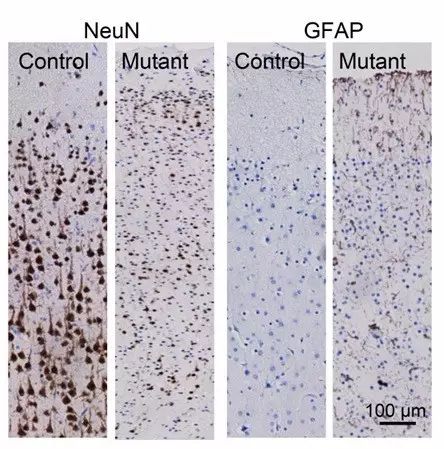
SHANK3缺失导致猴脑皮层发育异常,神经元数目减少,胞体变小,星形胶质细胞增多。
自闭症谱系障碍
(autism spectrum disorders, ASD)
儿童表现出社交障碍,刻板重复行为和兴趣狭隘等行为学特征。流行病学研究表明世界范围内大约
1%
的儿童表现有
ASD
。大量基础研究使用遗传修饰小鼠深入分析
ASD
的病理学机制。然而,小鼠和人类在大脑结构和行为学特征上存在巨大差异,严重影响小鼠模型研究的临床转化价值。因此有必要开发相应的
ASD
非人灵长类模型,促进基础研究成果的临床转化。
SHANK3
基因突变在
ASD
病人中出现频率最高,是目前国际上公认的几个
ASD
高发致病基因之一。中国科学院遗传与发育生物学研究所张永清研究组、李晓江研究组,美国杜克大学医学院姜永辉教授团队和华中科技大学鲁友明教授团队,以及广州元㬢生物科技有限公司密切合作,使用
CRISPR/Cas9
编辑技术在食蟹猴胚胎中打靶
SHANK3
基因,制备基因突变猴后代,最终获得了三只带有
SHANK3
基因突变的食蟹猴后代。
SHANK3
完全缺失导致一些突触后电子致密区蛋白如
GluN2B, PSD95
和
mGluR5
显著下调,以及
Homer1b/c
的异常亚细胞定位。在负责高级认知功能和社交行为的大脑前额叶区域,他们发现突变猴的成熟神经元数目显著降低,而星形胶质细胞显著增加。突变猴的前额叶皮层神经元的树突棘密度也显著降低。由于
SHANK3
缺失的小鼠模型未表现出上述病理变化,这些结果表明
SHANK3
特异性调控灵长类胚胎大脑发育。
ASD
基因是否和如何影响大脑发育是
ASD
领域关注的重大科学问题。之前的研究由于人脑材料样本的限制不能直接回答特定
ASD
基因是否影响人的大脑发育。
本项研究为我们理解
ASD
的神经病理发生机制提供了新的视野,也揭示了非人灵长类动物模型在研究
ASD
病理机制中的重要性和必要性。
该研究于
2017
年





