
瓣膜性心脏病(VHD)是一种危及生命且日益严重的问题,随着人口老龄化而加剧。由于目前没有药物可以改善原生瓣膜的功能障碍,因此使用机械心脏瓣膜(MHVs)或生物瓣膜(BHVs)进行瓣膜置换是拯救这些重症患者生命的唯一希望。近年来,由猪或牛心包制成的BHVs因其更好的生物相容性、改善的血流动力学性能以及无需长期抗凝治疗而优于金属MHVs。然而,结构瓣膜退化(SVD)的发生——一个由钙化和瓣叶退化(撕裂或断裂)等多因素过程所体现的现象,正限制着BHVs的耐用性。SVD的确切机制尚未完全揭示,但人们已经认识到,凝血的积累以及蛋白质和细胞等循环宿主因子的不规范浸润在其中起着核心作用。此外,BHVs的恶化是不可逆且难以干预的,对于年轻患者来说,通常需要进行二次、高风险的瓣膜置换手术。生物假体心脏瓣膜(BHV)用于经导管置换时,常因血栓、炎症和钙化而面临不可逆的退化。
来自浙江大学医学院的 Jian'an Wang等团队
提出了一种多维度模仿内皮的可愈合水凝胶防护BHV,它不仅能承受复杂的瓣膜生理和血流动力学环境,还能通过原位愈合逆转损伤诱导的结构退化。具有光热效应的聚多巴胺/硒胱胺纳米粒子被嵌入到涂覆在BHV表面的聚乙烯醇水凝胶中,以实现光触发愈合和催化亚硝酸盐生成。此外,血小板抑制剂替罗非班被包裹在水凝胶防护层中,以阻止植入后早期急性凝血级联反应。开发了一种大鼠血管内瓣膜样植入模型,以揭示BHV在腹主动脉中的长期血液相容性。防护后的BHV表现出增强的抗血栓性能、减少的炎症、更好的内皮化以及改善的血管通畅度。转录组分析表明,防护后的BHV具有更好的内皮功能。而且,模仿内皮的水凝胶防护层在愈合后保持了机械性能和生物功能,促进了良好的血液相容性和快速的再内皮化。总的来说,这种多维度模仿内皮的策略为预防和逆转BHV损伤提供了新的思路,而非仅仅依赖更换。相关工作以题为
“An Endothelium-Mimicking, Healable Hydrogel Shield for Bioprosthetic Heart Valve with Enhanced Intravascular Biocompatibility”
的文章发表在2025年01月15日的期刊
《Advanced Functional Materials》
。

1.创新型研究内容
为实现用于内皮模仿的一氧化氮(NO)释放可愈合水凝胶防护层,本文开发了由聚多巴胺(PDA)/硒胱胺纳米粒子增强、嵌入替罗非班的聚乙烯醇(PVA)水凝胶涂层,该涂层集成在单宁酸(TA)交联的猪心包(PP)上,形成生物假体心脏瓣膜(图1)。PVA已被证明具有生物安全性和出色的抗污性能,已应用于许多临床使用的医疗设备中。本文使用PVA作为亲水层,确保其提供适当的强度。PDA纳米粒子(NPs)在近红外光(NIR)下具有强烈的光热效应,使涂层具有可由光触发的修复能力。TA是一种无毒的、来源于植物的多酚,以其天然抗氧化特性而闻名。由于其分子结构中含有25个酚羟基,TA提供了丰富的结合位点,使其适用于各种应用。几项研究强调了TA作为戊二醛交联BHV的有前景的替代方案。因此,TA不仅与PP中的蛋白质链交联,还与PVA和PDA NPs形成了强氢键,确保了水凝胶与PP之间的强结合。此外,TA和PDA NPs的多酚结构能够淬灭VHD病理环境中的活性氧化物(ROS),并有利于内皮功能。硒胱胺(SeCA)通过氨基与儿茶酚之间的反应稳定地固定在PDA NPs内,触发新鲜血液中内源性NO载体RSNO的分解。作为整合素αIIbβ3的抑制剂,血小板表面高度表达的一种受体(每个血小板上有60,000到80,000个受体),替罗非班抑制血小板与纤维蛋白原结合,临床上显示出显著的抗活化和聚集效果。
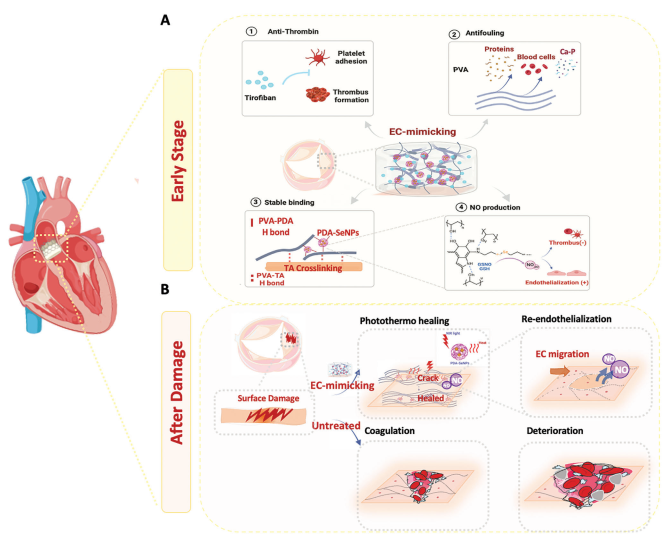
图1 PPs植入后早期和晚期的功能性及生物学反应
【Ti-PVA@PDA-Se@TA PPs的制备与表征】
本文采用“一锅法”合成了Ti-PVA@PDA-Se@TA PPs,如图1所示。通过扫描电子显微镜(SEM)对PPs的表面和横截面形态进行了评估。从图2A可以看出,Ti-PVA@PDA-Se@TA、PVA@PDA-Se@TA和PVA@TA组的PPs的胶原纤维覆盖了一层多孔结构,表明存在PVA水凝胶层。从放大的图像来看,PDA纳米粒子嵌入PPs表面,呈现出球形结构,平均直径小于300纳米。相比之下,TA和戊二醛(GLUT)组的胶原纤维清晰可见,没有水凝胶层的保护,它们可能会直接暴露于外部变化中。能谱仪(EDS)的结果证实了Ti-PVA@PDA-Se@TA和PVA@PDA-Se@TA组中硒元素的存在,表明SeCA已成功偶联到PPs上(图2B)。
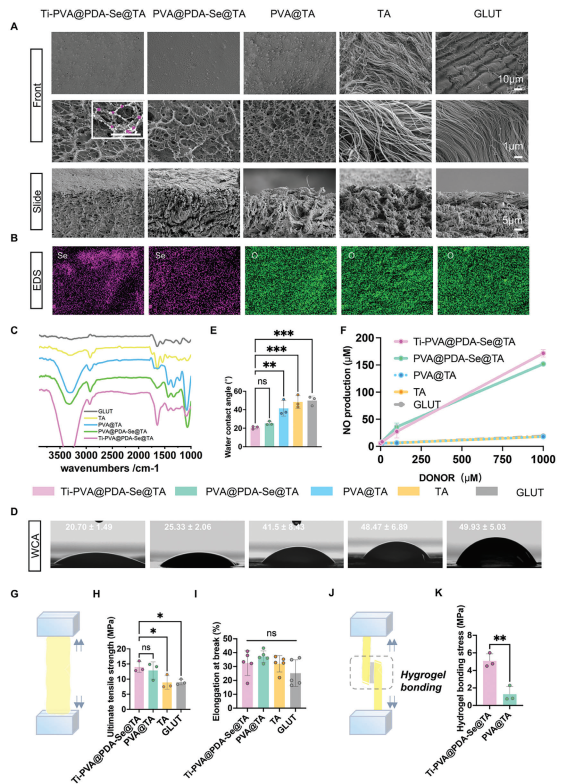
图2 PPs的结构、功能和机械特性表征
【NIR触发的愈合性能】
机械损伤和钙化是GLUT固定心包瓣膜(GLUT-fixed pericardial leaflets)的主要早期失效模式。心脏瓣膜在复杂的流体动力学条件下运行,承受着显著的剪切应力、弯曲变形和瓣膜张力。然而,由于缺乏自我修复能力,生物人工心脏瓣膜(BHVs)比原生瓣膜更容易发生机械降解。为了评估Ti-PVA@PDA-Se@TA PPs的NIR触发愈合性能,在PPs的中心制造了一个人为划痕,其长度为1毫米,宽度小于0.05毫米,深度为0.1毫米(图3A)。从光学显微镜下观察,随着NIR暴露时间的增加直至30秒,划痕的大小显著减小(图3B)。
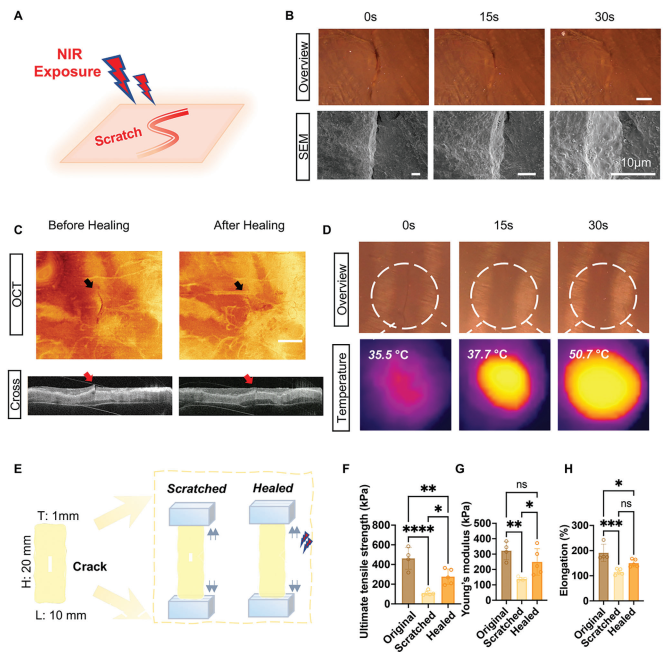
图3 近红外(NIR)触发的自修复性能评估
【Ti-PVA@PDA-Se@TA PPs的抗凝血性能】
血栓的形成被认为对早期BHV(血液接触设备,如血管支架等)增厚和钙化构成潜在威胁。因此,抑制血栓形成作为满足BHVs血液相容性关键需求的重要防线具有重要意义。本文首先进行了溶血试验,以检验不同修饰的PPs作为BHV材料的可行性。发现几乎无溶血发生,远低于相关标准2%。接着进行了体外抗血栓性能评估,结果显示在GLUT组和TA组的PPs暴露的胶原纤维上出现了大量血栓(图4A、B)。而在经过PVA水凝胶修饰后,由于PVA涂层的抗污染作用,PPs上的血栓粘附显著减少。在Ti-PVA@PDA-Se@TA组和PVA@PDA-Se@TA组中,血栓粘附量急剧下降,这得益于PDA-Se纳米粒子中的二硒键催化内源性一氧化氮供体GSNO产生抗血小板信号分子一氧化氮(NO)。
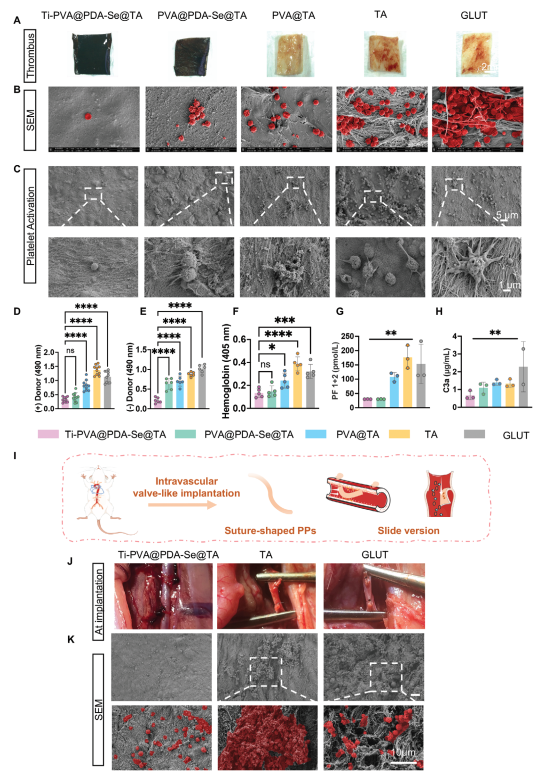
图4 PPs的抗血栓形成性能评估
【抗炎评估】
所有可植入的生物材料不可避免地会触发异物免疫反应,这些反应主要由巨噬细胞和异物巨细胞介导的炎症反应所驱动。这些反应的特征是激活的炎症细胞粘附和迁移到材料表面,以及这些活性炎症细胞在周围组织中产生活性氧物质(ROS)和氮物质。因此,本文使用人单核白血病细胞系(THP-1)来检查PPs上巨噬细胞的粘附和极化,以评估它们在生物人工心脏瓣膜(BHV)应用中的抗炎能力和可行性。脂多糖(LPS)和白细胞介素-4(IL-4)分别用于诱导M1和M2极化,作为阳性对照(图5A、B)。GLUT组和TA组显示出明显的DiD标记的THP-1细胞粘附和iNOS阳性细胞(图5C)。与TA组和GLUT PPs相比,PVA@TA组的粘附显著减少,再次证实了防污PVA水凝胶涂层的有益效果。在Ti-PVA@PDA-Se@TA组和PVA@PDA-Se@TA组中观察到更显著的抑制作用:与其他组相比,巨噬细胞的粘附和促炎细胞因子肿瘤坏死因子-α(TNF-α)的表达均显著降低(图5D),这表明NO释放与防污涂层结合在抑制炎症反应方面的有益效果。然而,各组间抗炎细胞因子IL-10的表达水平并无显著差异(图5E),这主要归因于Ti-PVA@PDA-Se@TA组和PVA@PDA-Se@TA组中巨噬细胞的粘附有限,使得差异不太明显。总体而言,上述结果均表明Ti-PVA@PDA-Se@TA涂层能够抑制急性炎症阶段的初始M1极化,同时显著有利于细胞微环境的积极重塑。
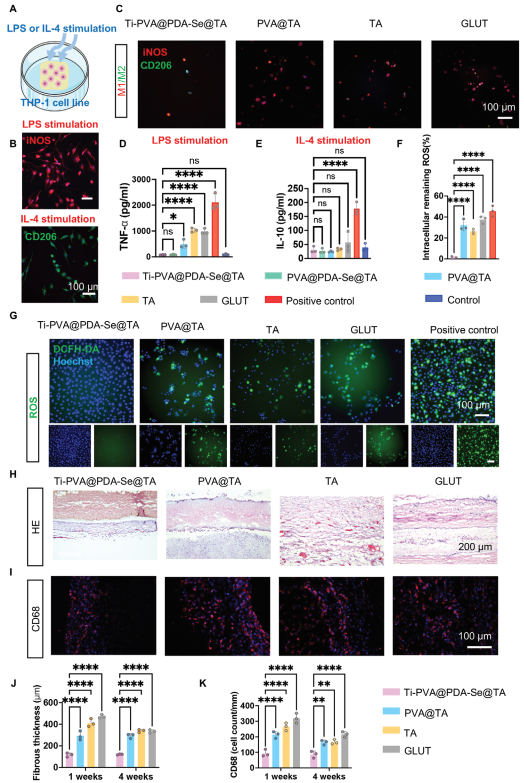
图5 抗炎性能评估
【血管内植入模型中炎症的评估】
将血液接触设备(BHVs)植入血管后,BHVs会暴露于血流中,血栓沉积以及循环单核细胞/巨噬细胞的浸润可能导致PP材料发生重塑,进而导致快速形成增厚的纤维包囊。通过苏木精-伊红(HE)染色和马松染色(图6A)展示了PPs周围形成的纤维包囊厚度。结果显示,与GLUT组和TA组相比,Ti-PVA@PDA-Se@TA组PPs周围纤维包囊的厚度分别减少了27%和40%(图6B)。此外,通过免疫荧光染色对巨噬细胞特异性标志物CD86(M1型巨噬细胞)和CD206(M2型巨噬细胞)进行评估,以分析炎症细胞浸润情况。免疫荧光和定量分析结果表明,在植入3周后,与TA组和GLUT组相比,Ti-PVA@PDA-Se@TA组PPs中的CD86+巨噬细胞浸润减少,这表明本文的修饰方法与TA组和GLUT组相比没有加重巨噬细胞浸润(图6C、D)。然而,在植入3周后,Ti-PVA@PDA-Se@TA组无论是在管腔内PPs部位还是血管部位,都有更多的M2型巨噬细胞浸润(图6E、F),这表明涂层对M2型巨噬细胞极化具有整体有益效果,并改善了利于组织再生的免疫微环境。此外,主要器官的苏木精-伊红(H&E)染色显示,植入后器官无明显系统性毒性或损伤。
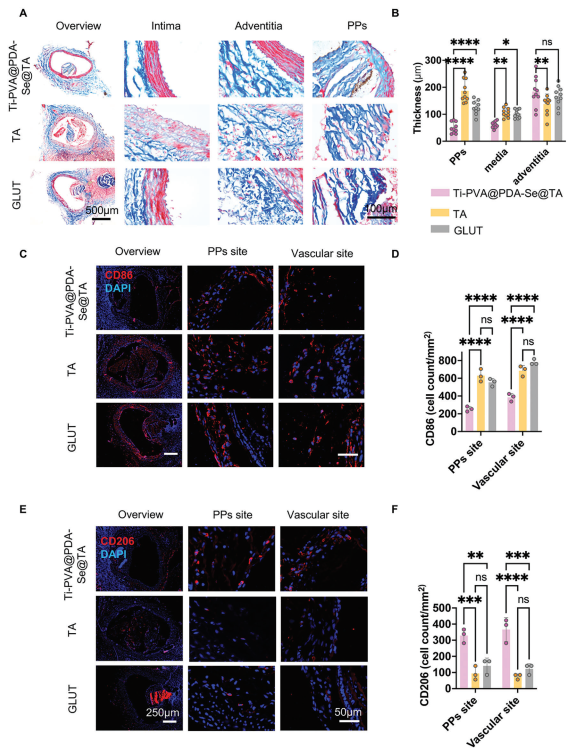
图6 血管内植入模型中炎症的评估
【Ti-PVA@PDA-Se@TA PPs的内皮化】
内皮化是血液接触生物材料功能的理想形式,可防止血栓形成并保持移植物通畅。因此,本文评估了类内皮涂层对ECs和SMCs的粘附、增殖和/或迁移的生物效应,因为这些细胞在内皮化过程中起主要作用。首先检查了HUVECs和SMCs在每组PPs上的粘附情况。结果表明,在NO供体存在的情况下培养48小时后,Ti-PVA@PDA-Se@TA PPs上HUVECs的增殖增强,并形成了融合的细胞层(图7A、C),而在没有供体的情况下,HUVEC的生长行为没有显著变化。与HUVECs相反,在有NO供体补充的情况下,Ti-PVA@PDA-Se@TA组中SMCs的粘附受到显著抑制(图7B、D)。然而,无论是否补充NO供体,GLUT、TA和PVA@TA PPs上HUVEC的增殖以及SMCs的抑制都明显受到阻碍,与Ti-PVA@PDA-Se@TA PPs相比。这种现象的原因可能是PVA和外来植入物不适合内皮细胞的生长和增殖,但通过添加SeCA来实现NO释放涂层巧妙地解决了这个问题。此外,还观察到,粘附的内皮细胞不仅显示出良好的细胞活力(93.75% ± 2.18%),而且还保持了内皮的重要生物学特性,如紧密的细胞连接标记zonula occludens-1(ZO-1),在Ti-PVA@PDA-Se@TA PPs上的HUVECs之间表达(图7E)。
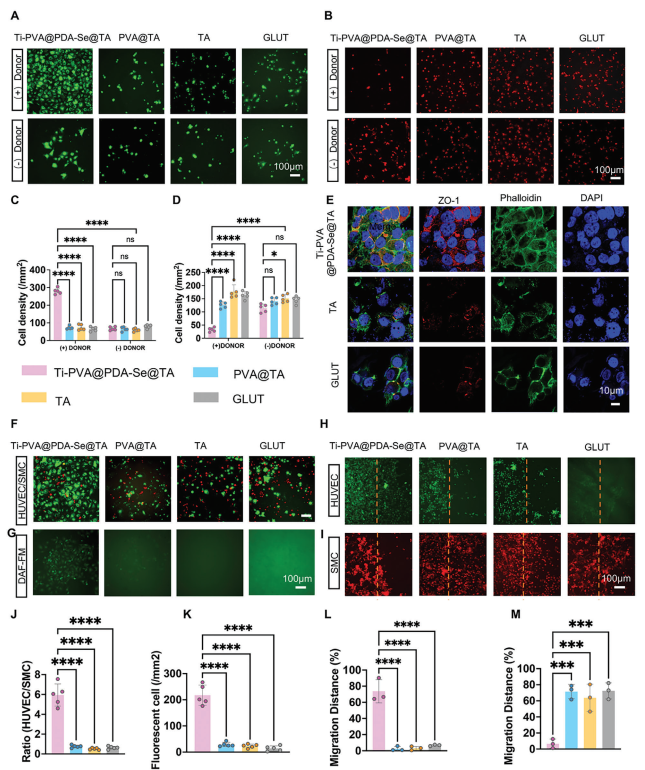
图7 PPs的体外内皮化性能
【对在PPs上培养的人主动脉内皮细胞(HAECs)进行转录组分析】
通过转录组测序分析进一步阐明了Ti-PVA@PDA-Se@TA对内皮细胞促进作用的潜在机制。主成分分析结果表明,组内重复性良好,组间差异明显(图S10A、B,支持信息)。基于|log2FC| > 2和P < 0.05的标准,各组之间差异表达基因的数量如图8A所示。其中,与GLUT组相比,Ti-PVA@PDA-Se@TA PPs上调了613个基因,下调了2567个基因(图8B)。基因本体(GO)数据库分析结果表明,与GLUT组相比,Ti-PVA@PDA-Se@TA PPs主要通过生物合成、氮化合物代谢、细胞增殖、迁移和粘附以及氧化应激反应等过程调节内皮细胞功能(图8C)。因此,本文通过GO分类对细胞增殖、粘附、迁移以及氧化应激调节等相关的差异基因进行了特异性分析。关于细胞增殖的结果显示,Ti-PVA@PDA-Se@TA PPs上调了内皮细胞中促进细胞增殖的基因(如SIPA1L3、SIPA1L2、SIPA1L1、BTG1、MKI67)的表达,以促进细胞粘附和增殖。此外,与GLUT组相比,Ti-PVA@PDA-Se@TA PPs下调了与不良细胞生长和肿瘤增殖相关的基因(如URGCP、PA2G4、BTG2、SIPA1和PPDPF)的表达(图8D)。对细胞粘附相关基因的分析表明,Ti-PVA@PDA-Se@TA PPs上调了与促进细胞粘附、细胞间相互作用以及细胞外基质功能相关的基因(如CDON、ANTXR2、ALCAM和BCAM),从而促进内皮细胞粘附和细胞间完整性的建立(图8E)。
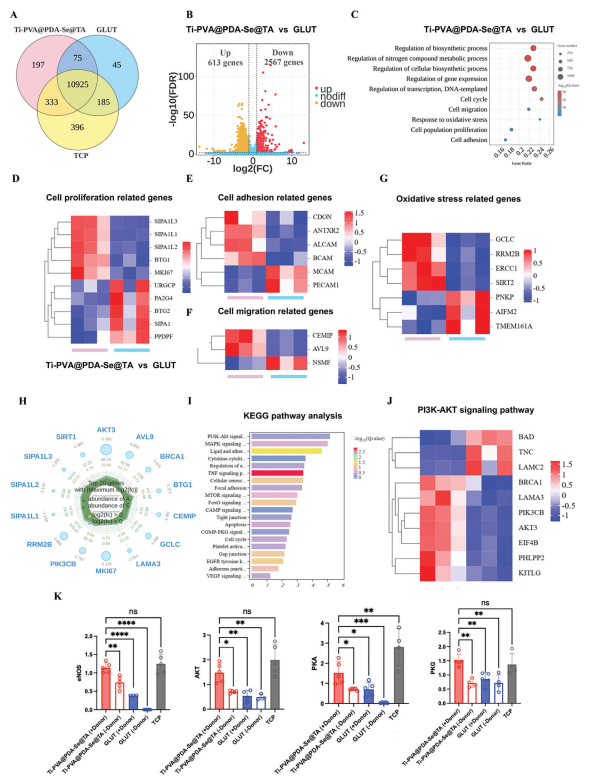
图8 在PPs上培养的HAECs的转录组分析
【体内内皮化】
在血管内植入物中,当前生物人工心脏瓣膜(BHVs)的合理重要要求是更快的内皮化,以防止长期血栓形成并有助于防止钙沉积。为进一步评估产生NO的PPs的内皮化效果,对CD31和eNOS进行了免疫荧光分析。结果表明,Ti-PVA@PDA-Se@TA组的PPs与CD31和eNOS阳性的ECs良好粘附(图9A、C),这些细胞在植入后3周沿管腔侧伸长并排列形成完整的单层。尽管TA组和GLUT组也显示出一层细胞覆盖,但这些细胞与内皮形态不一致,且不表达或不与eNOS共定位。血栓形成的抑制、钙化和增生性胶囊形成的减少以及内皮化的改善最终可以导致带有瓣膜状植入物的血管具有更好的血流动力学功能。在植入1周和3周后,通过超声心动图检查了植入PPs的主动脉的血流动力学条件(图9B、D),GLUT组、TA组和Ti-PVA@PDA-Se@TA组的通畅率分别为56%、40%和62%。Ti-PVA@PDA-Se@TA组的血流速度是TA组和GLUT组的1.56倍和1.16倍,表明Ti-PVA@PDA-Se@TA组的增生性重塑和阻塞较少。
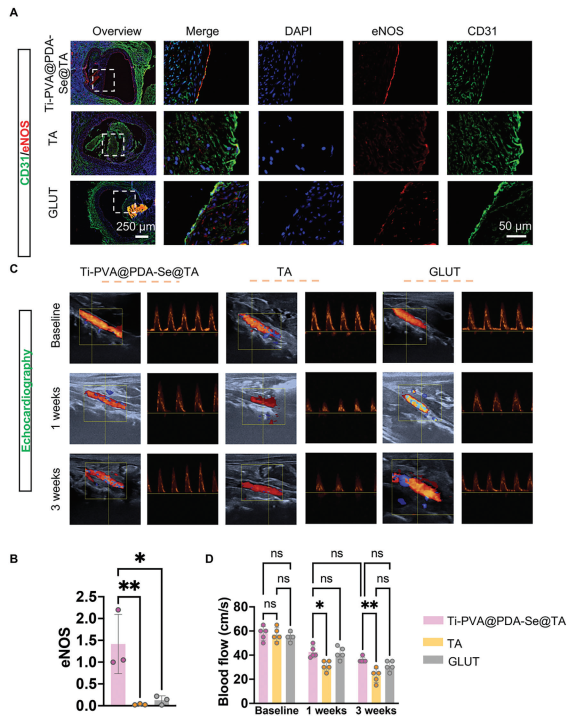
图9 PPs的体内内皮化及血流动力学性能评估
【近红外(NIR)触发愈合后的生物功能】
心脏瓣膜在患者一生中要经历十亿次的开闭循环。之前有报道显示,经过戊二醛处理的生物人工心脏瓣膜(BHVs)早在2000万次循环后就出现了胶原纤维损伤,这相当于体内瓣膜手术6个月的情况。BHVs无法进行细胞外基质(ECM)再生和重塑,胶原网格的任何变化(例如分层、结构重排和破坏)都是不可逆的。因此,为了解决这些问题,本文采用的具有原位修复能力的涂层策略可以提供重要的洞见和承诺,将损伤转化为可逆过程,并以最小的代价消除恶化过程。结构的恢复不足以维持BHVs的血液相容性,所以,进一步评估了修复后PPs的生物功能,包括抗血栓形成、钙化和内皮化(图10A)。本文比较了两组之间的抗血栓形成性能。从血小板粘附的结果显示,在水凝胶覆盖和表面结构完整的区域,只观察到少量血小板;但在划痕区域,抗凝效果完全改变,表现为大量血小板渗入裂缝侧面并暴露出下方的胶原纤维。而在PPs修复组中,由于对胶原纤维恢复了保护和覆盖,这种现象得到了逆转(图10B)。为了进一步研究涂层修复如何影响BHVs的钙化,将有划痕和修复后的PPs置于钙化介质中,通过SEM和EDSMapping可视化和测量生成的钙沉积和百分比。结果表明,钙主要位于有划痕PPs的断裂部位(图10C)。这与之前的假设一致,即断裂和磨损的胶原纤维在划痕处暴露的纤维区域提供了钙的结合位点。
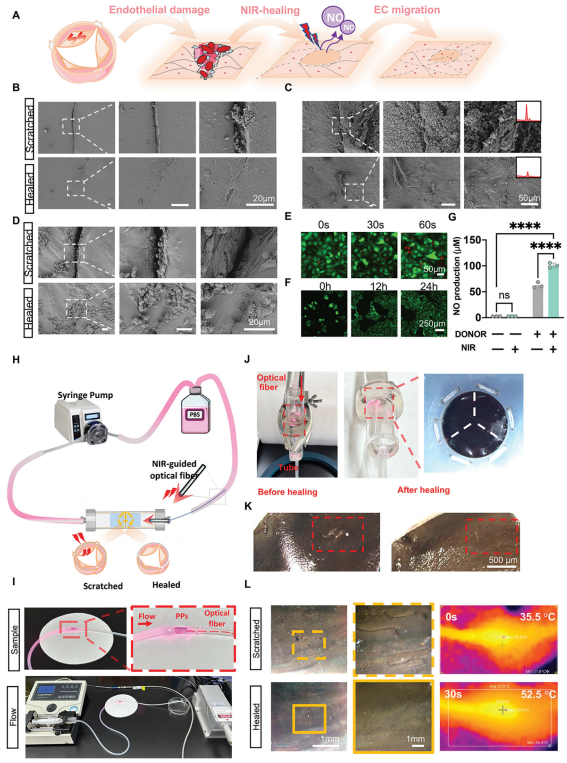
图10 近红外(NIR)触发的自修复后的生物功能评估
【总结与展望】
总的来说,本文开发了一种多尺度模仿内皮的策略来装备BHV。具有被动和主动抗血栓特性的增强型可修复水凝胶防护层,实现了高效的抗血栓、抗钙化以及体外和体内的显著内皮化功能。此外,本文开发了血管内瓣膜样植入模型,并且本文的设计在植入3周后表现出良好的功能,包括更好的通畅度、抗血栓性和内皮化。此外,BHV上可愈合且坚韧的水凝胶防护层实现了原位损伤修复,同时保持了显著的机械性能和血液相容性。总体而言,具有优异且可调的生物和机械特性的Ti-PVA@PDA-Se@TA PPs是下一代人工心脏瓣膜应用的有前景的候选者,有望实现更长的使用寿命。
参考资料:
https://doi.org/10.1002/adfm.202420683
来源:EngineeringForLife
声明:仅代表作者个人观点,作者水平有限,如有不科学之处,请在下方留言指正!






