高清无码
天天送
!!!
由
爱好摄影
的
CPM
每日分享!!!
HGRAC(Human Genetic Resource Administrationof China)
,即国家人类遗传资源管理,相关申报是近
1
年多以来在临床试验领域的一个新生事物,说明国家对于人类遗传资源的管理更加严格、规范。
目前根据相关法规要求,
凡是外资、合资企业参与、接触到标本、样本、数据的处理或管理的临床研究项目,都需要经过人类遗传资源管理审批;
因而这一环节成为外资相关临床研究的一个必要流程,也成为影响项目启动进度的重要环节之一。从事临床研究的同行们有必要对这一环节有所了解,而参与这一环节的同行们更应清楚其具体流程和要求。
法规要求及程序等之前已经有多篇文章介绍和阐述,根据近期申报经验,在此予以更新和补充。
最新的
《服务指南》、“办理流程”
和相关审批的
“常见问题”
解读可以参考网站“办事服务”区详细说明:
http://www.most.gov.cn/bszn/new/rlyc/syfw/index.htm
其中《指南》对
HGRAC
管理的适用范围、内容、企业性质、主体要求等有详细阐述。
1998
年法规及
2016
年新法规征求意见稿
其中新法规征求意见稿根据现状作了修订和补充,待审批颁布。后面将做简单介绍。
除《指南》及网站提示的官方申报流程,在实际操作中,需要了解各申报单位(研究中心)的相关人员、内部关系、行政流程等具体情况,梳理和优化完成申请的高效流程。
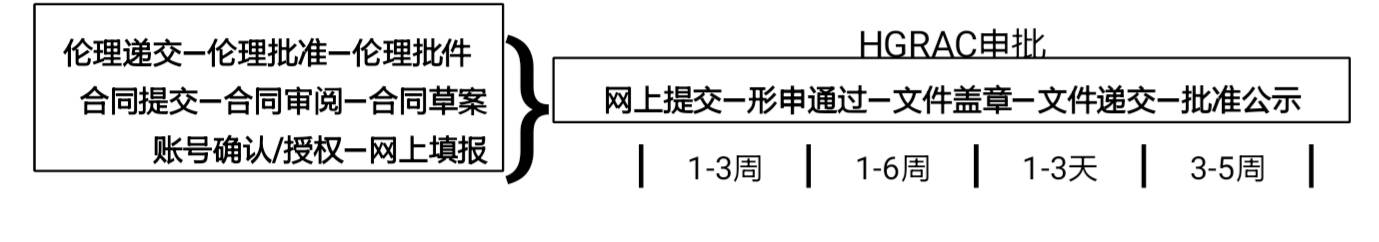
文件准备及申报流程示意图:
确认中心申报意愿
与研究中心机构或科研管理部门(科技处、科教科等)沟通,说明申报必要性及法规要求,确认中心申报意愿。
提示:作为临床研究开展的许可条件之一,各参与研究的中心有责任进行申报。各中心可独立申报,为利于研究整体进度规划,最好每中心都能牵头申报。
协助获得申报账号授权
确认申报单位账号可用并联系
单位管理员
,请其为所需申报的项目
创建申报人账号并授权
。
协助准备申报所需材料,在线填写申请书
按照《指南》要求准备所需材料,根据伦理、合同等审核进度,由申报人提前在申报系统内填写申请信息。在伦理上会后即完成填写,收到伦理批件即可上传所有文件。
网上提交,跟踪至形申通过
网上申请填完、上传要求文件后申报人在系统内提交至单位管理员,由单位管理员在系统内提交至科技部,完成网上提交。科技部将在
5
个工作日内完成形式审查,并提供反馈意见。
提交后定期登录系统查看状态,如有反馈修改意见须及时修改并再次提交,有疑问可以直接电话咨询科技部。网上审查合格后将显示
形申通过
,说明已网上受理。
获得申报单位及上级主管部门盖章,提交文件
公示批准后将公示信息告知相关中心,凭合同复件去科技部取得
HGRAC
批件原件(取件时需给所有备案文件盖章,应预留足够时间)。
跟踪审批进度,获得批准信息
盖章后的文件送交科技部,
5
个工作日内将收到电子版受理单。
根据科技部审查会议计划(约每月倒数第
1
、
3
周周一会审)及最新公示时间,
2-3
周后定期查询审批结果公示情况。
签署合同,获得批件
公示批准后将公示信息告知相关中心,凭合同复件去科技部取得
HGRAC
批件原件(取件时需给所有备案文件盖章,应预留足够时间)。
虽然该申请主体为研究中心,但真正推进者为
CRA
(申办方代表),
CRA
及相关人员应详细计划、充分准备;主动咨询、借鉴经验;及时反馈、提前沟通;密切联系、推动进度。
落实责任:
因
HGRAC
申请流程涉及多方人员,如协调不好容易耗费较长时间;需向
CRA
明确可以加速推进的环节(文件交至科技部前),提前熟悉流程,协调各方准备,提高效率。
分批计划
:目前仅有少数中心愿意牵头申请,多中心研究需要
预先了解各中心牵头意愿,根据能够牵头的中心伦理、合同等审核进度,制定周密、灵活的分批申报计划
,以争取尽快完成这一工作。
联动推进
:因该申请需提交协议草案,可以据此要求与各中心争取早日审阅合同,在伦理批准后即获得初步审阅意见,并与伦理批件一起提交
HGRAC
申请,从而推动合同审阅进度。
HGRAC
申请文件提交后即可开始合同的签署流程,同时为研究中心启动做准备。
因为
HGRAC
申请对于多数机构、部分科研部门属于新流程,中心相关人员并不清楚其具体流程、环节、要求及责任等情况,很多中心出于对工作量或不明风险的担忧,对该申请持消极态度,不愿自主申报、更不愿牵头申报。
CRA
应说明具体流程及工作内容、打消其顾虑,明确该申报是所有中心参与研究的必须流程,并提示牵头申报给
PI
及机构带来的切实益处,如可提高该中心及
PI
知名度、吸引申办方关注、获得更多外企优质项目等。
因该申报为行政审批流程,原则上不应收费。
CRA
应与研究中心明确这一原则,如有收费要求需与申办方协商解决。
法规对申报主体定义较明确,项目负责人、填报人应属申报单位。实际操作中可能因所授权的研究者工作繁忙,需要
CRA/CRC
指导、协助填报。
CRA/CRC
应熟悉申报流程和要求,及时予以支持。
因附加文件多数有相关盖章,网上受理后仅在受理的申请书上盖章(同时签署意见)即可。如果医院盖章方便也可以在其他文件上加盖公章。
原则上在实施相关人类遗传资源操作前需得到批准,实际操作中在获得批准公示后启动中心即可(批准后才会在网站公示)。
该类审批不确定因素多,每年批准的项目极其有限,除遵循以上相关流程外,需做特别确认。
●
明确所管理对象为人类遗传资源采集、收集、国际合作、出境等活动。
●
对采集、收集、国际合作定义做了进一步明确。将《指南》中归入“收集”的“
国际合作
”独立出来并明确定义:“本条例所称国际合作是指有境外机构或境内的外资独资或中外合资机构参与的人类遗传资源研究开发活动。”
●
对“采集和收集”和“国际合作和出境”两类活动分别做规定和要求。
●
删除《暂行办法》中对国际合作须“经审核批准后方可正式签约”的要求。
●
省、自治区、直辖市科学技术行政部门及县级以上地方各级人民政府有关部门参与本地区人类遗传资源管理,但审批决策仍由国务院科学技术行政部门发布。(取消
12
年版拟由省级人民政府科学技术行政主管部门审批的建议)
●
采集和收集:
要求开展单位具有负责人类遗传资源管理的部门,并制定具体的管理制度。须提供“采集和收集活动所需人员、场所、设施设备及经费来源等的证明材料”(第九、十一、十二条)
●
国际合作:
第十八条
申请开展人类遗传资源的国际合作和出境活动,应由中方和外方合作单位共同提交以下材料:(六)拟研究开发和出境的人类遗传资源的来源合法证明材料;
——以上何种证明材料待确认。
(以上法规公告可点击阅读原文查看)
投稿邮箱:[email protected]

有想法,请留言





