Piet Ost, Dries Reynders, Karel Decaestecker, Val ́erie Fonteyne, NicolaasLumen, Aur ́elie De Bruycker, Bieke Lambert, Louke Delrue, Ren ́ee Bultijnck,Tom Claeys, Els Goetghebeur, Geert Villeirs, Kathia De Man, Filip Ameye, IgnaceBilliet, Steven Joniau, Friedl Vanhaverbeke, and Gert De Meerleer
本刊负责人:张绪超 广东省人民医院
审校:王弘恺 复旦大学附属肿瘤医院
翻译:佟冰 北京协和医院
摘要
目的
:相关回顾性研究报道转移灶定向疗法(metastasis-directed therapy, MDT)可以提高寡转移复发
性前列腺癌患者的无进展生存期。本研究旨在通过一项随机II期临床研究对MDT的疗效进行评估。
研究对象与方法
:
该前瞻性、随机、多中心Ⅱ期临床试验的研究对象为无症状前列腺癌患者,所纳入患者既往接受过原发灶前列腺癌根治性治疗且出现生化复发,经胆碱PET-CT证实≤3处颅外转移灶,以及血清睾酮水平>50 ng/mL。按1︰1的比例将受试者随机分为主动监测组和MDT组。MDT组中,所有检测到的病灶行手术治疗或立体定向放疗。主动监测组中,每3个月复查前列腺特异抗原(prostate-specific antigen,PSA),若出现PSA进展或可疑临床进展,需行影像学检查。随机分配后患者在两个因素的基础上进行亚组分层:PSA倍增时间(≤ 3个月 vs > 3个月)和淋巴结状态(转移 vs 无转移)。主要研究终点是无雄激素剥脱治疗(androgen deprivation therapy,ADT)生存期。患者出现临床症状进展,出现3个以上的转移灶,或者已知转移灶出现局部进展时,开始ADT治疗。
结果
:
2012年8月至2015年8月,本研究共纳入62例患者,并对其进行了中位3年(IQR:2.3-3.75年)的随访。主动监测组患者中位无ADT生存期为13个月(80% CI,12-17个月),MDT组为21个月(80% CI,14-29个月),两组之间差异显著(HR 0.60,80% CI 0.40-0.90;log-rank
P
= 0.11)。两组患者在基线时的生活质量相似,在3个月、1年时仍无显著差异。MDT组有6例患者出现1级不良反应。未观察到2-5级不良反应。
结论
:
与仅进行主动监测相比,MDT可以明显提高寡转移复发性前列腺癌患者的无ADT生存期,值得开展III期临床研究以进一步验证。
概述
即刻或延迟雄激素剥脱治疗(androgen deprivation therapy,ADT)加初始监测是根治性前列腺切除术±放疗后出现生化复发的前列腺癌(prostate cancer,PCa)患者首选的治疗策略
[1,2]
。
前列腺癌初始治疗后复发模式相关分析显示,大多数患者复发时伴有三个或更少部位转移,即寡转移
[3-5]
。
1995年,Hellman和Weichselbaum
[6]
提出采用转移灶定向疗法(metastasis-directedtherapy,MDT)清除寡转移灶有可能阻止肿瘤继续转移扩散,进而提高生存期
[7-8]
。
如果这一假设得到证实,将使部分转移性前列腺癌患者的治疗现状由姑息为主改变为潜在可治愈。数个回顾性单臂研究表明,MDT可以延缓其他转移灶的临床进展,延迟进展后姑息性ADT的开始时间,且不良反应极少
[9,10]
。然而,MDT的这种治疗优势尚未进行严格的随机对照研究。对此,我们纳入存在≤3个转移灶的寡复发性前列腺癌患者,对其接受MDT或主动监测(标准治疗)后的ADT开始时间进行了对比分析。
研究对象与方法
研究设计与受试者:
本研究为多中心、随机、II期临床研究,由比利时根特大学附属医院伦理委员会审核同意。入组患者来自六个比利时医疗机构。入组标准:经病理确诊;接受根治性治疗(根治性前列腺切除术,术后放疗,或者两者联合)后出现欧洲泌尿外科学会定义
[2]
的前列腺特异抗原(prostate-specific antigen,PSA)复发的PCa患者;至多三处经胆碱PET-CT发现的颅外转移(任意N1或M1);治疗过且受控的原发肿瘤;WHO体能评分 0-1;愿意签署书面知情同意书。排除标准: 血清睾酮水平<50 ng/mL或有症状性转移;既往接受过MDT;积极系统性治疗(促黄体激素释放激素激动剂,促黄体激素释放激素拮抗剂,抗雄激素,或雌激素)期间出现的PSA复发;既往接受过PCa细胞毒性药物化疗;过去几月内接受过影响PSA水平的药物治疗(如氟康唑,非那雄胺,糖皮质激素等)。即使胆碱PET-CT提示前列腺部位阴性,也必须经多参数磁共振成像或前列腺活检证实阴性。每个转移灶单独计数,最后均计入总数。随机分配前必须有PSA和血清睾酮检测结果。本研究经所有入组机构伦理委员审核同意,所有患者入组前均签署书面知情同意书。
随机分配及设盲:
纳入研究的患者按1:1比例随机分配为主动监测组和MDT组,分配根据随机可变样本数目的排列区块得到的预生成序列进行。随机过程不设盲,受试者及研究者均知晓随机分配结果。数据管理者和数据分析者也知晓两个治疗组情况。随机分配过程中,根据PSA倍增时间(≤ 3个月 vs > 3个月),转移部位(淋巴结转移 vs 无淋巴结转移)再将入组患者分为各亚组。由负责的医生或科研护士入组患者并录入其参数,由另一位的医生专门负责随机分配过程。
研究流程:
主动监测组,患者每3个月进行临床检查和血清PSA水平检测。MDT组,患者接受转移灶切除术或立体定向放疗(stereotactic body radiotherapy,SBRT)以清除所有可见转移灶。MDT组患者治疗后的随访与主动监测组相同。多学科诊疗团队与患者沟通讨论后决定是否选择MDT。外科医生可以根据自身经验自主选择手术方式,但所选择的必须是目前可选的最佳手术方案。优先推荐侵入性小的操作,但非强制性要求。对于盆腔淋巴结转移,接受过扩大盆腔淋巴结清扫(pelvic lymph node dissection,PLND)或盆腔放疗的患者,只清除可疑淋巴结。如果在初始前列腺癌治疗时未施行扩大PLND。推荐真骨盆双侧补救性盆腔淋巴结清扫(salvage pelvic lymphnode dissection,sPLND),同时清除髂骨区内外侧以及闭孔窝区域所有淋巴结及纤维脂肪组织
[11]
。对于其他部位,优先推荐转移灶切除术。对于SBRT,大体肿瘤体积定义为经影像和代谢信息确认的所有可见肿瘤的体积。不因肿瘤微转移增加放疗范围。大体肿瘤体积在计划目标体积基础上增加2到5mm,以减小由器官运动和仪器设置引起的误差。放疗边缘据照射部位而定,距离骨转移病灶边缘2mm, 淋巴结转移灶边缘3mm,其他转移部位边缘5mm。总放射计量为30Gy(最大放射量的80%),分割为3部分进行,每部分>48小时且<96小时。放射野覆盖靶病灶外围(80%剂量,30Gy),达计划目标体积的90%。根据美国医学物理学家协会任务组101建议
[12]
减少风险器官的放射剂量。每次分割放疗期间,治疗前使用锥束CT进行病人参数设置及靶病灶确认。治疗前采用Delta(4) diode arrayphantom系统对所有放疗计划进行剂量验证。
[13]
随机分组后,两组患者每3月据欧洲泌尿外科协会指南
[2]
评估治疗毒性反应及有无PSA进展,直至出现主要终点事件。患者出现PSA进展或症状性进展时需复查胆碱PET-CT。利用欧洲癌症治疗研究组织(European Organization for Research and Treatment of Cancer,EORTC)的生活质量问卷(Quality-of-Life Questionnaire,QLQ)-C30和QLQ-PR25评估患者的健康相关生活质量(health-related quality of life,HRQOL),需在基线、第3月评估,此后每年评估1次。
结局变量:
无ADT生存期定义为由随机分配到姑息性ADT开始或出现任何原因导致的死亡的时间,是本研究的主要结局变量。ADT开始指征包括症状性转移,大于三处转移,基线转移灶局部进展。末次随访时尚未开始ADT的患者按删失处理。由负责治疗的医师自行判断ADT方案。对于MDT治疗后非局部、转移性复发的患者,如果有≤3个新发转移灶,可以再次进行MDT。PSA进展是本研究次要结局变量。PSA进展定义:若基线PSA≥2ng/ml,PSA升高≥25%且≥2ng/ml;若基线PSA<2ng/ml,PSA升高≥25%。单纯PSA进展不是ADT开始治疗指征。转移灶局部进展定义:肿瘤最大径增加≥20%,且绝对值至少增加5mm。胆碱PET-CT提示的可疑病灶,无论大小,均视为靶病灶。骨转移局部进展使用MD安德森癌症中心标准评估
[14]
,即CT提示可测量病灶或边缘不清病灶大小增加≥25%视为进展。
生活质量评分采用EORTC的QLQ-C30及QLQ-PR25进行评估
[15]
。两个量表的分级评分均通过EOCRTC推荐的流程进行
[16]
。MDT组中,使用CTCAE4.0评估毒副反应,手术病人进行Clavien-Dindo分级
[17]
。
统计学分析:
本研究为一项II期随机临床研究,旨在评估主动监测或MDT是否具有进行后续III期临床研究的价值。本研究中预期主动监测组和MDT组的无ADT生存期分别为12个月和24个月,检验效能0.8
[18,19]
。检验样本量根据既往同类型患者的相关回顾性研究决定
[9,20,21]
。风险比(hazard ratio,HR)为0.5。根据以上假设,本研究需在36个月以上的时间里随机入组62个病人,后续随访时间12个月(假设脱落率为5%)。
运用描述性统计方法总结分析两组病人临床特征。采用Kaplan-Meier生存曲线估算主动监测组和MDT组的无ADT生存期,以及各亚组分析。中位随访时间由完整随访时间和不完整随访时间共同计算得出。Cox比例风险回归模型评估无ADT生存期时的HR值。加权 Schoenfeld 残差用于检验拟合模型的比例风险假定。我们发现时间的变化趋势并不会影响协变量的比例风险假设,因此符合等比例风险假设。根据前列腺癌临床试验工作组建议
[22]
描述以PSA为基础的临床预后结果。使用瀑布图分析显示每个病人PSA由基线至第12周的百分比改变,以及治疗后任意时间点出现的PSA的最大降低值。PSA进展时间为随机开始时间至出现进展时间。我们在基线、3个月、1年时计算EORTCQLQ-C30和QLQ-PR25的平均值和标准差。所有分析按意向处理(intention to treat,ITT)分析或符合方案(per protocol,PP)分析进行。采用双边检验,
P
值<0.20有统计学意义。用R系统(www.R-project.org)分析处理数据。
结果
2012年8月1日至2015年8月31日,共随机入组62例患者(图1),患者临床特征见表1,中位随访时间3年(IQR,2.3-3.8年)。MDT的放疗方式为SBRT(n=25), 6例接受手术(5例sPLND,1例肺转移灶切除术)。
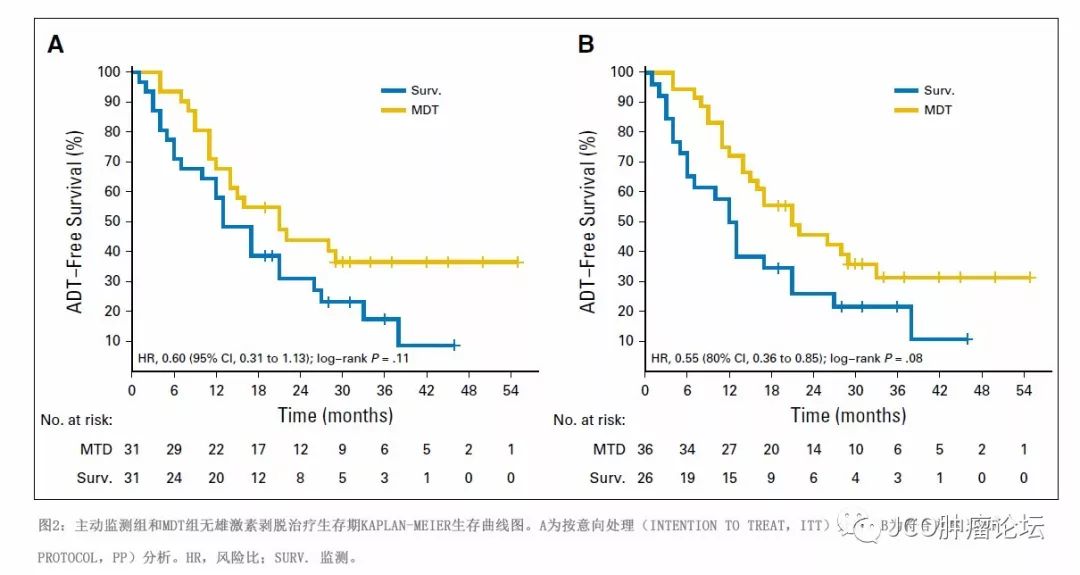
 ITT分析中,主动监测组和MDT组的中位无ADT生存期分别为13个月(80%CI,12-17个月)和21个月(80%CI,14-29个月),风险比为0.60(80%CI,0.40-0.90),log-rank
P
=0.11(图2A)。各种ADT治疗开始指征见表2,其中,多发转移性进展为两组开始ADT的主要原因。MDT组未观察到症状性或局部转移,而主动监测组分别观察到3例症状性转移和6例局部转移。MDT组,11例患者由于首次影像学进展为寡转移而再次接受1程MDT,2例患者由于寡转移接受2程MDT治疗。亚组分析(图3A)显示,MDT疗效与PSA倍增时间(
P
=0.35)以及转移部位(
P
=0.31)之间无相关性。由于主动监测组和MDT组的病灶数量存在差异(见表1), 我们对不同转移数量的各亚组间进行了事后分析。对应HR为0.64(80%CI,0.42-0.96),log-rank
P
=0.16。该结果与转移部位、PSA倍增时间亚组分析结果相一致。11例患者出现去势抵抗性,其中,主动监测组6例,MDT组5例。共4例患者死亡,3例死于其他肿瘤,1例死于心力衰竭。
ITT分析中,主动监测组和MDT组的中位无ADT生存期分别为13个月(80%CI,12-17个月)和21个月(80%CI,14-29个月),风险比为0.60(80%CI,0.40-0.90),log-rank
P
=0.11(图2A)。各种ADT治疗开始指征见表2,其中,多发转移性进展为两组开始ADT的主要原因。MDT组未观察到症状性或局部转移,而主动监测组分别观察到3例症状性转移和6例局部转移。MDT组,11例患者由于首次影像学进展为寡转移而再次接受1程MDT,2例患者由于寡转移接受2程MDT治疗。亚组分析(图3A)显示,MDT疗效与PSA倍增时间(
P
=0.35)以及转移部位(
P
=0.31)之间无相关性。由于主动监测组和MDT组的病灶数量存在差异(见表1), 我们对不同转移数量的各亚组间进行了事后分析。对应HR为0.64(80%CI,0.42-0.96),log-rank
P
=0.16。该结果与转移部位、PSA倍增时间亚组分析结果相一致。11例患者出现去势抵抗性,其中,主动监测组6例,MDT组5例。共4例患者死亡,3例死于其他肿瘤,1例死于心力衰竭。
 PP分析中,主动监测组和MDT组的平均无ADT生存期分别为12个月(80%CI,7-17个月)和21个月(80%CI,16-28个月),风险比为0.55(80%CI,0.36-0.85),log-rank
P
=0.08(图2B)。亚组分析(图3B)中,MDT疗效与转移部位之间未观察到相关性(
P
=0.95)。MDT疗效与PSA倍增时间之间显著相关,即PSA倍增时间≤3个月者的无ADT生存期较PSA倍增时间>3个月者显著提高(
P
=0.01)。
PP分析中,主动监测组和MDT组的平均无ADT生存期分别为12个月(80%CI,7-17个月)和21个月(80%CI,16-28个月),风险比为0.55(80%CI,0.36-0.85),log-rank
P
=0.08(图2B)。亚组分析(图3B)中,MDT疗效与转移部位之间未观察到相关性(
P
=0.95)。MDT疗效与PSA倍增时间之间显著相关,即PSA倍增时间≤3个月者的无ADT生存期较PSA倍增时间>3个月者显著提高(
P
=0.01)。
我们采用瀑布图分析随机后3个月的PSA改变值及其最大改变值(图4A和4B)。MDT组约74%的患者出现PSA降低,而监测组为42%。ITT分析中,主动监测组和MDT组的中位PSA进展时间分别为6个月(80%CI,4-7个月)和10个月(80%CI,8-13个月),风险比为0.53(80% CI,0.37-0.77),log-rank
P
=0.03(图4C)。PP分析中,风险比为0.52(80% CI,0.36-0.76),log-rank
P
=0.02。约75%MDT组患者出现PSA降低,而35%主动监测组患者出现PSA降低。
17%(6/36)的MDT组患者出现1级不良反应。未观察到2级以上不良反应。SBRT后出现的不良反应包括一过性腹泻(n=1)和一过性肌肉酸痛(n=1)。一例在接受电视辅助胸腔镜肺转移灶切除术后出现胸壁痛并服用非阿片类镇痛药6个月。sPLND后出现的不良反应包括生殖股神经感觉减退(n=1),淋巴瘘(n=1),以及阴囊和阴茎水肿(n=1)。
97%(60/62)患者完成基线QLQs调查,55例(89%)在3个月时完成,52例(84%)在1年时完成。图5显示ITT分析中两组在三个不同时间点的全球健康评分情况。我们并未在两组之间观察到HRQOL评分的临床相关性改变(所有随访;数据见附录)。总之,两组的HRQOL评分在基线,第3月,第1年时均保持稳定(数据见附录)。

讨论
据我们所知,这是首次在根治性治疗后寡转移性PCa患者中比较MDT或仅监测两种治疗策略疗效的随机研究。采用MDT策略的患者开始姑息性ADT治疗的时间明显晚于仅监测的患者。由于ADT治疗对医疗费用和HRQOL的影响,ADT治疗开始是本研究的一个复合终点
[23]
。最近中间临床终点前列腺癌工作组提出无转移生存期可替代总生存期
[24]
。然而,这个研究终点仅适用于局限性PCa, 并不能外推至转移性PCa。
许多相关回顾性病例研究已报道过有前景的成果。然而,最近一项meta分析认为,由于缺乏对比或随机试验研究、样本量小、以及入组患者的异质性问题,MDT不应该作为标准治疗
[9]
。然而,在2017晚期前列腺癌共识会议上,大约2/3的专家已经认同MDT可作为寡复发性PCa患者的治疗方案,尽管目前只有这方面的回顾性研究作为证据
[25]
。一项多中心病例研究通过改良入组和排除标准以克服既往回顾性研究的缺点,结果发现寡复发性PC接受SBRT治疗后的无ADT生存期可达28个月(95%CI,16.2-69.7个月)
[26]
。

 然而,由于缺乏对照组,以及50%患者在SBRT同时接受过短暂的辅助性ADT,这些研究仍存在很大的不足。这种短暂的ADT治疗可以解释为何其无ADT生存期高于本研究的无ADT生存期,即放疗同时加入短暂ADT治疗可以延长高危组和生化复发组PCa患者的无进展生存期和总生存期
[2]
。因此,我们认为未来十分有必要进行MDT同时加入短暂全身药物治疗的临床疗效研究。通过清除易被胆碱PET-CT遗漏的隐匿转移灶,这种协同治疗也许能改善PCa患者的治愈率。本研究所得结果清楚支持上述观点:30%接受MDT的患者在1年内病情进展,出现多发转移。影像检查技术的进步,比如68Ga前列腺特异性膜抗原(prostate-specificmembrane antigen,PSMA)PET-CT,也有助于筛选适合接受MDT的患者
[27]
。PSMA-PET应用广泛,较胆碱PET-CT
[27]
具有更高的敏感性和特异性,在该领域具有广阔应用前景。晚期前列腺癌共识会议工作组中,78%工作组成员支持使用下一代影像检查技术(PET-CT,和或全身核磁共振检查)对生化复发性前列腺癌进行重新分期,其中,76%成员推荐优先选择PSMA-PET,仅10%推荐F18-PET-CT,6%推荐胆碱-PET-CT
[25]
。对于淋巴结转移复发的患者,也可以考虑选择补救性淋巴结清扫或全盆腔放疗以覆盖全部隐匿转移灶
[28,29]
。
然而,由于缺乏对照组,以及50%患者在SBRT同时接受过短暂的辅助性ADT,这些研究仍存在很大的不足。这种短暂的ADT治疗可以解释为何其无ADT生存期高于本研究的无ADT生存期,即放疗同时加入短暂ADT治疗可以延长高危组和生化复发组PCa患者的无进展生存期和总生存期
[2]
。因此,我们认为未来十分有必要进行MDT同时加入短暂全身药物治疗的临床疗效研究。通过清除易被胆碱PET-CT遗漏的隐匿转移灶,这种协同治疗也许能改善PCa患者的治愈率。本研究所得结果清楚支持上述观点:30%接受MDT的患者在1年内病情进展,出现多发转移。影像检查技术的进步,比如68Ga前列腺特异性膜抗原(prostate-specificmembrane antigen,PSMA)PET-CT,也有助于筛选适合接受MDT的患者
[27]
。PSMA-PET应用广泛,较胆碱PET-CT
[27]
具有更高的敏感性和特异性,在该领域具有广阔应用前景。晚期前列腺癌共识会议工作组中,78%工作组成员支持使用下一代影像检查技术(PET-CT,和或全身核磁共振检查)对生化复发性前列腺癌进行重新分期,其中,76%成员推荐优先选择PSMA-PET,仅10%推荐F18-PET-CT,6%推荐胆碱-PET-CT
[25]
。对于淋巴结转移复发的患者,也可以考虑选择补救性淋巴结清扫或全盆腔放疗以覆盖全部隐匿转移灶
[28,29]
。
 据我们所知,该随机研究提供了首个MDT较主动监测策略可延迟ADT开始治疗时间的临床证据。本研究中,我们观察到MDT组四分之三的患者出现PSA变化。当然,我们同时观察到主动监测组35%患者在未接受治疗的情况下出现自发性PSA降低(图4A和4B)。然而,这些降低并不持久,仅20%男性在1年随访时未出现PSA进展,约10%在2年随访时未出现PSA进展。尽管如此,这些数据仍支持Hellman和Weichselbaum
[6]
对寡转移灶的观点,即这部分转移部位的肿瘤尚未完全具备转移潜力并呈缓慢进展。
据我们所知,该随机研究提供了首个MDT较主动监测策略可延迟ADT开始治疗时间的临床证据。本研究中,我们观察到MDT组四分之三的患者出现PSA变化。当然,我们同时观察到主动监测组35%患者在未接受治疗的情况下出现自发性PSA降低(图4A和4B)。然而,这些降低并不持久,仅20%男性在1年随访时未出现PSA进展,约10%在2年随访时未出现PSA进展。尽管如此,这些数据仍支持Hellman和Weichselbaum
[6]
对寡转移灶的观点,即这部分转移部位的肿瘤尚未完全具备转移潜力并呈缓慢进展。
我们的亚组分析显示伴与不伴淋巴结转移患者之间的MDT疗效差异不大。回顾性研究提示PSA倍增时间<3个月的MDT治疗后患者的PFS较PSA倍增时间更长的患者明显缩短。根据我们的PP分析,似乎MDT较主动监测在PSA倍增时间更短的患者中更显著。因此,对PSA倍增时间短的患者采取MDT是一种合理的治疗策略。
本研究纳入的生化复发PCa患者的总体健康状况很好,与其他纳入同样受试者的研究报道无明显差异
[30]
。由于第1年开始ADT的患者之间差异不大(图2A),因此不难理解为何在3个月、1年随访时HRQOL方面并未观察到MDT获益。MDT安全性很高,并未观察到2级以上不良反应,仅17%出现1级不良反应。
总之,MDT应用于寡复发性PCa患者中安全性好,较主动监测策略的无ADT生存期更长。我们建议在样本量更大的III期临床研究中继续探究MDT的应用价值。
AUTHORS’ DISCLOSURES OF POTENTIAL CONFLICTS OF INTEREST
Disclosures provided by the authors are available with this article at jco.org.
AUTHOR CONTRIBUTIONS
Conception and design
: Piet Ost, Karel Decaestecker, Gert De Meerleer
Collection and assembly of data
: Piet Ost, Karel Decaestecker, Val´erie Fonteyne, Nicolaas Lumen, Aur´elie De Bruycker, Bieke Lambert, Louke Delrue, Ren´ee Bultijnck, Tom Claeys, Geert Villeirs, Kathia De Man, Filip Ameye, Ignace Billiet, Steven Joniau, Friedl Vanhaverbeke, Gert De Meerleer
Data analysis and interpretation
: Piet Ost, Dries Reynders, Karel Decaestecker, Els Goetghebeur, Steven Joniau, Gert De Meerleer
Manuscript writing
: All authors
Final approval of manuscript
: All authors
Accountable for all aspects of the work
: All authors
REFERENCES
1. van den Bergh RC, van Casteren NJ, van den Broeck T, et al: Role of hormonal treatment in prostate cancer patients with nonmetastatic disease recurrence after local curative treatment: A systematic review. Eur Urol 69:802-820, 2016
2. Cornford P, Bellmunt J, Bolla M, et al: EAUESTRO
SIOG guidelines on prostate cancer. Part II: Treatment of relapsing, metastatic, and castrationresistant prostate cancer. Eur Urol 71:630-642,2017
3. Parker WP, Davis BJ, Park SS, et al: Identification
of site-specific recurrence following primary radiation therapy for prostate cancer using C-11 choline positron emission tomography/computed tomography: A nomogram for predicting extrapelvic disease. Eur Urol 71:340-348, 2017
4. Sobol I, Zaid HB, Haloi R, et al: Contemporary





















