

ADC 是一类新的抗癌药物,它把抗体的特异性和高效能的小分子毒素通过连接区偶联起来,成为了一个同时具备两个特性的新分子。迄今为止已有两个ADC药物被美国FDA和欧盟EMA获批: 由Seattle Genetics 自主研发的 Brentuximab Vedotin (aCD30-vc-pAB-MMAE)在2011年被批准用来治疗 anaplastic large cell lymphoma (ALCL) 和 Hodgkin lymphoma (HL). 另一个是 Roche自主研发的 Trastuzumab Emtansine (T-DM1) 在2013 年被批准用来治疗 Her2 阳性的乳腺癌。自从2013年ADC领域迅猛发展,现在有60多个ADC 药物正在进行临床试验用来治疗多种癌症,希望不久的将来有更多的ADC 药物被批准。
化疗属于最经典的肿瘤治疗手段,但众所周知毒副作用非常大。针对于肿瘤表面高表达的抗原,ADC可以把更高效能的毒素带到肿瘤细胞从而有效杀伤肿瘤组织,大大降低对其它正常组织的影响。因此ADC可以逐渐取代化疗达到特异性杀伤肿瘤的疗效。化疗不仅毒副作用大,它还显著抑制人体的系统免疫功能。ADC起到局部杀伤肿瘤, 特别是有些类毒素 (Tubulysin and PBD) 还可以引起 immunogenic cell death,激活dendritic cells 活性,从而提高免疫系统功能。由此可见ADC和免疫 checkpoint inhibitor 合用会产生更好的抗肿瘤治疗效果。现在有不少这样的临床试验正在进行中。
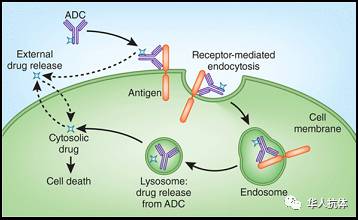
图1: ADC作用机制
ADC 在血液循环里保持稳定,只有通过抗体结合到肿瘤靶点才会释放携带的毒素到肿瘤细胞。 ADC 首先通过特异性抗体结合肿瘤表面抗原,然后整个抗原抗体复合物一起进行endocytosis(细胞内吞作用), 先到 endosome(核内体), 然后到lysosome (溶酶体)。 在溶酶体内毒素被从ADC中释放,最后毒素进入到细胞质,导致细胞死亡。还有一种情况,如果ADC在肿瘤微环境里不太稳定,毒素会在细胞外释放,然后穿过细胞膜进入肿瘤细胞内引起细胞死亡。
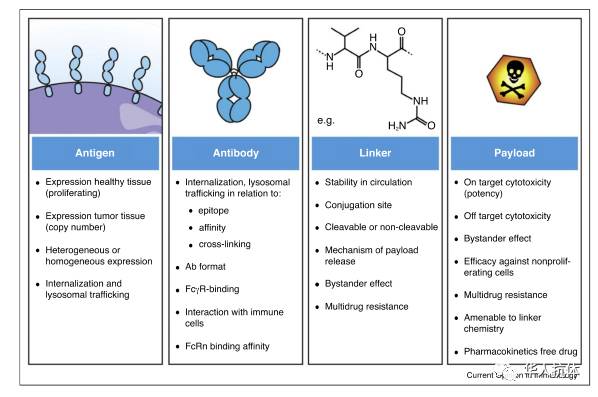
图2: ADC组成成分
ADC 包括三部份: 1)针对肿瘤表面抗原产生的抗体(Tumor Antigen antibody); 2) 杀肿瘤的毒素(Toxin payload);3)连接抗体和毒素的连接区 (Linker)。 下面对每个组成成份进行详细说明。
1)肿瘤表面抗原和特异性抗体的选择 (Tumor Antigen and antibody)
: ADC最理想的肿瘤靶点应该只在肿瘤表达但不在正常细胞组织表达。但是肿瘤细胞是从正常细胞突变过来的, 所以这种理想化的肿瘤靶点是很难找到的。在实际应用中只要选的ADC靶点在肿瘤中的表达远远超过正常组织,这样通过抗体结合肿瘤表面抗原,ADC就会选择性的把毒素带到肿瘤 。对抗体的选择包括抗体要有较高的亲和力(high affinity);有较强的特异性(high specificity);抗体应该用人源化(humanized)或全人 (human) 抗体;ADC中的抗体成份还应该有较强的内吞功能 (internalization)因而有效携带毒素进入肿瘤细胞内部,然后转运到溶酶体(lysosome)从而有效释放毒素杀伤肿瘤细胞。
2)杀肿瘤的毒素(Toxin payload)
:ADC用的毒素主要分两大类,第一类是微管抑制剂(anti-microtubule agents)包括 maytansinoids (DM1) 和 auristatin (MMAE, MMAF)。微管毒素主要抑制快速生长分裂的细胞,所以对肿瘤细胞有一定的特异性。目前通过的ADC药物Trastuzumab Emtansine (T-DM1) 用的是前者;Brentuximab Vedotin 用的是后者。还有在临床试验中的ADC大多使用的是这类毒素。
第二类是DNA抑制剂 (DNA damage agents)包括 烷基化试剂 (Alkylating agents such as Duocarmycin); 抗生素用来产生DNA双螺旋断裂(the enediyne antibiotics including calicheamicin); 结合DNA 小沟的制剂 (pyrolobenodiazepine,(PBD))。DNA毒素效力超级强, (IC50 在 picomole 范围), 主要抑制DNA复制转录修复功能,所以对所有细胞都有杀伤功能。因此当ADC用DNA毒素杀肿瘤,尽管它的功效非常好,它的毒副作用也比较严重。Seattle Genetics 最近宣布 停止Vadastuximab Talirine (SGN-CD33A) 三期 临床试验,由于用药病人出现了较高的死亡率。SGN-CD33A 使用的是PBD毒素,所以DNA抑制剂这类毒素的安全性还有待于更多临床试验的证实。
3)连接抗体和毒素的连接区 (Linker)
:设计连接区的几个要点, 第一 要在血液循环中稳定,确保没有毒素的释放; 第二 当ADC 进入肿瘤细胞,毒素要被有效释放;第三 要尽量设计亲水性的连接区,以避免ADC 聚合物的形成。ADC 聚合物被肝清除的时候不但容易引起肝毒性(hepatotoxicity), 而且还容易引起免疫原性 (immunogenicity)。亲水基团(hydrophilic moiety)包括 sulfonate groups,polyethylene glycol (PEG) group,或者pyrophosphate diester groups 已经用来加在连接区来提高整个ADC 的亲水性。四种连接区设计已经出线在临床试验中,腙(hydrazones)依靠酸性环境释放药物; 二硫化物(disulfides)依靠还原的巯基释放药物;组织蛋白可切的双肽 (cathepsin B cleavable dipeptides)依靠酶切释放药物; 和不可切的(noncleavable)依靠抗体降解释放药物。比如 Brentuximab Vedotin (aCD30-vc-pAB-MMAE)主要是通过溶酶体组织蛋白酶切断 VC 双肽连接区从而释放MMAE。Trastuzumab Emtansine (aHer2-MCC-DM1)是通过ADC在溶酶体降解释放Lysine-MCC-DM1.
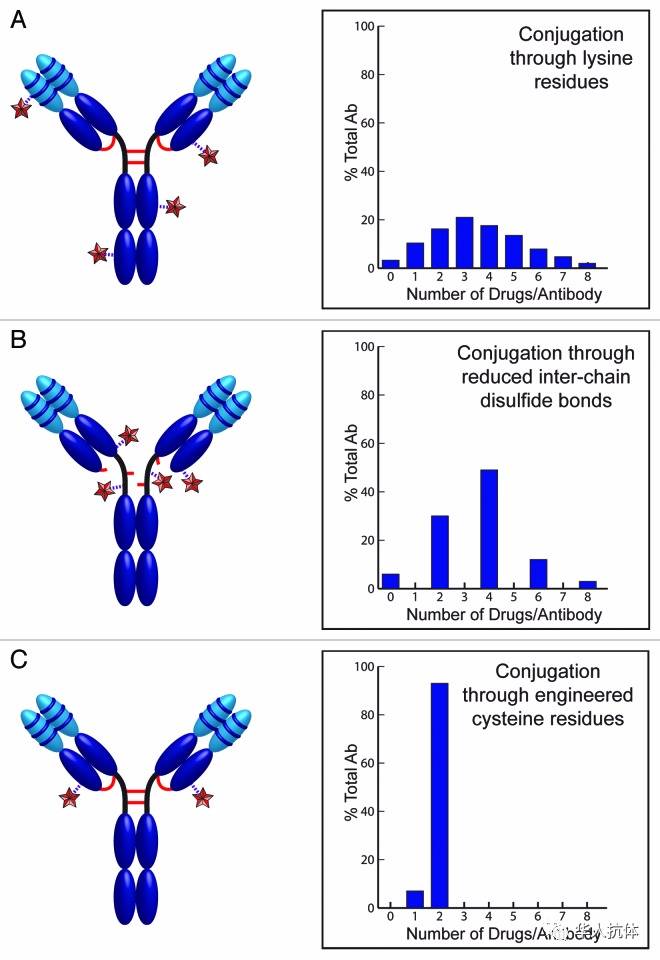
图3: ADC 偶联 (Conjugation)方法:A, Lysine偶联产生零到八个DAR,每个抗体有四十个左右的Lysine可以被偶联。B,Cysteine偶联产生0,2,4,6,8 个DAR,每个抗体有八个在铰链区的Cysteine可以被偶联。C,定点偶联利用抗体上的一个特异位点突变产生Cysteine 用来做偶联反应,每个抗体有两个DAR。
随机偶联 (random Lysine or Cysteine conjugation)
Lysine Amide 偶联
: 抗体表面lysine 能和 linker 区 N-hydroxysuccinimide (NHS)起反应。抗体序列有80 个左右lysine,大约10 个能够用做偶联反应。所以偶联反应的产物是一个混合物,包括不一样的Drug Antibody Ratio (DAR) 和不一样的偶联位点。在T-DM1,平均DAR是3.5 到4,包括从0到7 的分布。DAR和它的分布显著影响ADC PK/PD;抗体可变区 lysine 一旦被修饰,会影响抗体结和抗原的亲和力。FDA通过的ADC药物 Trastuzumab Emtansine (T-DM1)就是用的这种偶联方法。
Cysteine偶联
: 抗体Cysteine 和 linker 区能与巯基反应的功能基团 (Maleimide) 起反应。 一般来说,抗体表面没有自由巯基,所有Cysteine 来自二硫键。最常见的ADC isotype 是人IgG1, 它包括四个 interchain 和 十二个 intrachain 二硫键。其中四个 interchain 二硫键 对人IgG1结构影响不大, 所以在比较温和的条件下被还原成二,四,六,八 个自由巯基。这种方法最多有八个偶联位点,比起Lysine 的八十个位点,更具选择性。FDA通过的另一个ADC药物 Brentuximab Vedotin 就是用的这种偶联方法。
通过Lysine or Cysteine化学偶联,最终产物是混合物,包括不一样的Drug Antibody Ratio (DAR) 和不一样的偶联位点。这种混合物导致较差PK,较少的肿瘤分布,更多的毒副作用,较窄的治疗空间。此外,分析鉴定和控制生产批量之间的差异性也是技术上的大难题。为了克服这些难题,定点偶联(site specific conjugation)技术随之出现。
定点偶联 (site specific conjugation)
Engineered cysteine
: Genentech 发明了THIOMAB 技术,利用抗体上的特异位点突变产生Cysteine 用来做偶联反应,避免了破坏抗体自身的interchain 二硫键。这个技术的最终产物 是DAR=2 在抗体同一 位点的 抗体偶联物,它具有与常规ADC同样的体外体内活性,但是在大鼠和猴子的毒副作用显著降低,因而提高了ADC治疗空间。选择抗体哪个位点变成Cysteine至关重要。当cysteine被置换到抗体轻链(light chain,LC), 重链(heavy chain,HC), 或者 恒定区 (Fc region),每个ADC PK 和 疗效 均有显著差别。这说明抗体局布理化特性决定了ADC位点的稳定性。
Engineered non-natural amino acids (nnAAs)
:改造遗传代码产生新的带有反应基团的非自然氨基酸,例如selenocysteine 和 acetylphenylalanine (pAcPhe)。 Selenocystein 方法已被用于产生 Her2 ADC。在Her2抗体 重链A114 (同一位点已用于 THIOMAB),UGA amber stop Condon 被引入。Her2抗体114位点 acetylphenylalanine (pAcPhe) 在CHO 细胞系中表达,linker 含MMAF毒素 被偶联到 Her2抗体此位点。这种特异位点ADC在血液循环中保持稳定,当到达肿瘤具有特异性杀伤肿瘤能力。
Transglutaminase (TG)
:Microbial transglutaminase (mTG) 催化 glutamine 上的 胺基 (amine) 和 lysine 上的 胺基 (amine) 形成 异肽键 (isopeptide bond),同时释放尿素。mTG 也可催化抗体序列中特异 glutamine (Q)进行偶联反应形成 同质的ADC。mTG不能识别在糖基化抗体 恒定 (Fc)区的glutamine, 但是当抗体通过peptide-N-glycosidase F (PGNase F) 在N297 位点去糖基,Q295 就能被mTG催化,形成携带两个药物 (DAR=2)的ADC。还有一种情况,当N297Q 突变产生额外两个Q 位点用作偶联反应,这样就可以形成携带四个药物 (DAR=4)的ADC。除了Fc区天然Q位点,Strop 和同事 用 LLQG (glutamine tag)这四个氨基酸序列 作为mTG催化底物,然后把LLQG 插在理想的抗体位点进行偶联反应。
Sortase
:金黄色葡萄球菌中 Sortase A 能催化LPXTG氨基酸序列,切掉 threonine-glycine (T-G) bond, 接上含有oligoglycin (oligo-G)的序列。LPXTG序列可以被整合到抗体的不同位点进行偶联反应。生物素化 class I MHC 限制的多肽被 Sortase A 偶联到带有LPETG-His6 标签的aDEC25 抗体重链。这个偶联物内吞到 DC细胞, 然后表面递呈MHC限制的多肽 从而进一步激活T细胞功能。另外Beerli 小组发现LPETG序列首先被加到不同的抗体重链或轻链C末端,带有penta-G的毒素MMAE 通过 Sortase A 偶联到抗体上。这样产生的ADC具有和FDA通过的两个ADC药物 (brentuximab vedotin,trastuzumab emtansine )相似的体外体内肿瘤杀伤能力。
N-Glycan engineering
: N297位点是抗体恒定区的N-糖基化经典位点。聚糖是很好的偶联位点,因其远离抗原结和位点和不太影响抗体PK。SynAffix 描述了三步方法用聚糖合成带有确定DAR的ADC。第一步,抗体通过endoglycosidase Endo S 切除N端聚糖,只剩下GlcNAc;第二步,Y289L突变的bovine β(1-4)-galactosyltransferase 用来转运含叠氮(Azido)的糖到抗体;第三步,通过click 化学反应 drug-linker (药物-联接区)被偶联到抗体,产生DAR=2 的ADC。Zhou 的小组描述了另一种方法:抗体经过β(1-4)-galactosyltransferase and α(2-6)-sialyltransferase 首先被 sialyated,接下来在温和条件下过高碘酸盐氧化,含醛的抗体通过肟化学反应被偶联。采用这种方法,aHer2 抗体 (trastuzumab) 被偶联产生ADC 带有 DAR 接近 2。
在众多的定点偶联方法中,哪一种最好现在还很难定论,除非做一个头对头的临床试验。另一方面从生产的角度来评价,哪一种方法成本低质量稳定也是一个重要的因素。然而不管怎样,定点偶联技术迟早是要取代通过Lysine或cysteine得到的非定点偶联技术。这样技术上的革新会大大提高ADC PK;因而显著降低给肿瘤病人ADC剂量。这样在不影响 ADC临床疗效的同时大大降低毒副作用。
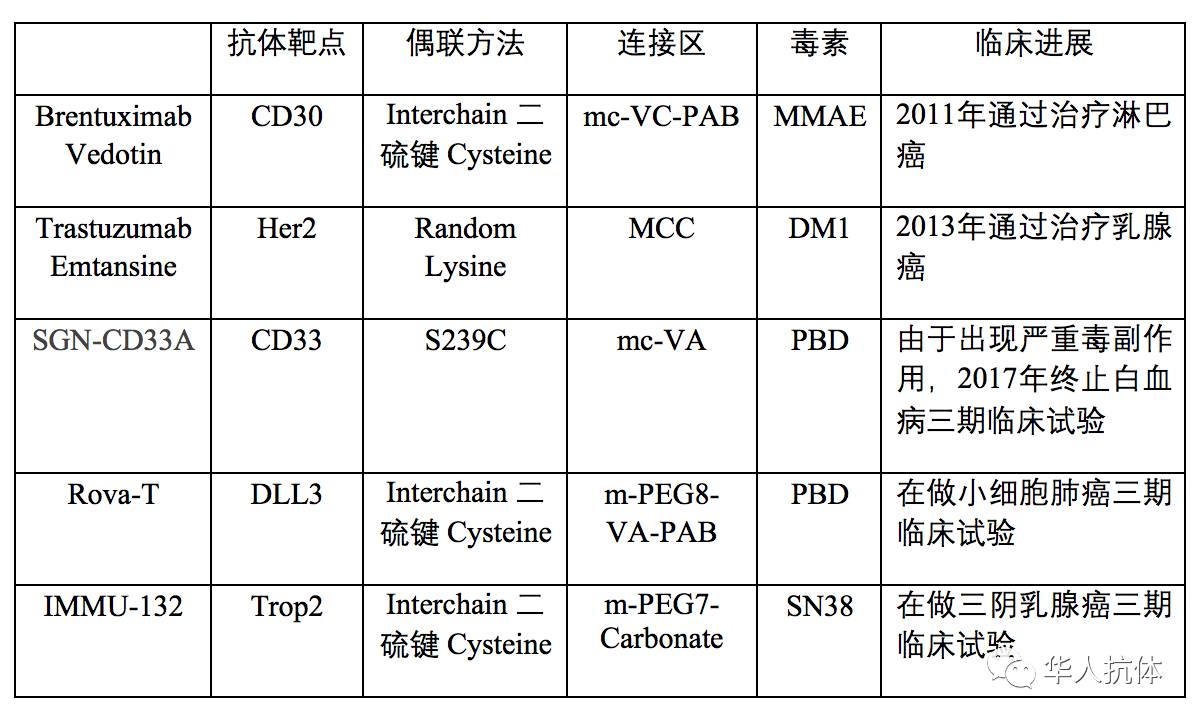
表1: 已被FDA通过的ADCs和正在做 三期临床试验的ADCs
目前的ADC技术还有望在以下方面继续提高。
1)偶联技术
: 定点偶联肯定会取代当前随机Lysine 或Cysteine 偶联技术。这样不但便于定量检测分析,还有利于提高PK 增加ADC治疗窗口。
2)毒素的选择
: 从当前采用最多的微管抑制剂(DM1,MMAE,MMAF)到毒性更强的DNA抑制剂 PBD, 例如Rova-T from Stemcentirc 和 SGN-CD33A from Seattle Genetics. IMMU-132 from Immunomedics 则采用化疗药物irinotecan 代谢活性物SN-38 做为毒素,通过连接区SN-38被偶联到Trop2 抗体上用于治疗乳腺癌和肺癌,现在此ADC正在临床试验二期中。此ADC可以带有8个SN-38以达到治疗功效。
3)连接区(Linker)的多样性
:现在常用的连接区包括不可切的和可切的。Trastuzumab Emtansine (aHer2-MCC-DM1) 属于前者,这类连接区在血液循环中稳定,只有ADC抗体结合肿瘤细胞表面抗原,在被肿瘤细胞内吞后,整个分子在溶酶体被降解后,毒素才得以释放。Brentuximab Vedotin (aCD30-vc-pAB-MMAE)属于后者,被组织蛋白切的vc-pAB连接区现在应用比较广泛,许多临床试验阶段的ADC都采用这个连接区。最近Mersana 发明了一种叫Fleximer 平台:一个不可切的连接区用来连接Fleximer和抗体;另一个可切的连接区用来连接毒素和Flexime。在这种设计下一个ADC可以携带12到15个毒素,在不影响PK的情况下,很大增加了ADC的疗效。现在用这个技术做的Her2ADC 正在一期临床试验中,希望很快知道一些临床数据来证实它的优越性。
4)ADC抗体靶点的选择
:当前人源或全人抗体技术相对比较成熟,寻找ADC新靶点是大家研发的重点。除了临床被证实的二个ADC靶点 Her2 和CD30, 我们可以继续跟踪其它新靶点的进展。有一点需要指出,有时候新ADC临床效果不太理想,并不一定是靶点不好,要分析整个分子,包括毒素,连接区,偶联方法。正如以上所述,ADC是一个复合分子,一定要考虑到每一个组成成分,这样才能最佳的设计好功效高副作用小的抗肿瘤药物。

单靖
,河南医科大学临床医学专业毕业,美国哥伦比亚大学博士,主要从事肿瘤生物机理研究。从2010年加入Regeneron做博士后开始,迄今一直从事肿瘤抗体药物研发。最近更加专注于ADC药物研发。
致谢:感谢郭雷、夏志南、董纪军、张勇博士对文章提出的修改意见。
[1] de Goeij BE, Lambert JM. New developments for antibody-drug conjugate-based therapeutic approaches. Curr Opin Immunol. 2016 Jun;40:14-23.
[2] Lu J, Jiang F, Lu A, Zhang G Linkers Having a Crucial Role in Antibody-Drug Conjugates. Int J Mol Sci. 2016 Apr 14;17(4):561.
[3] Panowski S, Bhakta S, Raab H, Polakis P, Junutula JR. Site-specific antibody drug conjugates for cancer therapy. MAbs. 2014 Jan-Feb;6(1):34-45
[4] Shen B, et al. Conjugation Site Modulates the In Vivo Stability and Therapeutic Activity of Antibody–Drug Conjugates. Nat. Biotechnol. 30(2) 2012: 184–191.
[5] Strop P, Delaria K, Foletti D, Witt JM, Hasa-Moreno A, Poulsen K, Casas MG, Dorywalska M, Farias S, Pios A, Lui V, Dushin R, Zhou D, Navaratnam T, Tran TT, Sutton J, Lindquist KC, Han B, Liu SH, Shelton DL, Pons J, Rajpal A. Site-specific conjugation improves therapeutic index of antibody drug conjugates with high drug loading. Nat Biotechnol. 2015 Jul;33(7):694-6.
[6] Swee LK, Guimaraes CP, Sehrawat S, Spooner E, Barrasa MI, Ploegh HL (2013) Sortase-mediated modification of αDEC205 affords optimization of antigen presentation and immunization against a set of viral epitopes. Proc Natl Acad Sci USA 110:1428–1433
[7] Beerli RR, Hell T, Merkel AS, Grawunder U (2015) Sortase enzyme- mediated generation of site-specifically conjugated antibody drug conjugates with high in vitro and in vivo potency. PLoS ONE 10: e0131177
[8] Strop P, Liu SH, Dorywalska M, Delaria K, Dushin RG, Tran TT, Ho WH, Farias S, Casas MG, Abdiche Y, Zhou D, Chandrasekaran R, Samain C, Loo C, Rossi A, Rickert M, Krimm S, Wong T, Chin SM, Yu J, Dilley J, Chaparro-Riggers J, Filzen GF, O'Donnell CJ, Wang F, Myers JS, Pons J, Shelton DL, Rajpal A. Location matters: site of conjugation modulates stability and pharmacokinetics of antibody drug conjugates. Chem Biol. 2013 Feb 21;20(2):161-7.
[9] Beerli RR1, Hell T1, Merkel AS1, Grawunder U1. PLoS One. Sortase Enzyme-Mediated Generation of Site-Specifically Conjugated Antibody Drug Conjugates with High In Vitro and In Vivo Potency. PLoS One. 2015 Jul 1;10(7):e0131177
ADC药物的研发|华人抗体协会论坛讨论撷英系列之十
华人抗体协会

免责声明:华人抗体微信公众号所载的文/图等稿件部分转载/复制于网络。版权均归原作者所有,不代表协会观点。保留转载文章的出处及原刊载媒体上的署名形式和版权声明(如有),但本协会对转载文章的版权归属和权利瑕疵情况不承担核实责任。如任何单位或个人认为本协会转载的文章涉嫌侵犯其合法权益,请及时向本协会提出书面意见并提供相关证明材料和理由,协会在收到上述文件后将采取相应删除措施。





