编者按:
近年来,鉴别和操纵各类神经元功能的脑研究技术在神经科学领域引发巨大的关注,许多科学家们利用Cre-loxP重组酶系统研究大脑正常工作的机理及各种脑疾病的起因。20世纪90年代初,还在做博士后研究的华人科学家钱卓开始探索Cre-loxP重组酶系统用于脑科学研究。当时,许多同行,包括他的导师都认为这将是一条死胡同。有趣的是,钱卓成功了。20年后,Cre-loxP重组酶系统介导的神经遗传技术成为了脑科学领域的基本技术平台之一,为基因在各脑区的特异性敲除、转基因表达、脑彩虹影像、逆转录病毒神经网路示踪、大脑透明技术、化学遗传学和光遗传学等提供基础技术支撑。近期的研究还发现了一系列新的基因重组蛋白,它们能对声纳、磁信号或快速电压变化产生反应,正在被用来开发声纳遗传、磁遗传学技术以及探测神经元放电变化的电压成像技术。可以预见的是,Cre-lox神经遗传学技术将继续在脑研究中发挥作通用平台的重要作用。
撰文 | 钱卓 (美国奥古斯塔大学佐治亚医学院大脑与行为研究所所长、云南西双版纳生物医学研究院院长)
翻译 | 王德恒(云南西双版纳生物医学研究院大脑破译中心研究员)
责编 | 陈晓雪
●
●
●
一百多年前,西班牙神经解剖学家、1906年诺贝尔奖得主Ramón y Cajal在显微镜下观察到大脑不同神经元的微观结构,惊叹于各种脑神经细胞如同夜空闪烁的星星一样美丽。近代神经科学的新篇章由此开启
[1]
。
20世纪70、80年代,随着单细胞标记和膜片钳技术的出现,神经元结构与功能的研究得到了飞速的发展
[3,4,5,7]
。分子生物学技术也进一步把神经科学领域推到了更深层次的基因和蛋白质水平
[8,9,10,11,12,13,14,15,16]
,大大推动了突触可塑性机理的研究
[17,18]
以及利用遗传工程技术增强大脑学习记忆和认知功能的研究
[19,20]
。
20世纪80年代后期和90年代初,在Mario Capecchi, Oliver Smithies和Martin Evan三位先驱基因打靶和胚胎干细胞技术
(该工作使他们在2007年共享诺贝尔生理学或医学奖)
工作的基础上
[21],
几个著名的实验室开始尝试创建突变小鼠用于基因在发育、肿瘤和免疫方面的功能研究
[23,24,25]
。随后,Alcino Silva, Seth Grant和Thomas O’Dell利用基因的敲除技术来研究CaMKII或Fyn蛋白激酶在突触和记忆功能
[26,27,28]
。这些工作为基因和大脑功能的研究开辟了新的思路。然而,大家很快发现,许多全身基因打靶
(基因在单个受精卵时就被敲除)
构建的小鼠模型,由于遗传补偿缺少表型,或由于被敲除的基因在许多器官发育中的重要作用,发生了产后夭折或发育不良的情况。比如,在CaMKII基因敲除的小鼠身上,人们观察到了自发性的癫痫症状,而在Fyn基因敲除的小鼠中,大脑海马中的齿状回明显存在神经发育缺陷。这两种情况立即引起了关于如何解释模式小鼠脑功能缺陷的激烈争论:到底是先天发育缺陷,还是该基因在成年大脑思维过程中的调节作用,引起了小鼠的学习记忆功能下降?鉴于NMDA受体在可塑性中的关键作用,麻省理工学院的李育庆等人
[29]
着手去证明其在学习行为上的开关作用,但是他们发现NMDAR1基因敲除的新生幼鼠由于大脑发育的缺陷
(如吸吮反射的缺失)
,出生15小时后就全部死亡了。这些夭折的小鼠丘脑的固有触须桶状结构
(stereotypic whisker barrels)
没有形成,说明了NMDA受体在脑结构发育中的关键作用
[29]
,对发育神经科学家来说,是一个令人兴奋的发现。相反,这样的结果对于认知和行为神经科学家来说,却是令人失望的,他们无法利用全身基因敲除技术来研究成年大脑的思维活动与神经机理。大家渴望能有一种新的遗传工程技术,不仅能避开发育过程,而且还能把任何一个基因只在特定的脑区的某一类细胞中进行条件性删除。

年轻而喜欢冒险的岁月
我对研发新一代遗传工程技术的兴趣起源于1990-1993年在哥伦比亚大学的那段经历。1990年,我从明尼苏达大学博士毕业,来到Eric Kandel
(2000年诺贝尔生理学或医学奖得主)
实验室作博士后。密歇根大学Bernie Agranoff教授曾在1964提出长时记忆需要新的蛋白质合成和基因表达。因为我看了一本描述Kandel在海兔研究中“争斗内幕”的科普书
(
Explorers of the Black Box: The Search for the cellular Basis of Memory
)
,我在Kandel实验室主动避免用海兔做研究,而是选择大鼠为研究对象,寻找并克隆能被大脑活动所调节的基因。在我之前,Kandel两个极为优秀的博士后
(在其他实验室读博期间就已发过一两篇
Cell
文章)
由于技术原因,都徒劳而归。1990到1993年,我利用蛋白抑制所引进的即早基因“超表达”的现象,首次成功地差异克隆了一批被大脑活动所调节的新基因,包括大脑特异的即早基因BAD1
(Brain Activity-Dependent)
、组织型纤溶酶原激活剂
(tPA)
和一种促细胞分裂的原活化蛋白激酶磷酸酶
[30,31]
。后来, BAD1基因也被约翰霍普金斯大学的Paul Worley实验室分离并另命名为Arc
(Activity-regulated cDNA)
[32]
。对我来说,分离出大脑新的基因固然令人兴奋,如何检测这些基因在脑认知记忆中的功能更是一个巨大的挑战。大家已经知道基于反义寡核苷酸的“knock-down”方法既不精确也不可靠,而全身基因敲除看似是个不错的选择,但也有如上所说的局限性。
后来,我偶然发现杜邦公司的Brian Sauer博士的一篇论文报道了Cre重组酶在哺乳动物培养细胞株中对环形质粒转染时成功切除标记基因的现象
[33]
。该文在结语提出了一个很重要的问题:“不知Cre是否也能引起哺乳动物细胞染色体上内在基因的lox位点重组?” 这引发了我尝试用它来开发脑区和细胞类型特异性的基因敲除
和/
或转基因过表达新技术的念头。我知道,所有的教科书和文献描述DNA复制和重组与细胞分裂密切相关
(如减数分裂或有丝分裂; 图1)
。这个基本的学说深深地印在每个人的脑中,从Sauer的论文开篇句不难看出,他也对此深信不疑:“近年来,有丝分裂期的哺乳动物的细胞DNA重组的控制过程已成研究的热点……有丝分裂重组在免疫系统的发育和功能中起着核心作用。” 当时大家都知道大脑的神经元在出生后就不再进行有丝分裂
(除了嗅球和海马体中的齿状回)
。因此,任何人打算在成年大脑上进行DNA重组的工作,也意味着其科研生涯必将走入死胡同。大自然已经明确表明,所有的脑肿瘤都不是发生在神经元,而是在还能分裂的胶质细胞。因此,要想利用DNA重组的方式在大脑中进行区域和神经细胞特异性基因敲除显然是不可行的。
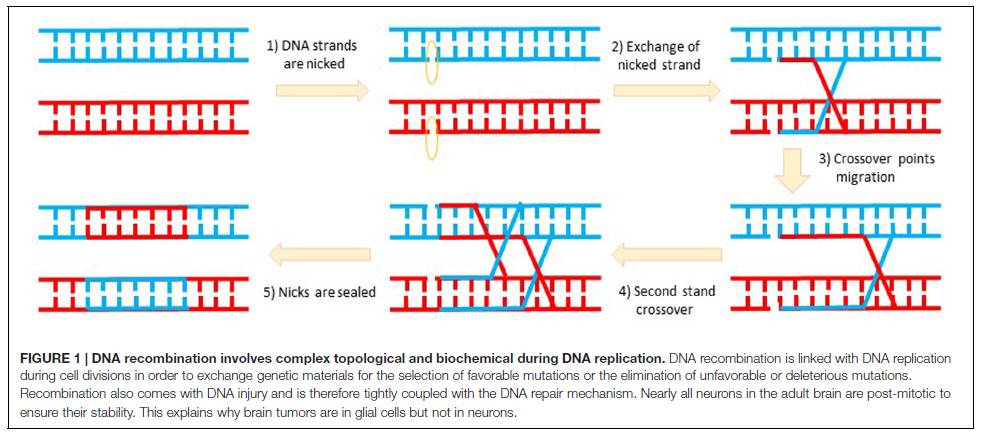
►
图1
但我很想弄明白大脑基因的功能,只是当时只有少数的实验室拥有用来制作传统基因敲除小鼠的基因打靶设施和胚胎干细胞。因此我放弃了申请大学Faculty
(教职)
的机会
(那时大家一般只做一个博后)
,而联系了犹他州的Mario Capecchi和麻省理工学院的Susumu Tonegawa两位大师,表达了想做第二个博后的愿望。高兴的是他们都同意了。于是,我去向Kandel寻求指导和建议,他建议我去Tonegawa的实验室,这让我有些诧异
(Tonegawa因发现免疫抗体多样性的遗传机理在1987年诺贝尔生理学或医学奖,然后转行闯入了Kandel所在的学习记忆领域这一地盘,因此他俩关系很僵)
。我也取得了Kandel实验室另一博士后Mark Mayford的同意使用他克隆的CaMKII启动子,该启动子将在小鼠出生2到3周后激活并只在前脑的主要细胞如锥体细胞上表达
[34]
。对于Kandel的指点和Mayford的慷慨我万分感动。直到数年后Mayford喝了酒后才偷偷地告诉我,原来Kandel当时看中了我的想法会注定失败,正好来个一石二鸟,为消耗掉一个现在的和一个将来可能的竞争对手,“绅士般”地顺水推了这一舟。
1993年秋天,我来到麻省理工学院。在我向Tonegawa做了只有15秒的简短介绍后
(大名人们都太忙了)
,免疫专家的他并没有对我想研发的Cre-loxP神经遗传技术有什么看法,而是放任自由。我惊讶地发现这个有40个博后和学生的大实验室弥漫着丛林动物生存法则的氛围。不过总的来说,麻省理工学院还是一个非常令人兴奋的地方。
开发Cre-loxP神经遗传技术,面临着三大风险:
(1)当时的教科书中认为,DNA重组只能发生在分裂细胞中,而我的直觉是,疱疹病毒
(引起唇疱疹)
感染外周神经节并以某种方式进行自身复制
(迄今为止,该机制仍然是未知的)
,而神经节的神经元“可能”没有分裂;
(2)实验的周期长而且程序复杂,两年内没有反馈,何况这是第二个博士后,哪怕在原理上能成立,如果在技术上出了差错,我仍将求职困难。我必须构建一系列质粒并创建出至少三种不同的小鼠品系,然后着手开始多年的交叉繁殖工作
(图2A,B)
。在那个年代,能够得到一只基因突变的小鼠,已属非常难得。事实上,因为复杂的程序、冗长的项目周期和昂贵的成本,再加上得到的可能是没有任何表型或非己想要的结果,学术界的一个残酷现实就是只有少数几个成功的人能得到一份大学的教授工作,另一大批没有成果的、不幸的博士后们只能从学术界消失。
(3)我给自己挖的另一个坑是:我选择NMDAR1而不是BAD1/Arc作为条件性敲除的基因。我们知道,如果在插入LoxP的位点在某种方式上干扰了NMDA受体的表达,那么数年后得到的将是生下就夭折的小鼠
[29]
。相反,如果在LoxP插入位点时,无意中把Arc基因弄坏,至少我还能发表一篇全身基因敲除的文章。但是我说服了自己,相信自己的想法不仅有希望,而且还能得到好结果:不成功,便成仁,到时,我也会因不相信教科书的教义,而得到一枚“荣誉傻瓜勋章”。
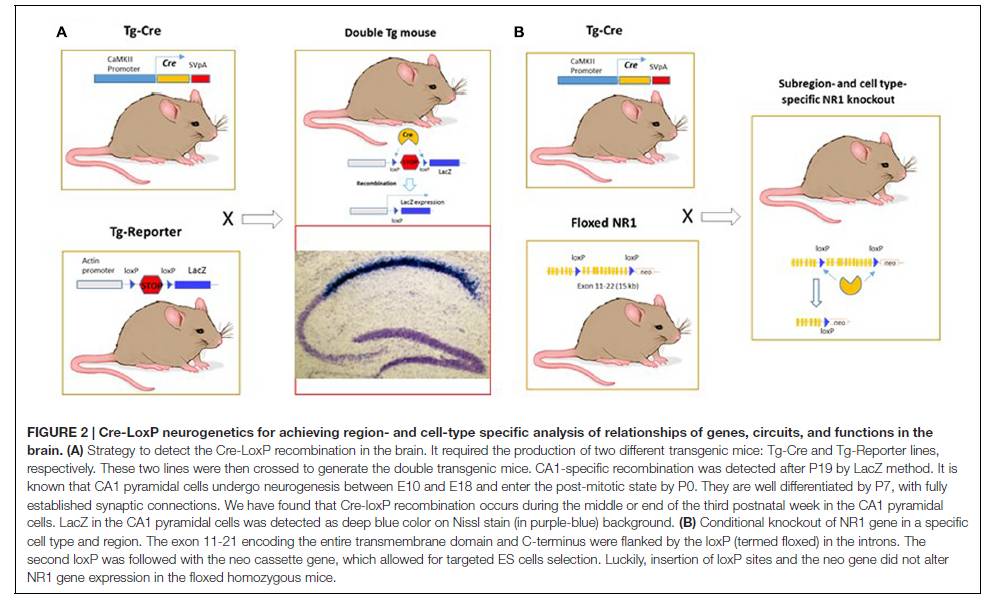
►
图2
真正开始实验时,亟需把纷繁而又复杂的事项进行合理的安排。刚到新的实验室,一切还没理顺,幸好身边的几个同事都很友好,都愿意帮忙。David Gerber和Toshikuni Sasaoka分别教我受精卵和囊胚的微注射;陈东风在免疫抗体和染色方面给予指导;李育庆
(现在佛罗里达大学任教)
分享他对NMDAR1质粒构建的见解;徐明
(现在芝加哥大学任教)
为我提供胚胎干细胞并教我如何进行完美的胚胎干细胞培养;同时我也非常感谢加州理工学院的David Anderson提供的LacZ报告基因和杜邦的Brian Saucer提供的Cre-loxP质粒。
1994年初,我完成了所有的质粒构建并开始转基因小鼠的繁育和floxed NR1胚胎干细胞打靶。更幸运的是,我还有一个勤奋的本科生Cindy Tom和技术员Jason Derwon协助进行基因分型和脑组织切片的工作。
7月,德国的Klaus Rajewsky在
Science
上报道了他们在T细胞的RNA聚合酶中取得了50%的敲降
[35]
,一团黑云飘到了我的头顶。因为这意味着,即使在分裂的T细胞中Cre重组的效率也不高:或是50%的T细胞可以100%敲除RNA聚合酶,或100%的细胞只删除一个基因的拷贝,或更糟的是,两种情况相互混合。尽管如此,我仍“奢望”
(在进一步的文献搜索后)
他们使用的瞬时激活启动子可能是T细胞发育过程中的Cre重组效率低下的罪魁祸首。在随后的岁月里,我把自己变成了鸵鸟,不顾外界的情况,一头扎进了我的Cre-loxP神经技术研发的沙堆里。
当年的深秋,我终于从实验中第一次得到了反馈。
在一个阳光明媚但寒冷的早晨,我仍然记得在显微镜下,我看见 LacZ大脑染色切片时的那种无法言喻的惊喜,在第一条的 Cre 转基因品系小鼠大脑中,我就发现海马CA1区锥体细胞中发生了特异的基因重组
(图 2)
。因为海马 CA1区 是许多可塑性和记忆研究者眼中的“宇宙中心”,这样的好运使我坚信上帝不仅存在,而且一直就在我的身旁。随后,另外的几个 Cre品系也确认了类似 CA1区域特异性的重组;然后其他的Cre品系小鼠还显示具有前脑的特异性。当Tonegawa从日本出差回来,我向他汇报了我的发现。可能由于他在倒时差的缘故,他也没有想起我这几年在做的是什么课题。当他醒悟过来后,非常兴奋,立即打电话给加州大学洛杉矶分校的Alcino Silva
(把Tonegawa引入神经领域的第一个博后,已成为该校的助理教授)
,与对方分享了这一惊喜。
与此同时,我在思考为什么本来应该在前脑表达而不是CA1区特异性的CaMKII 启动子会有如此的特异性作用。陈东风和我通过对Cre的染色找到了原因——我们发现 Cre在CA1区锥体细胞上的表达更高,因此基因顺利而有效地重组了。在之后的6到8个月的时间里,我通过交杂Cre转基因T29-1品系获得了floxed NR1纯合子小鼠,确认了CA1区锥体细胞特异性 NMDA 受体敲除。拿到3-5周的小鼠,Pato Huerta和我就各自推进脑片记录和组织学实验。我们亦留出一组小鼠与Tom McHugh, Kenny Blum和Matthew Wilson进行合作研究,在NR1突变小鼠上记录海马位置细胞的放电活动模式。现在,我们知道T29-1的Cre-lox重组在出生两个月的小鼠上保留了CA1区特异性,不过随着Cre表达时间的积累,如同预期的CaMKII启动子的动态,大概在小鼠出生第8周后开始,特异性重组将逐步扩散之整个前脑。
1996年的秋天,我们准备给
Cell
杂志投3篇连续的文章。我们决定将报告Cre-lox神经遗传技术的可行性作为第一篇,CA1区特异性NMDA受体敲除研究作为第二篇,位置细胞的特性作为第三篇。因为在工作中使用了Kandel实验室的CaMKII启动子,最初和Eric Kandel商议的是,Cre-lox的工作万一成功,我们将把他和Mark Mayford放在第一篇投稿中, 作为共同作者。这个起初不被看好的项目, 如今得到了出乎意料好的实验结果,也因此带来了诸多烦恼,令人头痛。Kandel认为神经科学界对CA1特异性的NMDA受体敲除在学习和记忆研究具有更为重要而广泛的意义,他要求将他的署名从第一篇的方法论文章中移到第二篇,但是Tonegawa也认为第二篇文章可能更重要,坚决反对。一个多月来来回回的争吵让我夹在中间左右为难,头痛不堪,但也让我亲身体验了什么叫做脑袋被挤夹在石缝里。最终Kandel的名字还是被Tonegawa硬放到了第一篇文章里,而最终这三篇连续文章在没有通讯作者的情况下,与1996年的12月底发表在了
Cell
杂志上
[36,37,38]
(第一篇引
用次数为921,第二篇为1526,第三篇514)
。

神经科学的Cre-driver资源
Cre-lox神经遗传技术可行性的成功验证在神经科学领域引发了一个新的热点。我也于1997年夏天在普林斯顿大学分子生物学系建立了自己的实验室
(施一公几个月后也来到来该系,我们成为系里仅有的两位华人教授)
。美国国立卫生研究院意识到Cre-lox神经遗传技术对神经科学的独特而重要的作用,启动了神经科学研究蓝图Cre-driver
(Cre-表达体系)
项目,为认知行为学创建一批小鼠品系,以便更好地鉴定特定的细胞类型和神经回路的功能。我也在立项、评审过程中提供了一些指南和建议
(我回避了申请,而专注创构转基因“聪明鼠”,
[39]
)
。美国国立卫生研究院最终遴选了三个中心,启动了神经系统表达Cre重组酶的转基因小鼠的创建及繁殖工作。三个研究中心分别由贝勒医学院的Ronald Davis博士
(现在佛罗里达州Scripps研究所)
,冷泉港实验室的Z. Joshua Huang博士
(与Brandeis大学的Sacha Nelson一起)
和Scripps研究所的Ulrich Mueller博士领导。这几个项目创建了数百条Cre-driver的小鼠品系
[40]
。现在,这些品系的小鼠获得的途径有突变小鼠区域资源中心
(MMRRC)
或美国最大的动物供应商Jackson实验室的Cre库
(见表1)
。
美国国立卫生研究院的神经科学研究蓝图还资助了洛克菲勒大学的GENSAT项目。该项目由Nathaniel Heintz领导,创建BAC-Cre重组酶驱动的小鼠品系
[41]
。现今,已经创建了总计288个Cre品系。除了官方的努力,许多个人实验室和科研院校也创建了多种Cre-drivers
[42,43]
。迄今为止,Jackson实验室已经收集了600多个Cre品系的小鼠模型,提供给大家研究。
欧盟也跟随美国国立卫生研究院的倡议推出以CREATE命名的Cre-driver项目
(为等位基因突变小鼠条件表达的资源协调)(表1)
。CREATE联盟代表的大多数欧洲、国际小鼠数据库持有人以及研究团体的核心,建立Cre-driver品系的一体化战略,并应用在小鼠上建模来研究复杂的人类疾病。各国的研究人员可以通过联系
EMMA
(European Mouse Mutant Archive, Italy)
或者
MSR
(International Mouse Strain Resource; Table 1)
来获得Cre的不同品系。另外,英国、加拿大和日本也启功和资助了他们自己的Cre-driver项目
(表1)
。
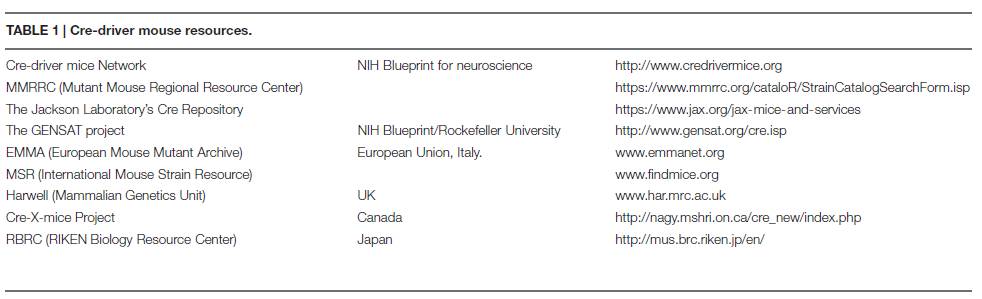
►
表1

脑研究的一个重要通用平台
在过去的十年中,Cre重组基因技术应用最令人激动的一个方向是采用光刺激操纵神经元的光遗传学
[44,45]
。研究人员通过在丰富的Cre品系小鼠上或Cre病毒表达光感应离子通道,刺激或抑制某类神经细胞的放电,使其成为耀眼的明星
(这一系统被Karl Deisseroth简称为光遗传学)
。亲眼看到光感应离子通道能充分地利用Cre重组基因技术的原理及这些Cre品系动物
[46]
,为神经科学界更多的同行服务,对我来说是个莫大的乐趣。
在神经科学方面,并非仅有表达光感应离子通道受益于Cre-LoxP神经遗传技术这一平台。Cre-LoxP神经遗传技术在化学遗传学中已显现出强大作用,使得科学家能够激活或抑制特定的神经元。例如,在化学–转基因修饰过的蛋白上进行过表达,如蛋白激酶
[47,48]
或在特定的神经元或脑区设计药物激活专门受体
[49]
。
研究人员还可以通过Cre品系使用floxed白喉毒素片段A
(DTA)
来删除
(毒死)
特定的细胞,然后观察所产生的表型。
此外,Cre-lox遗传技术也应用于逆行病毒对大脑各种神经元的示踪,如斯坦福大学骆利群教授等小组示踪锥体细胞或多巴胺细胞
[50,51]
,或被用在透明大脑
(Clarity)
特异神经元环路的示踪方法中。哈佛大学的Jeff Lichtman和Joshua Sanes还巧妙地利用Cre-loxP系统的独特性质在单个神经元中,随机表达不同比例的红、绿、蓝色的绿色荧光蛋白
(GFP)
的衍生物,这种技术被称为“脑彩虹”
[52]
。这种技术使他们能够以一种独特的颜色标记每一个神经元,对神经科学连接组学领域来说,无疑是巨大的贡献。
Cre-lox遗传技术平台也被用于电压敏感的蛋白质来监测神经元的活动变化。基因编码的钙传感器,如GCaMPs,使得许多实验室通过对钙的瞬态来推断神经元活动的变化
[53]
。研究人员也在开发其他基因编码的电压敏感的荧光蛋白,以便可以离体或在体的方式来研究神经元的放电反应
[54,2,6]
。
去年,Stuart Ibsen和Sreekanth Chalasani报道了一个有趣的方法,采用低压超声刺激产生的微气泡可以增强机械的形变,从而激活力传导通道
(TRP-4)
促发神经元放电
[22]
。作者发现,通过在特定的神经元中过表达TRP-4,可以增强神经元对超声刺激的敏感性。另外,科研人员还报道了另一种非侵入性的方法:磁遗传学
(magnetogenetics)
,可以通过磁刺激在体激活神经元。比如,神经元的激活是可由表达并刺激阳离子通道
(TRPV4)
与顺磁性铁蛋白的混合体来实现
[55,56]
。或外源磁受体铁硫簇组装蛋白1
(Isca1)
[57,58]
。可以想象,随着各种新蛋白功能的开发,脑科学家们可利用Cre-lox技术平台,利用它们操纵特定的神经元,进一步了解大脑的工作原理。
回首过去的20年,研发Cre-lox神经遗传技术曾被同行断定为是一条死胡同,但凭着直觉和初生牛犊不怕虎的冲劲,我用头撞穿了“南山”,幸运地闯出了一条生路。如今在神经科学领域,几乎每周都会有科研人员利用Cre技术的学术成果报道。当学生们问起时,我会感慨地鼓励大家:年轻时当个愣头青,说不定就是上帝给你的一大宝器!

本文来自:Tsien JZ (2016) Cre-Lox Neurogenetics: 20 Years of Versatile Applications in Brain Research and Counting…
Front. Genet.
7:19.
doi: 10.3389/fgene.2016.00019
原文链接:http://journal.frontiersin.org/article/10.3389/fgene.2016.00019/full
因篇幅所限,参考文献从略,请回复“参考文献”查看。
制版编辑:邓志英
丨
本页刊发内容未经书面许可禁止转载及使用
公众号、报刊等转载请联系授权
[email protected]
▼点击查看相关文章
特殊使命
|
钱与竞争
|
校长造假
|
奥数
|
遗作
最受欢迎
|
西湖
|
农场
|
学术辩
|
日本奖
屠呦呦
|
王晓东
|
白岩松
|
何江
|
张锋
|
霾
杨振宁
|
卢煜明
|
王小凡
|
女性成就
|
张纯如
 ▼
▼
▼
点击“阅读原文”,牵手科学队长!
▼
▼
▼
点击“阅读原文”,牵手科学队长!




