BMS宣布Opdivo与CTLA-4抑制剂Yervoy联用在PD-L1阳性的NSCLC中达到部分共同主要终点
BMS宣布剂Opdivo与CTLA-4抑制剂Yervoy联用,在治疗肿瘤PD-L1表达≥1%的非小细胞肺癌患者(NSCLC)的3期临床试验中,达到了试验1a部分共同主要终点
Opdivo和Yervoy是BMS开发的免疫检查点抑制剂
Checkmate 227分为3组。1a组评估nivo联合ipi或nivo单独用药对比化疗治疗PD-L1阳性的NSCLC;1b评估nivo联合ipi对比化疗和nivo联合化疗对比化疗一线治疗PD-L1阴性的NSCLC。2组是nivolumab联合化疗对比化疗,不考虑PD-L1和TMB,主要研究终点为OS
1a,和1b的探索性分析发现opdivo达到了共同终点,延长了OS。但是2组没有显著获益
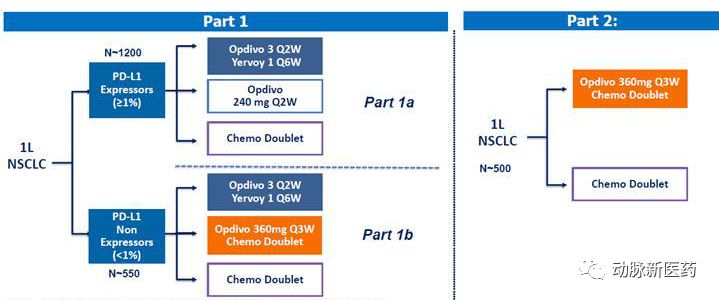
Checkmate 227的实验设计
数据来源:
BMS
杨森公司宣布,治疗多发性硬化的在研疗法ponesimod,在3期临床试验中达到主要终点和多数次要终点
杨森公司(Janssen)宣布,治疗复发型多发性硬化症(MS)的在研疗法ponesimod,在3期临床试验中达到主要终点和多数次要终点
Ponesimod是一款特异性鞘氨醇-1-磷酸受体1(S1P1)调节剂
在随机双盲,含活性对照的3期优越性临床试验,包含1133名患者,疗程长达108周,主要是比较ponesimod与获批疗法teriflunomide在治疗复发型MS患者时的疗效、安全性和耐受性
ponesimod与teriflunomide相比,达到了试验的主要终点,疗效至少相当
FDA接受Epizyme在研药物tazemetostat递交的新药申请(NDA),同时授予其优先审评资格
Epizyme宣布,FDA接受其为在研药物tazemetostat递交的新药申请(针对上皮样肉瘤),同时授予其优先审评资格
Tazemetostat是一款“first-in-class”组蛋白赖氨酸甲基转移酶(Histone-Lysine N-methyltransferase)EZH2的抑制剂
tazemetostat的ORR为15%,DCR达到了26%。中位OS尚未抵达。此外,tazemetostat也展示了良好的安全性和耐受性
罗沙司他在长期接受透析和未经透析的肾脏病患者的2项3期实验达到临床终点
NEJM在线发表了两篇论著,公布了罗沙司他(roxadustat)在中国的两项3期临床试验结果
罗沙司他是一种“first-in-class”低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI)
在透析导致贫血的实验中,实验者招募了305名终末期肾脏病患者,以2:1的比例随机分配至试验组和对照组;在肾性贫血实验中,研究者以2:1的比例随机分配了154名慢性肾病患者
在透析贫血组中,受试者在23周至27周时血红蛋白中位水平为10.4 g/dL,达到了预设的非劣效性;在肾性贫血组中,服药8周后试验组患者的血红蛋白水平有显著提升,达到了主要临床终点
Myovant Sciences宣布其在研relugolix组合疗法,在治疗子宫肌瘤的3期临床试验达到了主要疗效终点
Myovant Sciences公司宣布,其在研relugolix组合疗法,在治疗子宫肌瘤的3期临床试验LIBERTY2中,达到了主要疗效终点和6项关键性次要终点
Relugolix组合疗法每片包含relugolix (40 mg),雌二醇(1.0 mg),以及醋酸炔诺酮(0.5 mg)
接受relugolix组合疗法治疗的患者中71.2%达到预设的缓解标准这一主要临床终点,安慰剂组的数值为14.7%(p<0.0001)
默沙东公司宣布治疗HIV感染的创新药物islatravir,在1期临床试验中获得积极结果
默沙东(MSD)公司宣布,治疗HIV感染的创新核苷类逆转录酶易位抑制剂(NRTTI)islatravir(曾用名MK-8591),在1期临床试验中获得积极结果
Islatravir是默沙东开发的创新NRTTI,通过多种机制抑制HIV逆转录酶的功能,作用机制有别于目前获批的抗HIV疗法和传统的核苷类逆转录酶抑制剂(NRTIs)
在1期临床试验中,islatravir被装进一个火柴大小的聚合物药物洗脱植入体。它被皮下植入到健康志愿者的上臂中,在12周之后植入体被摘除
植入体能够持续12周将细胞内islatravir的浓度保持在药代动力学阈值以上
ViiV Healthcare公司宣布fostemsavir在HIV-1 成人患者的3期临床试验中取得积极结果
ViiV Healthcare公司宣布,其“first-in-class”抗病毒疗法fostemsavir,在治疗接受过多次前期治疗的HIV-1 成人患者的3期临床试验中取得积极结果
Fostemsavir是temsavir的前体药物(pro-drug)。Temsavir能够与HIV-1包膜糖蛋白gp160复合体的gp120亚基相结合,阻断病毒与细胞CD4受体的相互作用
3期临床试验,fostemsavir与优化背景治疗(OBT)联用,治疗携带对多种药物产生耐药性HIV-1病毒的难治患者群
在接受fostemsavir与OBT联合治疗第96周,60%随机队列中的患者(n=163/272)实现病毒学抑制(HIV-1 RNA<40拷贝/毫升),与第48周的结果相比增加了6%
Vertex Pharmaceuticals公司向美国FDA提交了NDA,申请治疗囊性纤维化(CF)的药物上市
Vertex Pharmaceuticals公司宣布,它向美国FDA提交了由VX-445(elexacaftor),tezacaftor和ivacaftor三种药物构成的组合疗法的新药申请(NDA),用于治疗囊性纤维化(CF)。
VX-445是新一代CFTR蛋白矫正剂,它用于恢复携带F508del突变的CFTR蛋白的功能,从而改善CF患者的呼吸功能
在随机双盲,含安慰剂对照的3期临床试验中,VX-445与tezacaftor和ivacaftor构成的三联疗法用于治疗携带一个F508del基因突变和一个功能最小化基因突变的患者
治疗组患者与接受安慰剂治疗的对照组相比,肺功能显著提高
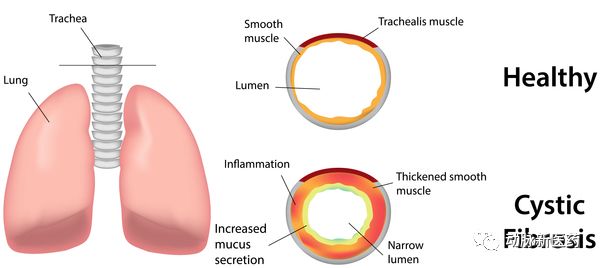
囊性纤维化的表现
数据来源:
NIH
Acadia宣布其5HT2A反向激动剂Nuplazid在一个叫做ENHANCE的三期临床失败
Acadia宣布其5HT2A反向激动剂Nuplazid在一个叫做ENHANCE的三期临床失败
Nuplazid是高选择性5羟色胺受体2A亚型反向激动剂,但没有多巴胺受体活性、因此没有其它精神分裂药物的不自主运动副作用
这个试验招募396位中重度精神分裂患者,分别在标准疗法背景上使用6周Nuplazid和安慰剂
两组患者在阳性、阴性总评分(PANSS)无差异,错过一级终点。Nuplazid在事先设定的阴性症状分值这个二级终点显著优于安慰剂组,但因一级终点错过这个终点只能作为探索性疗效
商业合作
PharmaCyte Biotech与UTS联手创造新的Melligen细胞,治疗糖尿病
7月22日,PharmaCyte Biotech宣布与澳大利亚悉尼科技大学(UTS)签署了一项研究协议,将创造一种新的Melligen细胞,用于治疗糖尿病,这种细胞可能表达更高水平的胰岛素。( biospace )
HHS、DoD与VenatoRx联合开发治疗耐药感染的新型抗生素
7月22日,HHS、DoD与VenatoRx,宣布将联合开发一种新型抗生素,用于治疗由对现有药物产生抗性细菌引起的感染。VenatoRx临床阶段候选药物包括一种新型化合物VNRX-5133,当与目前市售抗生素头孢吡肟联合使用时,可以克服某些形式的抗生素耐药性。这种方法可以使头孢吡肟/ VNRX-5133治疗由一些对现有抗生素不敏感的耐药细菌引起的感染。( biospace )
百洋医药集团与老百姓大药房达成战略合作,共同实现10亿级销售规模
7月22日,百洋医药集团与老百姓大药房举行以“战略聚力,同心共赢”为主题的战略合作签约仪式,双方共同宣布达成战略合作。这是继百洋启动千亿处方药零售平台项目之后,与连锁药店巨头达成的首个合作。未来2年内,在百洋医药集团商业化平台的支持下,老百姓大药房将从“药品零售商”转变为“健康服务商”,双方共同实现10亿级销售规模。( 医药地理 )
Mallinckrodt Pharmaceuticals与Silence Therapeutics达成合作,开发及推广RNA干扰(RNAi)疗法SLN500
近日,Mallinckrodt Pharmaceuticals公司宣布与Silence Therapeutics公司达成一项合作协议,两家公司将开发及推广RNA干扰(RNAi)疗法SLN500,用于抑制补体级联反应,从而治疗补体系统相关的免疫疾病。根据协议,Mallinckrodt将获得SLN500疗法的独家全球性开发权益。Silence公司将获得2000万美元的预付款,以及潜在里程碑付款。Silence公司将负责临床前研究,并执行每项资产的开发计划,直到1期临床试验结束。Mallinckrodt随后将负责临床开发和全球推广。( 新浪医药 )
雷尼绍与威尔士大学口腔医院达成合作,研发独特的外科手术植入体
近日,雷尼绍同位于英国卡迪夫的威尔士大学口腔医院 (University Dental Hospital of Wales, UDH) 合作,成功攻克外科手术植入体领域的多项挑战。UDH医院曾使用雷尼绍增材制造 (AM) 技术制造一系列口腔产品,包括钴铬合金支架,而且还利用增材制造技术生产定制化颌面植入体和手术导板。
现成的标准化植入体需要进一步改造或者磨削患者患处周围的骨骼,而定制化医疗产品是专为特定患者设计的,因此可以帮助医院大幅缩短手术时间。定制化医疗产品不仅有助于改善患者体验,减少长时间麻醉的相关风险,而且可以大幅缩短手术时间以及减少相关成本。( 3ddayin )
Mallinckrodt和Silence Therapeutics达成价值20亿美元RNAi协议,抑制补体级联反应
近日,英国两家制药公司Mallinckrodt Pharmaceuticals和Silence Therapeutics plc联手开发RNA干扰疗法,旨在抑制补体级联反应。补体级联反应是一组参与免疫系统的蛋白质,在炎症的发展过程中发挥作用。补体级联蛋白被认为在许多疾病的发病机制中发挥作用,包括自身免疫性疾病。( 汇众医疗 )
赛诺菲与罗氏签署达菲授权协议,用于预防和治疗流感
近日,赛诺菲已与罗氏(Roche)签署一项达菲(Tamiflu)在美国的独家授权协议,用于预防和治疗流感。赛诺菲消费医疗部门执行副总裁Alan Main表示:“对我们来说,这是一笔战略性且重要的交易,因为我们正努力不断将创新引入市场。” ( seekingalpha )
Dassault Systèmes与FDA扩大合作,为心血管设备审查流程提供信息并加快获得新的治疗方法
7月24日,Dassault Systèmes宣布将与美国食品和药物管理局合作延长5年。3D体验平台正在进行一项临床试验,评估活体心脏模拟3D心脏,以改变新设备的测试方式。3D体验平台将被用来开发一个新的数字工具,使心血管和医疗设备的监管审查更加有效。研究人员希望,这一史无前例的过程将促进行业创新,并为患者提供一条有效途径,让他们获得安全、有效新疗法,治疗世界头号死因——心脏病。( biospace )
美国儿童慈善医院与MORE Health爱医传递达成合作,为中国儿童患者提供远程诊疗服务
7月23日,美国堪萨斯城儿童慈善医院和全球医疗服务公司MORE Health爱医传递宣布建立创新合作伙伴关系,借助爱医传递的医师合作平台,为来自世界各地的患者提供儿童慈善医院的专家远程诊疗服务。通过此次合作,MORE Health爱医传递与儿童慈善医院将以互惠互利、共同发展的方式合作提供远程第二意见,同时儿童慈善医院也将临床创新成果带给中国患者和中国医生。
Syapse公司与辉瑞公司达成协议,在肿瘤学领域开发精准药物
7月23日,Syapse公司宣布与辉瑞签署一项合作协议,将利用Syapse公司社区卫生系统提供商网络的真实数据,了解分子检测和治疗选择。这是该公司第三次与大型制药公司签署此类协议。Syapse公司首席执行官Ken Tarkoff表示:“辉瑞公司在利用真实数据改善全球患者生活方面走在前列,我们很高兴能与他们合作,发掘有助于改善患者护理和加速新疗法可用性的证据和见解。为了实现精准医疗的潜力,医疗生态系统中所有利益相关者需要共同努力。” ( 汇众医疗 )
新基宣布将Ico激动剂vopratelimab和PD-1抗体JTX-4014产权退回Jounc
7月25日,新基宣布将Icos激动剂vopratelimab和PD-1抗体JTX-4014的产权退回给合作伙伴Jounce,但将出资5000万美元首付、4.8亿里程金获得其巨噬细胞检查点抑制剂LILRB2 受体抗体JTX-8064。尽管Jounce的核心技术是ICOS,但因vopratelimab在一期临床无论单方还是与Opdivio组合都只有10%左右应答率,所以新基放弃这个资产而开始一个新靶点合作。( 新浪医药 )
慕恩生物与承葛生物签署合作协议,联合开发IBD活菌药
7月25日,慕恩(广州)生物科技有限公司与广州承葛生物有限公司签署战略合作协议,双方将针对溃疡性结肠炎(UC)治疗联合开发微生物活菌药物,共同推进微生态制药产业的快速发展。( 动脉网 )
艾尔建与Editas联合启动眼科CRISPR疗法I/II期临床研究
近日,艾尔建与基因组编辑公司Editas Medicine联合宣布眼科基因编辑疗法AGN-151587(EDIT-101)的I/II期临床研究BRILLIANCE(NCT03872479)已启动患者入组。AGN-151587正开发用于治疗莱伯先天性黑蒙症10,这是一种由中心体蛋白290(CEP290)基因突变引起的遗传性失明。AGN-151587是一种AAV5病毒载体,装载了3个成分,包括:由U6聚合酶III启动子控制的2个指导RNA(gRNA)gRNA-323和gRNA-64,以及通过光受体特异性GRK1启动子表达的金黄色葡萄球菌Cas9。( 新浪医药 )
BioCardia与AstraZeneca延期开发协议,进行Helix™系统的支持和培训
7月26日,BioCardia宣布已与AstraZeneca就BioCardia的Helix™生物治疗输送导管系统签署2017年开发协议的延期协议。Helix™系统可以低风险将细胞和基因传递给患者心脏,目前已被进行12项细胞和基因治疗试验且被应用于至少300例手术。根据该协议的初始临床前阶段,BioCardia将获得相当大的预付款,其中一部分将对BioCardia生物治疗输送系统的支持和培训。该协议时间有限,且仅适用于BioCardia目前尚未自行开发或与他方合作开发的一类生物治疗药物。( 汇众医疗 )
赛诺菲与美国生物制药公司Verastem签订协议,获抗癌药Copiktra授权
近日,美国生物制药公司Verastem Oncology宣布与赛诺菲(Sanofi)签订协议,授予赛诺菲在俄罗斯、独联体、土耳其、中东、非洲开发和商业化靶向抗癌药Copiktra(duvelisib)治疗所有肿瘤学适应症的独家权利。Copiktra是一种口服磷酸肌醇-3激酶(PI3K)抑制剂,该药是美国FDA批准的首个PI3K-δ和PI3K-γ双效抑制剂。( 生物谷 )
其他资讯
*
美国FDA批准礼来公司开发的Baqsimi粉剂上市,作为治疗严重低血糖的紧急疗法。
Baqsimi是一种胰高血糖素从鼻腔喷入的粉剂疗法,它是第一款获得FDA批准的严重低血糖非注射型紧急疗法
*
默沙东(MSD)和卫材(Eisai)联合宣布,美国FDA已经授予Keytruda(pembrolizumab)与Lenvima(lenvatinib)组合疗法突破性疗法认定,用于一线治疗不能局部治疗的晚期不可切除的肝细胞癌(HCC)患者
*
Freenome宣布完成1.6亿美元的B轮融资,至此Freenome已累计完成2.38亿美元的融资。Freenome旨在开发简单而准确的多组学血液检测方法,对早期癌症进行检测和筛查
*
德克萨斯大学西南医学中心的研究人员发现,目前一些用于治疗不到10%的乳腺癌患者的PARP抑制剂可以用于治疗更广泛的癌症类型,包括卵巢癌和前列腺癌。这项新研究还发现了一种潜在的生物标志物,可以指导在那些患者中可以使用PARP抑制剂抗击癌症
*
GSK宣布任命前诺华和阿斯利康首席财务官Jonathan Symonds为下一任董事长。GSK正面临业务上的巨大转变,目前正在寻求“通过创新的研发方法创造价值”,并计划“创建和拆分两家新的世界领先公司”,一家专注于制药和疫苗,另一家专注于消费者健康业务
*
安进和艾尔建宣布在美国市场推出Mvasi和Kanjinti,这两款药物分别是安维汀和赫赛汀的生物仿制药。安维汀和赫赛汀是全球最畅销的两款肿瘤学药物,2018年全球销售额分别为68.49亿瑞士法郎和69.82亿瑞士法郎。在美国,两款药物2018年销售额合计为59亿美元
产品审批
复星医药1.05亿美元引进产品Vyleesi获FDA批准
近日,美国FDA已批准Vyleesi(bremelanotide注射液),用于治疗绝经前女性的获得性、广义的机能减退型性欲障碍(HSDD)。
该病特征为性欲降低,致使情绪低落或人际交往困难。
Vyleesi通过皮下注射给药,30分钟起效,疗效可持续8个小时。
( 医药地理
)
三星Hadlima获美国FDA批准,用于治疗多种自身免疫性疾病
7月24日,韩国生物制药公司三星宣布,美国食品和药物管理局(FDA)已批准Hadlima,该药是艾伯维旗舰产品修美乐的生物仿制药,用于治疗多种自身免疫性疾病,包括:
类风湿性关节炎(RA)、幼年特发性关节炎(JIA)、银屑病关节炎(PsA)、强直性脊柱炎(AS)、成人克罗恩病(CD)、溃疡性结肠炎(UC)、斑块型银屑病。
Hadlima是三星Bioepis公司在美国批准的第三款抗TNF生物仿制药,同时也是该公司在美国批准的第4款生物仿制药。
( 生物谷 )
对标AbbVie旗下Humira,Merck生物仿制药获得FDA批准
7月23日,FDA批准Merck公司的仿制药Hadlima与AbbVie公司的类风湿性关节炎治疗药物Humira生物相似。
该药物由Samsung Bioepis有限公司为Merck制造,并带有FDA最严厉的盒装警告,标志此药增加严重感染的风险,包括结核病和细菌性败血症。
Humira是世界上最畅销的处方药,自AbbVie从设备制造商雅培实验室分拆出来后的六年中,这种药物一直是其最大的收入来源。
AbbVie在11月降低了对Humira海外销售的预测,理由是欧洲的制药商包括Mylan NV和Biogen Inc.的激烈竞争。
( 汇众医疗 )
辉瑞利妥昔单抗仿制药Ruxience获FDA批准
7月23日,辉瑞公司(Pfizer)宣布FDA批准Ruxience(rituximab-pvvr)。
该药是Rituxan(利妥昔单抗)生物仿制药,用于治疗成人非霍奇金淋巴瘤(NHL)、慢性淋巴细胞白血病(CLL),肉芽肿伴多血管炎(GPA)、显微镜下多血管炎(MPA)。
此次批准基于综合数据审查,在数据证明Ruxience与参考产品相似性,与对照品相比,在安全性和疗效方面没有临床差异。
( Drugs )
FDA首次批准Lyrica的仿制版本,适用于多种神经系统疾病
7月23日,FDA宣布九家制药公司已获得第一批仿制品Lyrica(普瑞巴林)的批准。
Lyrica的仿制药已被批准用于治疗糖尿病周围神经病或脊髓损伤,带状疱疹后神经痛和纤维肌痛引起的神经性疼痛。
FDA还批准了通用版本作为17岁及以上患者部分发作性癫痫发作的辅助治疗。
FDA指出,普瑞巴林必须配发患者用药指南。
普瑞巴林具有血管性水肿,过敏反应,呼吸困难和喘息的风险,也可能引起外周性水肿。
如果迅速停止使用该药物,可能会出现癫痫发作频率增加或其他不良反应。
普瑞巴林可能会增加自杀念头或行为的风险。
( Drugs )
美国FDA初步批准Alembic Pharma生产血糖控制药物
7月23日,制药公司Alembic Pharmaceuticals表示,该公司已获得美国卫生监管机构的初步批准,可以生产有助于降低血糖水平的Dapagliflozin药片。
批准产品疗效相当阿斯利康公司Farxiga药物。
Alembic Pharmaceuticals在一份BSE文件中称,该公司已获得美国食品和药物管理局(USFDA)的批准,可生产5毫克和10毫克剂量的Dapagliflozin减肥药。
该文件还指出,Dapagliflozin可作为饮食和锻炼辅助品,可改善2型糖尿病成年人血糖控制。
( economictimes.indiatimes )
百特胰岛素药物Myxredlin获美国FDA批准
7月23日,百特公司宣布美国食品和药物管理局批准Myxredlin药物(0.9%氯化钠注射液中含有人体胰岛素),Myxredlin是第一个也是唯一一个现成的胰岛素静脉输液。
( 汇众医疗 )
Sunovion新药Latuda补充申请获FDA批准,治疗10至17岁躁郁症患者
近日,Sunovion制药公司提交的Latuda(lurasidone)新药补充申请(sNDA)获FDA批准。
该申请扩大了Latuda的使用范围,涵盖10至17岁1型双相情感障碍重度抑郁发作的儿童患者。
Latuda的扩大适应症批准得到针对10至17岁患有双相抑郁症的儿童和青少年的3期临床研究数据的支持。
在为期6周的随机、双盲,安慰剂对照研究中LATUDA与安慰剂相比对双相抑郁症状具有统计学显著和有临床意义的改善。
( 新浪医药 )
FDA批准MED-EL美国的人工耳蜗植入治疗单侧耳聋和不对称听力损失
7月23日,MED-EL公司宣布,FDA已批准该公司的人工耳蜗植入系统用于单侧耳聋和不对称听力损失。
这是人工耳蜗被FDA首次也是唯一一次批准用于这些适应症。
MED-EL人工耳蜗植入(CI)系统,包括SYNCHRONY和最近FDA批准的SYNCHRONY 2,适用于在一只耳朵中有严重的感音神经性听力损失,另一只耳朵有正常听力或轻度感音神经性听力损失,或者在一只耳朵中有严重感音神经性听力损失且轻度至中度严重感觉神经性听力损失的,5岁以上AHL患者。
( 汇众医疗
山东鲁抗首仿达格列净片上市申请获CDE受理
7月22日,根据新药研发监测数据库(CPM)显示,CDE受理了山东鲁抗达格列净片的上市申请,为我国首仿产品。
达格列净(dapagliflozin)由百时美施贵宝开发,后把全球销售权卖给阿斯利康。
首先于2012年11月12日获欧洲EMA首次批准,是全球第一个获批上市用于治疗2型糖尿病的SGLT2抑制剂。
( 新浪医药 等2家媒体报道 )
亚盛医药抗耐药CML新药HQP1351获美国FDA临床试验许可
7月22日,致力于在肿瘤、乙肝及与衰老相关疾病等治疗领域开发创新药物的处于临床阶段的研发企业亚盛医药宣布,公司日前收到美国药品监督管理局(FDA)通知,同意公司在研新药HQP1351直接进行临床Ib试验,将用于治疗针对 TKI(酪氨酸激酶抑制剂)耐药的慢性髓性白血病(CML)。
HQP1351 是亚盛医药在研原创1类新药,为口服第三代 BCR-ABL 抑制剂,靶向不同种类的 BCR-ABL 突变体,包括具有 T315I 突变的类型,用于治疗耐药性 CML 患者。
( 动脉网 )
政策一览

人事变更
前诺华、阿斯利康首席财务官Jonathan Symonds将接任GSK董事长
7
月24日,GSK宣布任命前诺华和阿斯利康首席财务官Jonathan S
ymonds为下一任董事长,任期于9月1日生效。
GSK正面临业务上的巨大转变,Symonds在一份声明中表示,GSK目前正在寻求“通过创新的研发方法创造价值”,并计划“创建和拆分两家新的世界领先公司”,一家专注于制药和疫苗,另一家专注于消费者健康业务。
Symonds每年将获得70万英镑的薪酬,其中现金部分为525,000英镑,其余收入以GSK股票的方式结算。
( 新浪医药 )
Verb Surgical宣布任命Kurt Azarbarzin为总裁兼首席执行官
7月24日,Verb Surgical Inc.宣布Kurt Azarbarzin已经加入该公司担任总裁兼首席执行官,立即生效。
Verily首席执行官Andy Conrad表示:
“通过Verb,我们正在开发一个旨在实现外科手术转型的综合技术平台。
Kurt的商业智慧和在微创手术领域的创新研发传统使他成为团队受欢迎的领导。
” ( 美通社 )
科技前沿
《Cell Systems》:
研究发现非整倍体细胞增殖缺陷新机制
7月24日,中国科学院遗传与发育生物学研究所钱文峰研究组与北京大学Lucas B. Carey研究组合作,构建近100株2n+x酵母株系,发现一些蛋白复合体所有亚基的整体加倍是导致2n+x细胞增殖缺陷的关键原因。进一步通过与遗传发育所汪迎春研究组合作开展质谱分析发现,这些蛋白复合体所有亚基的整体加倍使它们有机会逃脱蛋白质质量控制机制而导致过量的蛋白表达,那些单独加倍的亚基由于不能组装到蛋白复合体往往会被特异性降解。上述研究在Cell Systems杂志上在线发表。( 生物360 )
《Nature Communications》:
靶向老瓶颈开发新抗癌药
近日,埃默里大学Winship癌症研究所的科学家们已经确定了一种靶向核糖核酸还原酶的方法,这种方法可以避免以前方法的毒性,为药物研发提供了有针对性的信息,相关研究结果于近日发表在《Nature Communications》杂志上。( 新浪医药 )
《Nature》:
蛋白过度表达可能是癌细胞致命弱点
日前,在一项使用酵母细胞和癌症细胞系的研究中,约翰霍普金斯大学的科学家们报告说,他们发现在拥有额外染色体组的癌细胞中存在一个潜在的弱点。染色体组是携带遗传物质的结构。研究人员表示这种脆弱性根源于癌细胞的一个共同特征--细胞内蛋白质浓度高--这使它们看起来臃肿不堪,而且可能成为癌症治疗的新靶点,相关研究成果发表在《Nature》上。( 新浪医药 )
《国家科学院院刊》:
提供遗传性痉挛截瘫病理研究新视角
最近,香港科技大学助理教授郭玉松团队和中科院生物物理研究所教授胡俊杰团队发现,一种名为ATL的酶被用于调节细胞内蛋白质的运输。这一新发现为遗传性痉挛性截瘫的病理学研究提供新见解。相关论文刊登于美国《国家科学院院刊》。
内质网的管状结构由ATL接驳而成,研究人员消除ATL后,发现其内质网管道不但无法接驳,COPII的形成亦减少,影响其装载蛋白的效率,并严重减慢蛋白的运送速度。研究进一步发现,蛋白质的流动性以及 COPII的形成可透过一种经过异变、具有膜栓连而非融合功能的ATL来恢复。郭玉松表示:“ATL 介导的膜栓连在维持内质网内流动性方面有关键作用,期望该发现为该罕见疾病的治疗提供线索。” ( 生物360 )
体内基因编辑技术CRISPR将在美国开始临床试验,治疗Leber先天性黑蒙
2019年秋季,首次在美国开始的临床试验将使用体内基因编辑技术CRISPR,利用基因技术治疗被称为Leber先天性黑蒙的遗传性失明症。研究人员将使用一种在特定位置切割或“编辑”DNA的工具,为儿科和成年患者提供他们缺乏的基因的健康版本。该试验将包括美国各地的18人,由两家公司Editas Medicine和Allergan进行。Leber先天性黑蒙是遗传性儿童失明的最常见原因,每10万分娩中约有2至3例发生。( Drugs )
信达生物制药ORIENT-31试验开始,旨在评估Tyvyt®和IBI305联合化疗性
7月24日,信达生物制药(Innovent Biologics)宣布ORIENT-31试验已向第一名患者给药,该试验旨在评估Tyvyt®和IBI305联合化疗安全性和有效性。ORIENT-31研究是一项在中国进行的随机双盲多中心III期试验,480名先前参与过EGFR-TKI治疗的患者将参加该研究。Tyvyt®是一种与Eli Lilly and Company共同开发的单克隆抗体。IBI305是一种重组人源化抗血管内皮生长因子(抗血管内皮生长因子)单克隆抗体,能与化疗主干结合治疗表皮生长因子突变型非鳞状小细胞肺癌(NSCLC)。( biospace )
范德堡大学:
利用纳米粒子增强免疫细胞对抗癌症
近日,范德堡大学的研究人员在《Science Advances》发表了一种新技术,利用纳米粒子增强免疫细胞,帮助他们捕获通过血液迁移的癌细胞。该产物被称为TNF相关的凋亡诱导配体(TRAIL),由附着于脂质纳米颗粒表面的两种蛋白质以及称为E-选择蛋白的粘附受体组成。
一旦将这些纳米颗粒注入血液中,E-选择素就可以使它们粘附在白细胞上,使它们成为对癌细胞更有效的杀手。首席研究员Michael King说,“我们对在全国各地诊所接受治疗的癌症患者的数百份血液样本中进行了测试。在所有情况下,活的癌细胞在两小时内被清除。” ( New Atlas )
McMaster开发出一种抗菌凝胶,切割时可自行愈合
近日,McMaster大学研究人员开发出了一种新型凝胶,完全由噬菌体病毒制成。噬菌体能自发组装成液晶,并在化学粘合剂的帮助下,形成明胶状物质,切割后可以自愈。抗菌凝胶可以靶向攻击特定形式的细菌,有望在医学和环境保护中有许多有益的应用。开发者Zeinab Hosseini-Doust表示该凝胶可以用作植入物和人工关节的抗菌涂层,用作人体组织的无菌生长支架,或用于环境清理操作。Hosseini-Doust实验室的博士生雷坦说,“我们需要新的杀灭细菌的方法,噬菌体是有前途的替代方法之一。” ( eurekalert )
普渡大学团队设计解毒剂自动输送装置,可逆转阿片类药物服用过量
近
普渡大学生物医学工程助理教授Hyowon Hugh Lee的团队提出了一种简单低成本微创的解毒剂自动输送装置(A2D2),可以在检测到阿片类药物过量引起的呼吸衰竭时给予大剂量的纳洛酮。纳洛酮是一种安全有效的阿片拮抗剂,可以逆转过量阿片类药物服用过量。因为在过程中出现了少量泄漏(1.75%的有效载荷),Hyowon Hugh Lee表示需要进一步的研究来验证设备的长期稳定性,并证明闭环释放机制对阿片过量服用有效。阿片类药物过量现在是50岁以下美国人死亡的主要原因,2017年约有48,000人因此死亡。( eurekalert )














