1、
中山大学肿瘤防治中心马骏教授团队等人在首次在
柳叶刀(IF=53)
发表专题文章

鼻咽癌是由鼻咽粘膜衬里引起的上皮性癌症。在鼻咽,肿瘤常出现在咽凹窝。尽管鼻咽癌起源于相似的细胞或组织系,但与其他头颈部上皮性肿瘤有明显的不同。
与其他癌症相比,鼻咽癌相对少见。根据国际癌症研究机构的数据,2018年,鼻咽癌新发病例约为129000例,仅占2008年确诊病例总数的0·7%,但其地理分布极为不平衡;超过70%的新病例发生在东亚和东南亚,年龄标准化率(世界)在中国为3/100000,在以白人为主的人口中为0·4/100000。
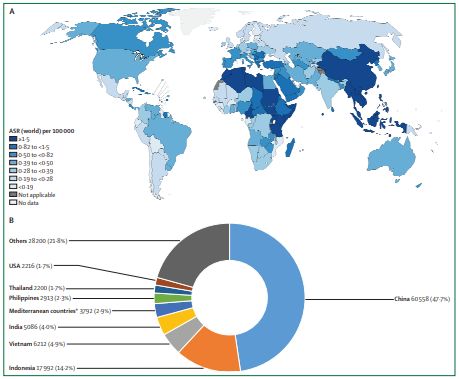
2018年鼻咽癌的全球分布
在过去几十年中,鼻咽癌发病率在全球范围内逐渐下降:南亚和东亚、北美的发病率大幅下降。以北欧国家为例,香港自八十年代以来,每年平均变化约为-1%至-5%.,香港的发病率稳步下降,在20年内,整体下降约30%;在2000-11年期间,广州市区的男性平均年变化率为-3%,女性为-5%。生活方式和环境变化很可能是造成这一变化的原因。
男性鼻咽癌发病率高于女性,2015年7月,中国的发病率约为2·5。值得注意的是,中国南方地区的人在移民到非地方病地区后仍有较高的发病率,但第二代移民的发病率有所下降。随着人口迁入的越远,发病率也有下降的趋势。这些发现表明,遗传、种族和环境因素的结合可能影响鼻咽癌的发病。
2、中山大学首次在顶级医学期刊NEJM(IF=79)发表长文,开发新的方案治疗局部进展期鼻咽癌

鼻咽癌是一种具有特定地理分布的头颈癌,在2018年,鼻咽癌影响了全球约130000名患者,其中中国华南地区,东南亚和北非地区的患病率最高
。超过70%的患者在诊断时被诊断为局部进展期疾病,并且在该亚组中对于预后不良的患者,同时使用铂类药物进行放化疗是治疗的主要选择,化学疗法使肿瘤对放疗的毒性作用敏感。
远处转移占疾病复发模式的主导地位,约占70%患者的癌症特异性死亡率。
已经研究了化学疗法作为化学放射治疗的诱导或辅助方案的加入。放化疗后全身治疗的毒性仍然是一个相关的问题,
一项随机对照试验的长期结果支持诱导化疗的使用,其中多西紫杉醇,顺铂和氟尿嘧啶加入局部进展期鼻咽癌患者的放化疗中,患者的总生存期延长。
之前的2期试验表明,吉西他滨联合顺铂是鼻咽癌患者的有效化疗方案,并已被确定为顺铂加氟尿嘧啶治疗复发或转移性疾病的首选治疗方法。但是,
在新诊断,非转移性,局部进展期疾病的背景下,吉西他滨联合顺铂诱导放化疗的疗效和安全性尚不清楚。
因此,该研究进行了一项
多中心,随机,对照,3期临床试验
,以研究局部进展期鼻咽癌患者中加入吉西他滨联合顺铂对化放疗的疗效和安全性。该研究比较了单独使用放化疗(标准治疗组)或者是吉西他滨和顺铂作为诱导化疗加放化疗的治疗效果(试验组)。 该研究的主要终点是意向治疗人群的
无复发生存期
(即无疾病复发[远处转移或局部复发]或任何原因引起的死亡)。 次要终点包括总体存活率,治疗依从性和安全性。
该研究共纳入480名患者(诱导化疗组242名,标准治疗组238名)。中位随访时间为42.7个月
研究结果发现,同期
放化疗前增加吉西他滨+顺铂(GP方案)诱导化疗,可将3年无瘤生存率从76.5%提高到85.3%,3年总生存率从90.3%提高到94.6%。同时,GP诱导化疗方案十分安全,超过95%的患者可以顺利完成3程诱导化疗;GP诱导化疗期间,仅5%的患者出现4度副作用;并且也没有增加患者治疗后患合并症的风险。
总而言之,
GP诱导化疗联合同期放化疗可以明显降低患者远处转移风险,进而提高无瘤生存、总生存。结合患者在治疗期间毒性反应小、耐受性好
,研究人员相信,
此治疗模式未来会被国际指南采纳,成为局部进展期鼻咽癌的标准治疗方案之一。
这项临床研究于2013年在中山大学肿瘤防治中心启动(主要研究者:马骏教授),联合华中科技大学附属同济医院(胡国清教授)、佛山市第一人民医院(张宁教授)、广西医科大学附属肿瘤医院(朱小东教授)、华中科技大学附属协和医院(杨坤禹教授)、贵州省肿瘤医院(金风教授)、第四军医大学附属西京医院(石梅教授)、中山大学附属第五医院(程志斌教授)、苏州大学附属第二医院(田野教授)、广东药科大学附属第一医院(王希成教授)、北京大学附属肿瘤医院(孙艳教授)和江西省肿瘤医院(李金高教授)共同参与。
3.
中山大学马骏团队在国际著名医学期刊BMJ(IF=23)发表肿瘤免疫最新成果

最近10年,免疫检查点抑制剂相关的临床试验如雨后春笋般在全世界广泛开展,产生了大量的高质量证据。基于免疫检查点抑制剂的多种治疗模式,如免疫检查点抑制剂单药、不同免疫检查点抑制剂药物联合使用、免疫检查点抑制剂联合传统治疗展现出了强大的抗肿瘤疗效,为攻克癌症带来了曙光。
免疫检查点抑制剂通过阻断表达于肿瘤细胞和/或免疫细胞表面的具有负性调控作用的蛋白小分子(如PD-1, PD-L1, CTLA-4),解除肿瘤细胞对免疫系统的抑制,从而激活自身免疫产生独特的抗肿瘤的疗效。针对以上负性调控分子,多种免疫检查点抑制剂药物被成功研制,如抗PD-1的O药(nivolumab)、K药(pembrolizumab),抗PD-L1的T药(atezolizumab),抗CTLA-4的Y药(ipilimumab)。
免疫检查点抑制剂在研制和上市方面均得到加速批准,并能快速应用到临床实践中惠及广大肿瘤患者。然而,在得到鼓舞的同时我们不得不考虑一个令人担忧的问题:免疫检查点抑制剂的毒性研究的进展相对落后,在缺乏足够安全性证据的情况下使用免疫检查点抑制剂可能会为患者带来疗效的同时也带来风险。因此,系统地、全面地、深入地探究不同免疫检查点抑制剂的毒性谱特征、毒性事件发生率、以及安全性排名迫在眉睫。
2018年11月8日,我校肿瘤防治中心马骏教授团队最新的一项肿瘤免疫研究结果在国际著名四大医学综合期刊之一的The BMJ杂志(2018年影响因子23.26)上在线发表。
该项大型网状荟萃分析研究共纳入了36项(共15,370人)采用头对头比较设计的II/III期临床试验,比较了不同类型、不同药物、不同剂量的免疫检查点抑制剂(ICI)在安全性方面的优劣,详细绘制了免疫检查点抑制剂的“毒性与安全性排行榜”。该研究有助于临床医生深入了解不同免疫检查点抑制剂药物的毒性特征,为免疫检查点抑制剂所致毒性的预防、早期识别及干预提供可靠的依据。
马骏教授团队从6个层面详细地进行了探索。一是“剂量层面”,探究相同免疫检查点抑制剂药物的不同剂量对安全性的影响;二是“类别层面”,探究同一种类免疫检查点抑制剂的不同药品类别以及不同免疫检查点抑制剂疗法对安全性的影响;三是“严重程度层面”,探究不同免疫检查点抑制剂在“所有等级毒性”和“严重毒性(3-4级毒性)”发生方面的差异;四是“详细程度层面”,探究不同免疫检查点抑制剂在具体的毒性事件(如肺炎、肝损害、甲低等等)上的安全性差异;五是“肿瘤层面”,探究免疫检查点抑制剂在不同瘤种(肺癌、黑色素瘤)中所致毒性的差异;六是“数据层面”,严格筛选头对头设计的II/III期临床试验数据进行荟萃分析,再利用高质量的安慰剂对照试验和单臂试验数据进行验证。
根据研究结果,免疫检查点抑制剂在“所有等级毒性”和“3-4级毒性”方面的安全性排序由高到低均为:阿特朱单抗、纳武单抗、帕姆单抗、伊匹单抗、tremelimumab。具体而言,相较于传统治疗,免疫检查点抑制剂所致毒性主要体现在皮肤、内分泌系统、肝脏和肺。单药免疫检查点抑制剂(除tremelimumab外)相较于免疫检查点抑制剂药物联用或免疫检查点抑制剂联合传统治疗具有更高的安全性。
毒性谱方面:tremelimumab 的毒性谱最广最严重,或可导致严重的皮肤、消化系统、内分泌系统不良事件;阿特朱单抗虽然在安全性排行榜上列第一位,但其具有最高的致甲低、恶心、呕吐的风险;帕姆单抗主要导致关节痛、肺炎、肝脏毒性;伊匹单抗所致毒性主要体现在皮肤瘙痒、结肠炎、肾脏毒性纳武单抗的毒性谱最窄最温和,而致甲亢和甲低风险稍高。
综合证据发现:纳武单抗在安全性方面——尤其对于肺癌患者——是最佳的选择。此外,本研究还发现:同一免疫检查点抑制剂药物药物的不同给药剂量在其所致毒性方面一般没有显著差异,但伊匹单抗10 mg/kg/3 wk的风险显著高于3 mg/kg/3 wk。
该研究是马骏教授团队关于肿瘤免疫治疗领域的一项重要研究,其内容详实,完成度高、方法学扎实,研究结果得到了香港、台湾、法国、美国的多位知名统计学、肿瘤学、免疫学专家的认可,为临床合理使用免疫检查点抑制剂提供了高级别的循证医学证据。