点击蓝字,关注我们 」
骨肉瘤是年轻人最可怕的骨肿瘤之一,需要开发创新疗法,以有效消除肿瘤,同时最大限度地减少对肢体功能的损害。理想的治疗策略应具备三个基本能力:抗肿瘤作用、组织保护特性和增强成骨的能力。在这项研究中,合成了自组装的 Ce-取代钼蓝(CMB)纳米轮晶体并将其加载到3D打印的生物活性玻璃(CMB@BG)支架上,以开发一种独特的三合一骨肉瘤治疗方法。由于 CMB 纳米轮晶体的表面等离子体共振特性,CMB@BG支架在近红外II窗口内表现出出色的光热衍生肿瘤消融。此外,CMB的光热协同催化作用促进了由过热引起的活性氧的快速清除,从而抑制炎症并保护周围组织。CMB@BG支架具有促增殖和促分化能力,可有效加速骨缺损内的骨再生。总而言之,CMB@BG支架结合了高效的肿瘤消融、基于抗炎机制的组织保护和增强的成骨能力,很可能成为骨肉瘤综合治疗需求的点对点解决方案。该研究以题为“
Photothermal Catalytic Reduction and Bone Tissue Engineering Towards a Three-in-One Therapy Strategy for Osteosarcoma
”发表在
Advanced Materials
上(DOI: 10.1002/adma.202408016)。

骨肉瘤是<25岁个体中最常见的原发性恶性骨肿瘤。骨肉瘤的典型治疗策略包括手术切除肿瘤和瘤周组织,以及手术前后由多种化疗药物组成的新辅助化疗。尽管综合治疗策略可有效改善骨肉瘤的不良预后,骨肉瘤的侵袭性和手术引起的广泛骨缺损继续威胁着生存和生活质量。鉴于骨肉瘤的临床治疗策略在过去三十年中没有发生根本性变化,解决实现更宽的手术切缘以完全去除肿瘤细胞与获得最大程度的外周组织保留以保留肢体功能之间的矛盾仍然具有挑战性。迫切需要探索新的治疗策略,以协调有效的肿瘤消除和理想的骨缺损修复,以进一步改善骨肉瘤的临床结果。
骨组织在一定程度的损伤后可以完全再生。然而,缺损大小在很大程度上限制了骨组织的自我修复能力,由肿瘤浸润或治疗性切除引起的大骨缺损往往超过临界大小,难以实现自发修复。具有成骨、成骨和成骨诱导特性的生物活性材料已被开发用于填充骨折末端之间的间隙,以帮助大骨缺损中的骨组织再生。生物活性玻璃(BGs)因其优异的生物相容性、适当的骨传导特性和一定的骨诱导特性而被广泛用作大面积骨缺损的有前途的植入物。此外,结合先进的3D打印技术,所得的3D打印BG支架可以纵向成型,以适应个别骨缺损患者的外观。因此,工程化具有肿瘤消融和骨修复能力的多功能植入支架对于最大限度地减少手术切缘和同时最大限度地提高肿瘤清除率至关重要。
作为一种新兴的肿瘤消融策略,光热疗法(PTT)已被广泛用于治疗各种恶性肿瘤,已被证明是一种实用的抗肿瘤策略,侵入性最小,全身不良反应可忽略不计。然而,PTT中的近红外(NIR)激光诱导的热疗可能是一把双刃剑,可以消除肿瘤细胞并激活瘤周组织中的不利炎症反应。PTT相关炎症肯定可能是导致肿瘤复发、医源性创伤和治疗耐药性的一个因素,这阻碍了PTT在进一步临床应用中的蓬勃发展。因此,迫切需要一种将高肿瘤消融率与有效抑制炎症反应相结合的实用策略,以实现PTT的广泛应用。
与PTT相关的无菌性炎症涉及多个生物过程,包括促炎细胞因子的释放、炎症细胞的聚集和活化的细胞信号通路。在桥接PTT和不利炎症的因素中,过量活性氧(ROS)的产生对于炎症激活至关重要;因此,抗氧化策略已被广泛用于治疗急性和慢性炎症性疾病。ROS的压倒性产生会阻碍组织愈合过程中的细胞增殖和分化。多金属氧酸盐(POM)是一类特殊的分子簇,由一种或多种过渡金属(Mo、W、V和Nb)和氧原子组成。由于其变体结构具有增强的 NIR吸收,POM纳米团簇作为有前途的PTT治疗肿瘤的纳米药物而受到广泛关注和炎症性疾病。然而,由于POM对正常组织的不良副作用和POM的质量浓度相对较高,因此尚未进行POM的临床研究。因此,探索具有出色ROS清除能力和对正常组织可忽略不计的副作用的创新POM对于更安全、更有效的骨肉瘤治疗至关重要。钼蓝(MB)纳米团簇是具有精细轮形结构的典型POM。MB轮子的精致架构通常由{Mo8}个单位(以五边形{Mo(Mo)5}单位)并与{Mo2}和{Mo1}单元作为结构键。NIR诱导的光热转化与POM纳米团簇的催化氧化还原活性的结合不是分裂的,而是整体的。POM纳米团簇的NIR照射在活性位点引起光热转导,从而在催化中心提供原位热源,与典型的热或光增强反应相比,获得出色的催化效率。在这种情况下,钼蓝(CMB)的光热增强催化活性可以用作对冲热诱导组织损伤。在MB的轮形结构中,Ce离子可以很容易地被{Mo2}单位通过简单的一锅反应过程获得Ce掺杂的MB纳米团簇。合成的 Ce掺杂MB纳米团簇继承了对称的轮状结构,引入的Ce离子表现出较强的ROS清除能力和增强的成骨能力,它有可能消除PTT诱导的炎症并促进骨骼再生。
在这项研究中,设计并报道了新型铈取代的CMB负载3D打印生物活性玻璃(表示为 CMB@BG)支架。CMB在近红外II(NIR-II)窗口中表现出非凡的光热效应,并表现出理想的ROS清除能力,这使得通过抑制升高的ROS水平和随后的炎症反应来结合对骨肉瘤的有效PTT和保护周围组织。CMB@BG支架在体外正向调节骨髓来源的间充质干细胞(BMSC)的成骨分化,并加速体内大骨缺损的再生。因此,具有NIR-II激活光热效应、抗氧化诱导的抗炎能力和增强成骨能力的CMB@BG支架是骨肉瘤的开创性治疗策略。
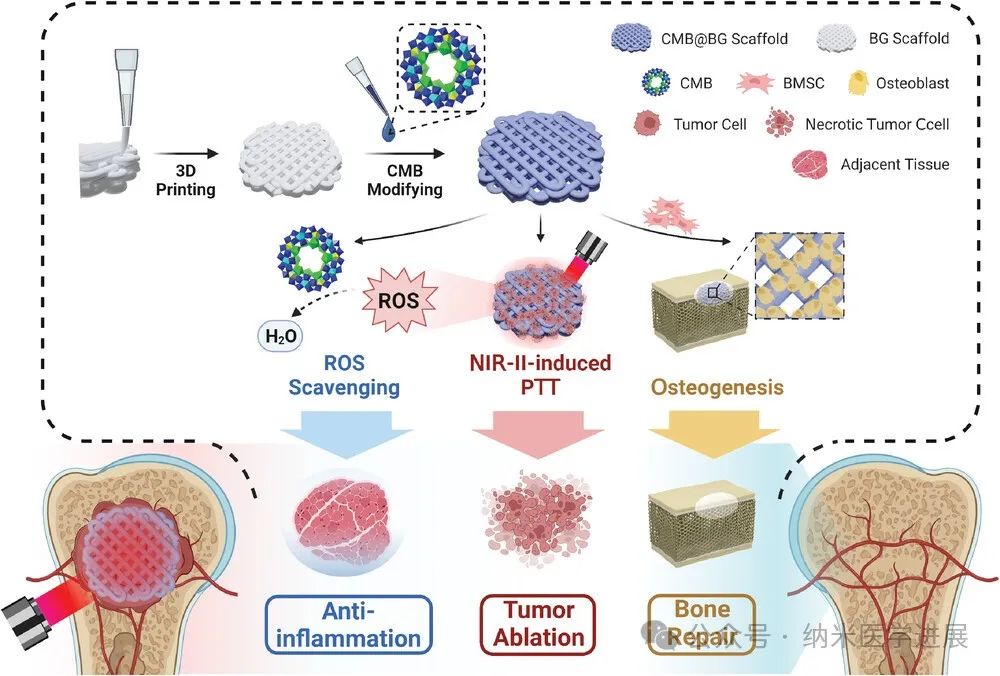
图1.
CMB@BG支架的示意图。
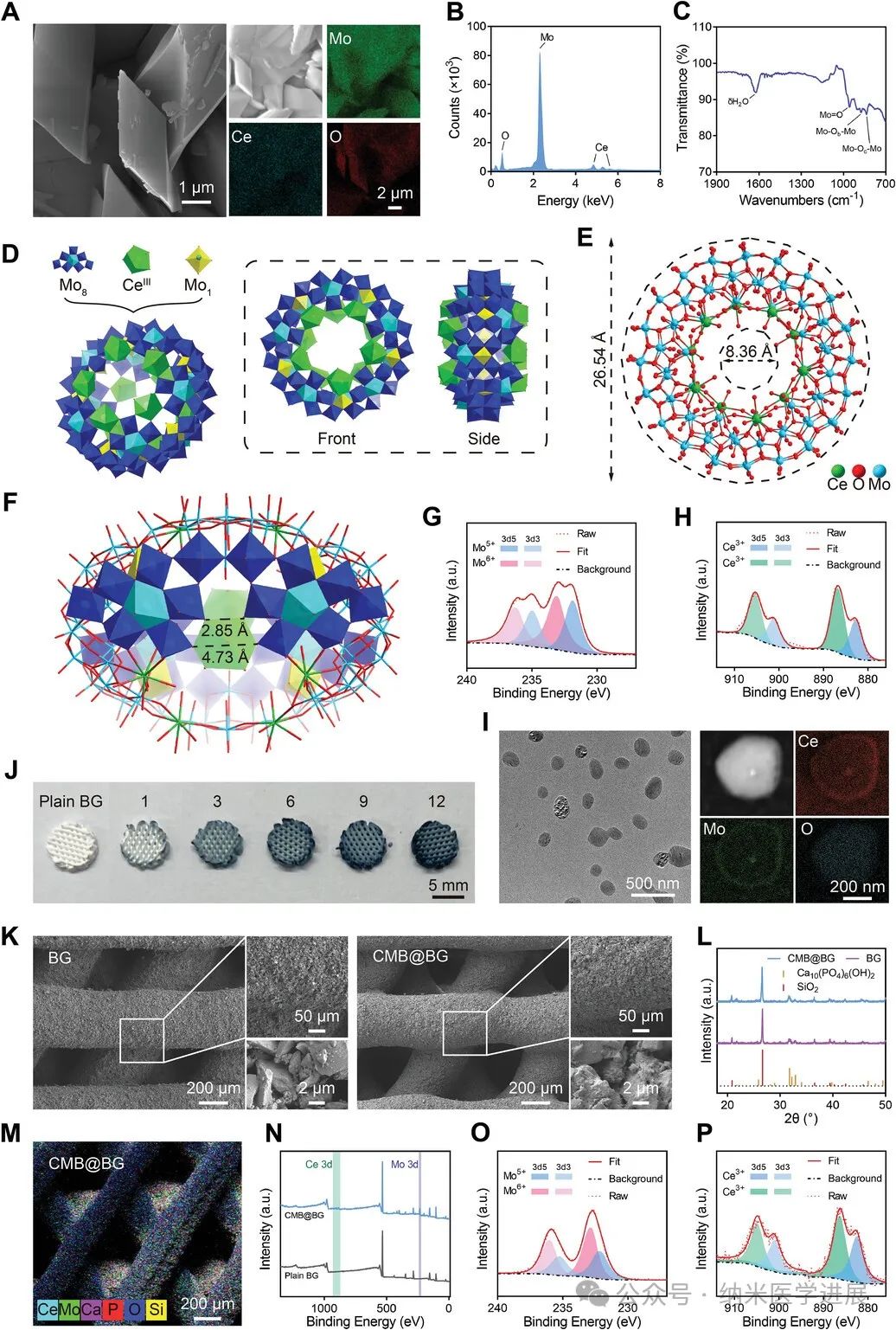
图2.
CMB和CMB@BG支架的表征。
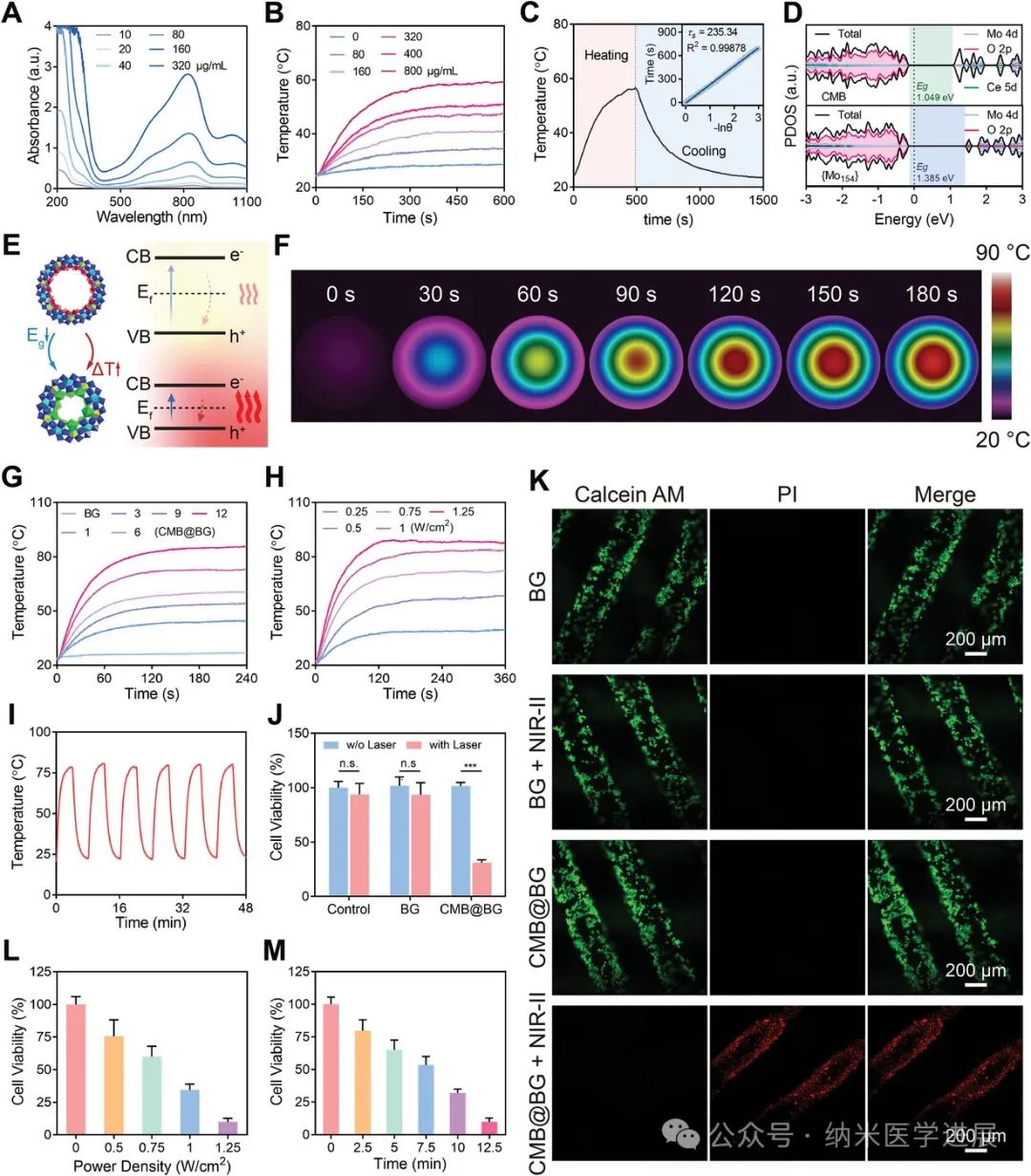
图3.
光热特性和体外PTT诱导的CMB@BG肿瘤细胞消融。
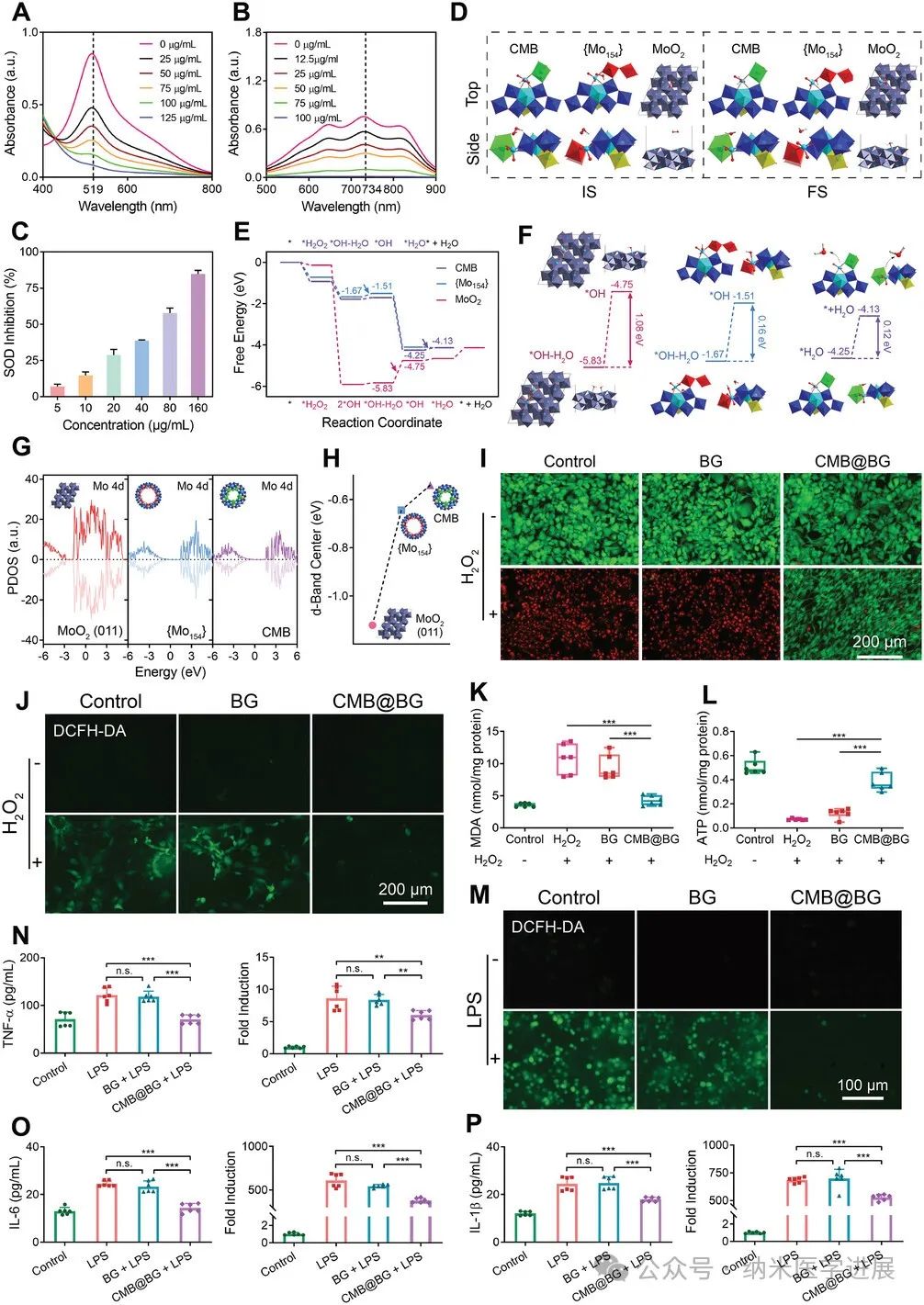
图4.
ROS 清除和导致CMB@BG的体外抗炎行为。
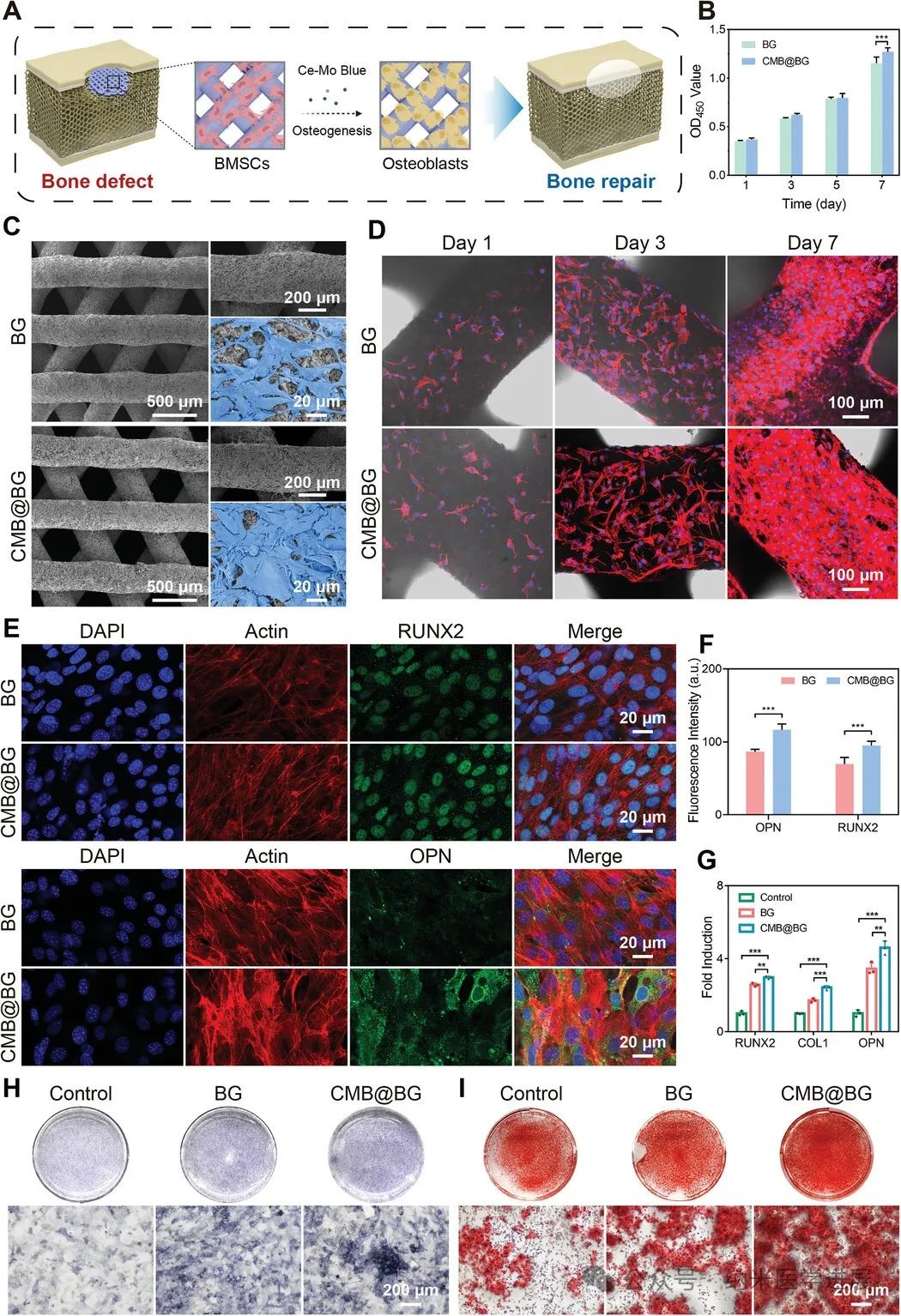
图5.
体外接种在CMB@BG支架上的BMSCs的细胞增殖和成骨分化。
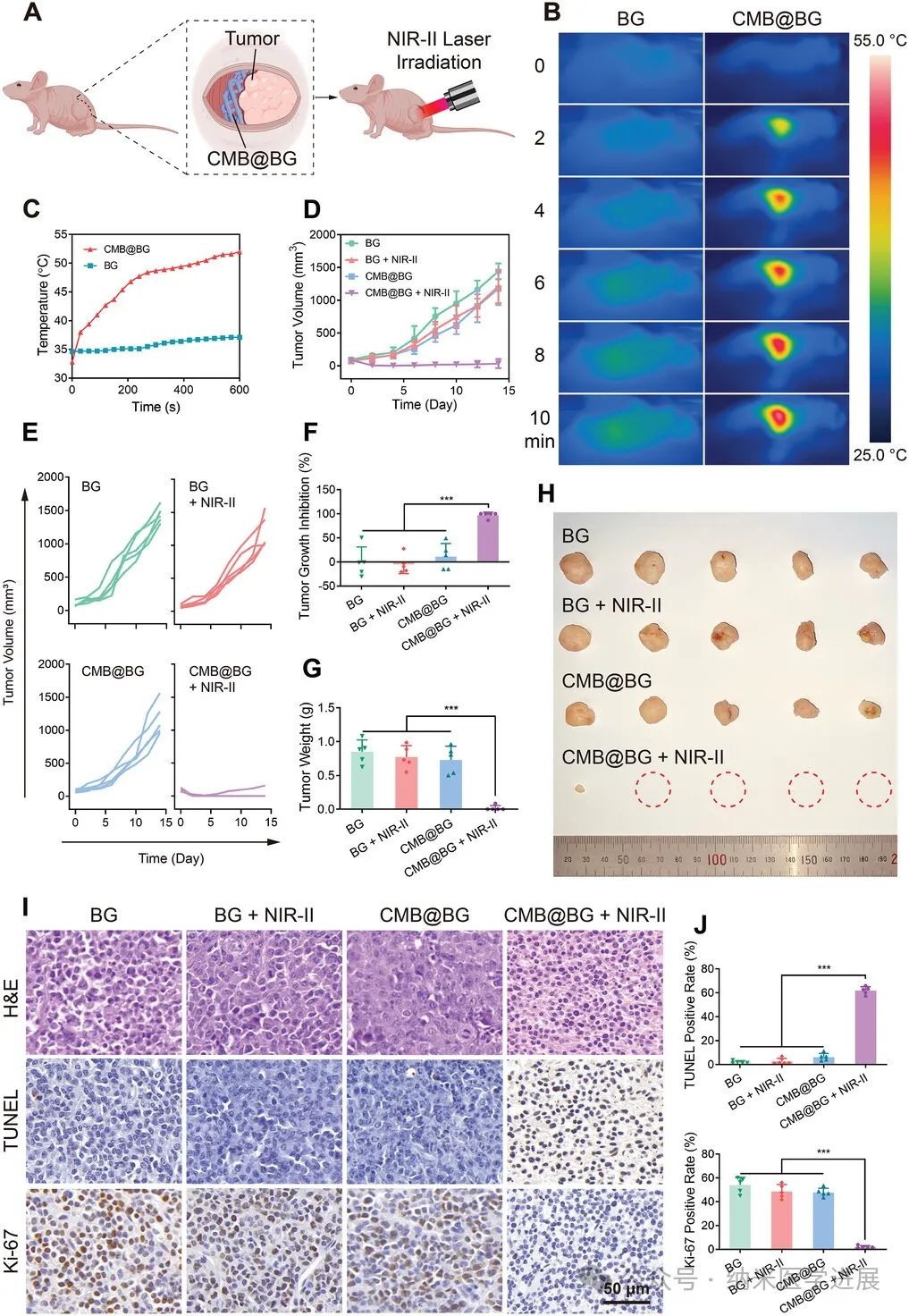
图6.
PTT诱导的体内植入CMB@BG的荷骨肉瘤小鼠肿瘤消融。
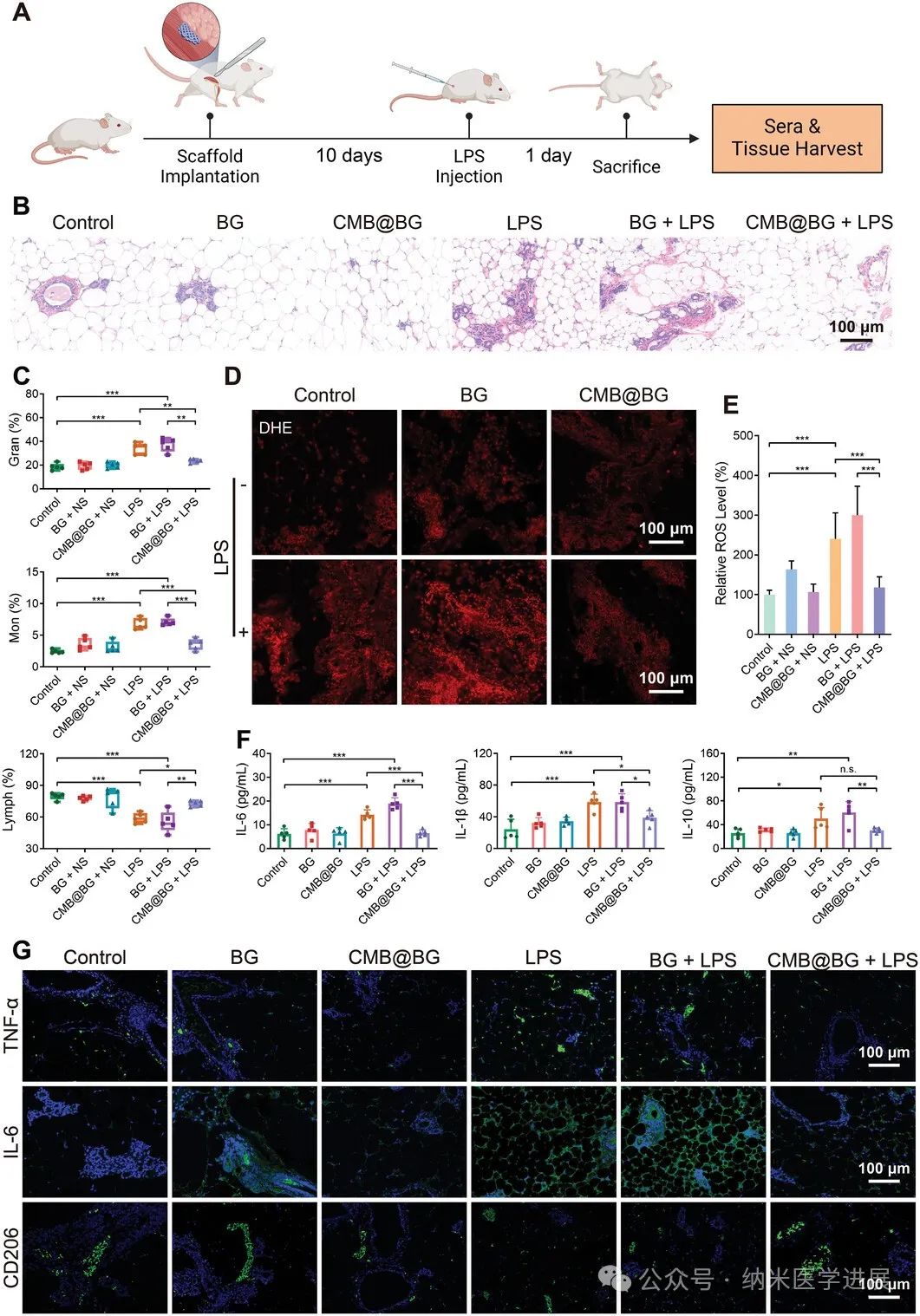
图7.
体内CMB@BG的抗炎作用。
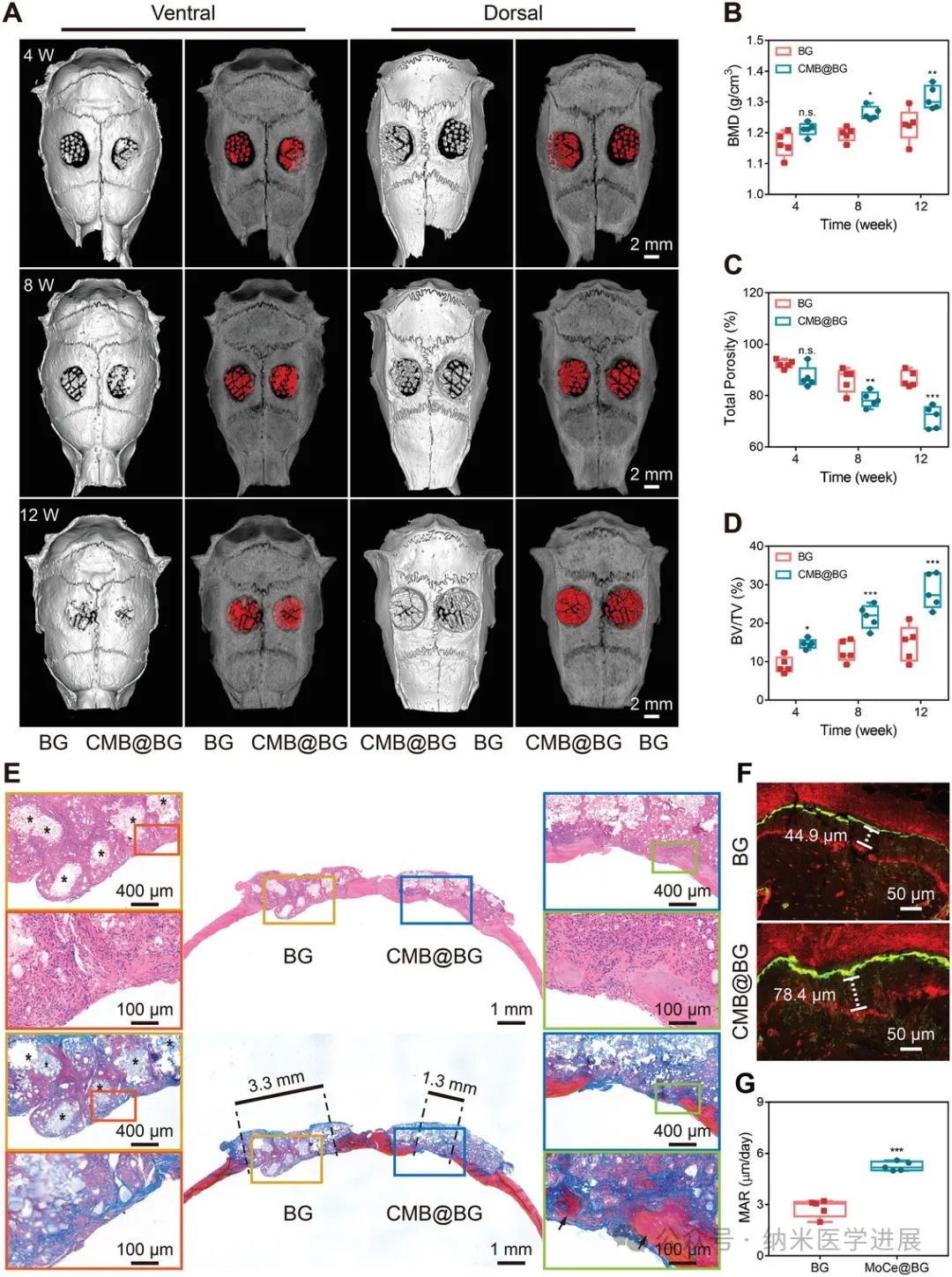
图8.
CMB@BG支架在体内的成骨功效。
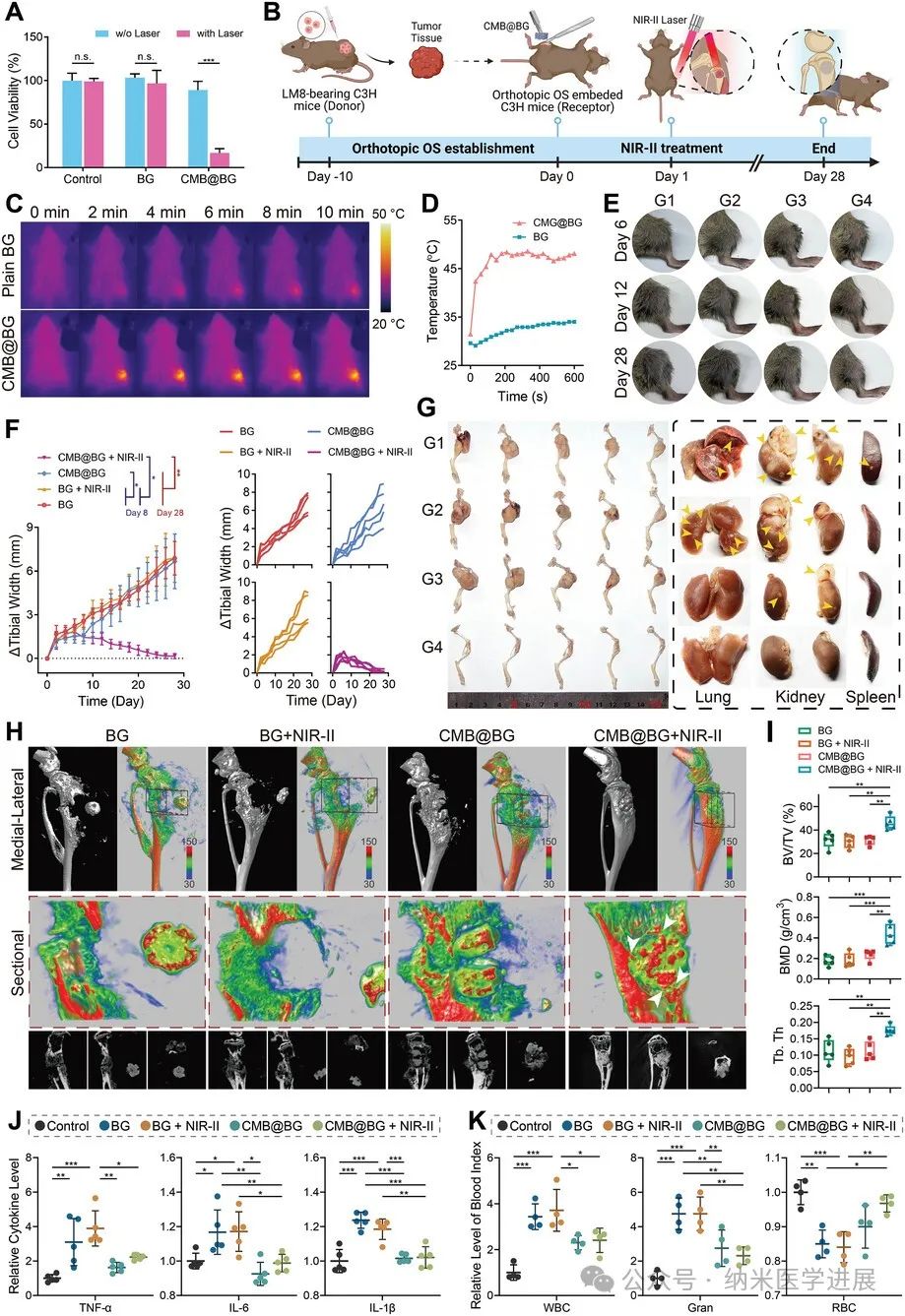
图9.
CMB@BG支架在原位骨肉瘤动物模型中的三合一治疗效果。
结论
治疗骨肉瘤的理想治疗策略可以概括为三个部分:根除肿瘤、保护健康组织和修复骨缺损。在此,我们开发了独特的3D打印CMB@BG支架,具有多种功能,可平衡高效的PTT诱导的肿瘤消融、对周围组织的保护作用和增强的成骨能力。具有高生物相容性的多孔3D打印BG支架为支持细胞粘附和桥接骨缺损提供了基础。同时,
Ce
3+
的取代导致了SPR性能的改善为PTT诱导的肿瘤消融奠定了基础,从而促进了PTT诱导的肿瘤消融。CMB的光热增强催化作用显著提高了ROS清除能力,可用作对冲热诱导组织损伤。DFT 计算表明,CMB在H
2
O
2
的速率确定步骤中具有较低的自由能变化切割过程,计算的PODS曲线进一步显示Ce
3+
取代上移了CMB中多价Mo的
d
带中心,导致中间物质的吸附能增加,从而提高了整体ROS切割能力。CMB的有效ROS清除能力在体外和体内均得到验证,有助于抑制PTT过热引起的不良炎症反应。CMB@BG具有生物相容性,在成骨分化试验中观察到CMB@BG的显着成骨能力,表明骨缺损恢复增强。由于其精心设计的结构和出色的生物性能,CMB@BG在为治疗骨肉瘤而开发的其他生物支架中脱颖而出。CMB@BG率先将肿瘤消融、增强成骨和抗炎组织保护结合在一个平台中,使其成为与骨肉瘤相关的复杂病理变化的综合解决方案。这些3D打印的CMB@BG支架解决了骨肉瘤治疗的迫切需求,作为平衡清除、保护和修复的理想三合一对策。此外,它们还为骨肉瘤治疗的综合治疗策略提供了开创性的见解。
论文链接
:https://doi.org/10.1002/adma.202408016
申明
:本微信号转发内容仅做学术交流使用,不作为商业用途,也不代表支持或赞同其观点,如涉及知识产权保护问题或其他方面的问题请及时联系小编,我们会尽快协调处理。本微信号原创文章版权归本微信号所有,欢迎分享到朋友圈等非媒体上。
本公众号另建有纳米医学
实名学术交流群
,请备注姓名+单位+研究方向添加下方微信号,
否则不予通过。