通过灵巧接头桥接的抗体-药物偶联物(ADC)具有改进的治疗窗,可高效靶向肿瘤细胞和组织。蛋白质工程、接头化学和新的细胞毒性载荷的发展预示ADC成为个性化医疗的安全有效的抗癌疗法。
抗体药物偶联物(ADCs)包含高亲和力抗体和通过合适接头偶联的细胞毒性载体。ADC已经成为靶向癌症治疗的更强大工具,其“药物:抗体比”(DAR)也已得到改善,临床试验数量也有很大增加。
ADC可选择性和持续性地将细胞毒性药物递送至肿瘤。它的三个主要组分为抗体、细胞毒性剂和接头。许多单克隆抗体是实体瘤和血液癌症的标准疗法,而原始化疗药物由于其非特异性毒性而对癌症治疗作用有限。ADC的发现填补了二者的缺口。Mylotarg是FDA首批批准的ADC,用于急性骨髓性白血病。Adcetris是CD30抗体和单甲基阿里他汀E的偶联物,被批准用于治疗淋巴瘤。Kadcyla已被商业化用于HER-2阳性转移性乳腺癌。ADCs面临的挑战包括抗体免疫原性、抗原表达、药物过早释放等,生物工程的进展已改善了其安全性和有效性。
靶向抗原是最重要的决定因素,其理想特征是:1在肿瘤中比在健康组织中有更高表达;如Adcetris在成熟和未成熟骨髓细胞表面的表达在所有AML患者中都是高的。2在配体存在下通过内吞作用抗原被内化,并循环回到质膜。ADC的内化效率取决于抗体的选择,抗原的表位和靶标的类型。不过有研究表明ADC的内化不是必须的,如SIP-F8-SS-DM1。3肿瘤微环境中均质的抗原表达和循环中低抗原丰度。每个细胞10000个抗原是所需的最小抗原数。此外ADC的抗体偶尔能诱导抗原介导的抗癌活性。用ADCs靶向肿瘤抗原的其他挑战包括高的间质瘤压力,生理和动力学能障,以及旁观者效应。
要点包括抗原亲和力,靶向特异性,良好的保持性,最小的免疫原性,低交叉反应性以及沿血浆循环。目前大多数用于人类的Abs是人源化的或更适合于人的。临床试验的ADC中的大多数Abs是人免疫球蛋白(Ig)-G同种型特别是IgG1,它可以比其他抗体更多地引发Ab依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)相关的肿瘤细胞杀伤,如Kadcyla中的曲妥珠单抗。此外双特异性抗体可靶向肿瘤细胞和肿瘤相关免疫细胞两种抗原,但目前大部分仍在临床前研究中。
接头很关键,它对于ADC的治疗指数,功效和药代动力学有重要影响。其特征是:1
稳定性
,保持循环中的Ab浓度,防止药物提前释放、脱靶等。2一旦进入细胞,接头要
易于裂解
,快速释放所携带的细胞毒性药物分子。3
好的DAR值
(药物抗体比),能稳定连接大量药物分子,产生均质性的ADC。目前DAR值以接近4为目标。
可切割接头
:腙,二硫键和肽。它们分别对应于低pH敏感性,谷胱甘肽敏感性和蛋白酶敏感性。肽接头比其他两种更稳定,如Adcetris中组织蛋白酶B敏感的二肽键(缬氨酸-瓜氨酸)。另外聚乙二醇化的β-葡萄糖醛酸苷接头虽然DAR值较高,但尚需更多研究。
不可切割接头
:包含不可裂解的硫醚或马来酰亚氨基己酰基(mc),它们依赖于ADC内化后的溶酶体酶促降解来释放细胞毒性载体,例如Kadcyla的一硫醚接头。
1.高效的治疗指数,在低剂量下也有效。对癌细胞杀灭作用强大,而不杀死健康细胞。
2.在血液循环中稳定(由于经静脉给药)
。
3.能与接头偶联,同时保留Ab的内化特性并促进其抗肿瘤作用
。
4.分类:微管抑制剂、DNA合成抑制剂、扑异构酶抑制剂。
阿里他汀:
有丝分裂抑制剂,基于多拉司他汀-10的奥司他丁类似物,Adcetris基于阿里他汀。
美登素衍生物
(
DM)
:微管抑制剂。Kadcyla是DM连接的HER-2靶向ADC,用于HER-2阳性转移性乳腺癌。
卡奇霉素
:抑制DNA复制。临床试验中针对ALL和非霍奇金淋巴瘤研究了CMC-544。
倍癌霉素
:靶向DNA的小沟,BMS-936561(MDX-1203)正在进行I期临床试验。CC1065偶联的ADC对多药耐药细胞系有效。
鹅膏毒
肽:
结合RNA聚合酶II,ChiHEA125-Ama是将anti-EpCAM与α-鹅膏菌素ADC相连。
其他ADC有效载荷
:有PBD和Centanamycin(吲哚酰胺)衍生物,是DNA复制抑制剂。PBD可避免出现耐药性
。
多柔比星:
DNA合成抑制剂。相关药物为IMMU-110,已经过I/II期临床试验。
开发新的细胞毒性药物的主要挑战是应具有较高的治疗指数
。
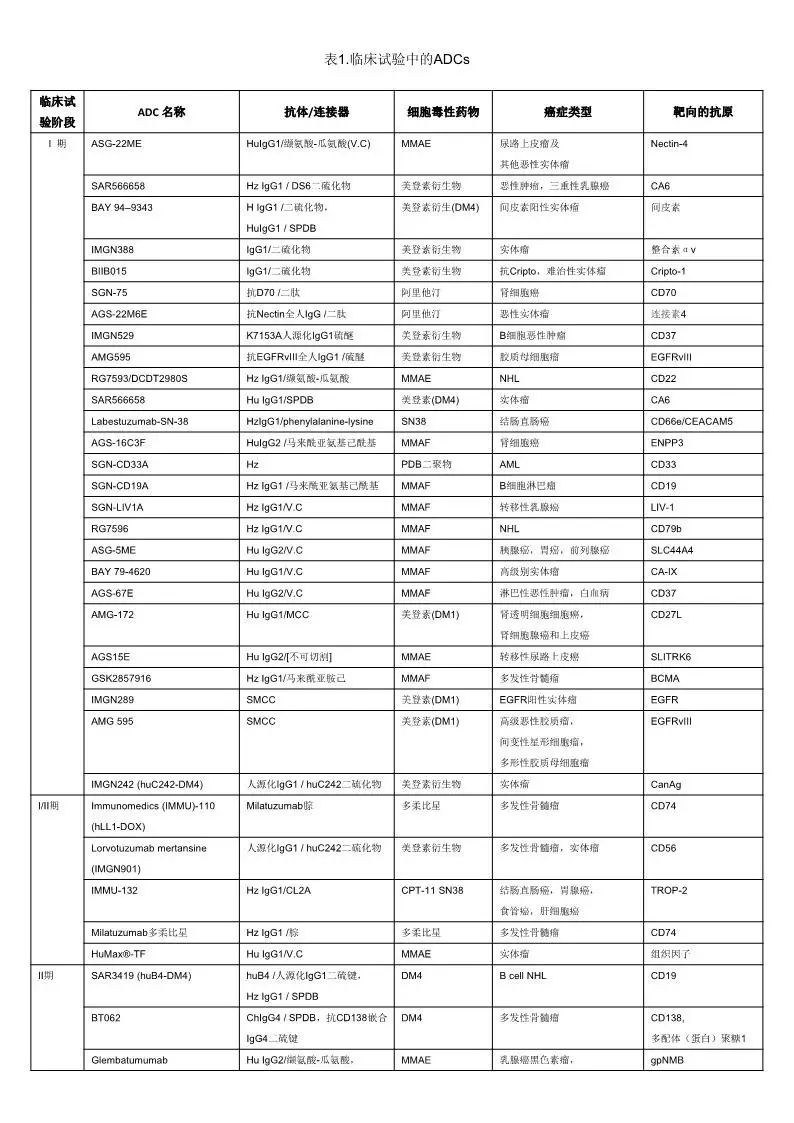
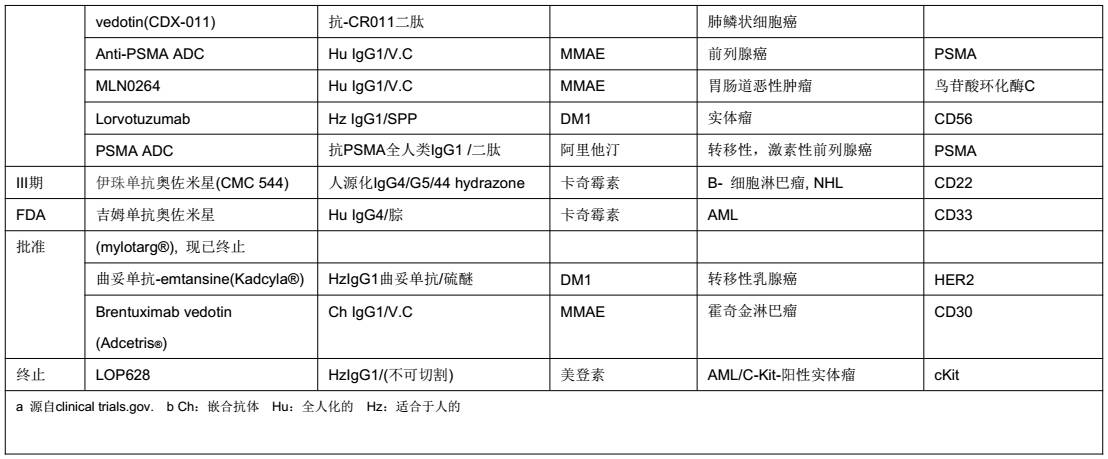
多样化、新型的更安全的ADC。
第一代ADC
:鼠源抗体,有较大免疫原性,抗原特异性低,毒性载荷不够强大,接头不稳定。相关药物Mylotrag已撤市。
第二代ADC
:比第一代接头稳定,毒性载荷更有效,但基于随机耦合策略而使其DAR有异质性,药物稳定性低,非特异性毒性增加,ADCs半衰期减少。
第三代ADC
:位点特异偶联(硫桥法、引入非天然氨基酸、酶促策略),拥有均质、单一性ADC,更有效的细胞毒性载体等。目前有四种含PBD的ADC正在I、II期临床试验中。
偶联技术、Ab生物工程以及有效药物鉴定等的重大进展使ADC疗效更好,导致FDA批准Adcetris®和Kadcyla®以及其他一系列临床试验。成本是ADC的一个主要局限,目前通过更便宜的非动物性重组mAb和现有药物再利用来降低成本。进一步研究ADC有很大的余地。
广泛的研究正在改进ADC的所有组分。免疫组织学(IHC)、循环肿瘤细胞和成像技术已用于评估可行的生物标志物,用来确定患者群。蛋白支架(分为非Ig支架、Ab衍生的支架)在开发高亲和力ADC方面显示出前景。鉴于靶向实体肿瘤的ADCs的主要障碍是肿瘤基质,最近重点关注的肿瘤基质靶向ADC有望为治疗实体瘤开辟新的治疗窗口。
参考文献
Sau S
,
Alsaab HO
,
Kashaw SK
,
Tatiparti K
,
Iyer AK
.Advances in antibody-drug conjugates: A new era of targeted cancer therapy.Drug Discov Today. 2017 Jun 13. pii: S1359-6446(17)30078-8.
识别微信二维码,添加生物制品圈小编,符合条件者即可加入抗体微信群!
请注明:姓名+研究方向!















