BioArt按
:
人类基因组中有超过98%的DNA是非编码序列,但是这些非编码序列对不超过2%的蛋白编码序列的调控却具有重要作用。
然而由于现有技术的局限,我们对于绝大部分的非编码序列的调控因子,结构与功能,以及相关的调控机制还知之甚少。
8月24日,美国德克萨斯西南医学中心
徐剑
课题组与复旦大学生物医学研究院
周峰
研究组等合作在
Cell
杂志上发表了题为“In Situ Capture of Chromatin Interactions by Biotinylated dCas9”的论文,
报道了一种可以用来分离纯化单个调控序列的全新方法—CAPTURE (CRISPR Affinity Purification
in situ
of Regulatory Elements),该方法具有特异性强、灵敏度高以及通量分析高等优势,今后运用这项技术有望帮助研究人员更全面系统地分离鉴定相关调控序列,并深入研究人类疾病的发病机制
。

论文解读:
近年来,人类基因组学和表观遗传组学的蓬勃发展加深了我们对基因组非编码序列的了解。这些占基因组98.5%的DNA序列对基因组1.5%的蛋白编码序列的起着重要的调控作用。但是,由于现有技术的局限,我们对于绝大部分的非编码序列的调控因子,结构与功能,以及相关的调控机制还知之甚少。
基因组非编码区域含有大量的组织特异性的调控序列,包括基因转录增强子(enhancer)、沉默子(
silencer
)、绝缘子(
insulators
) 等。这些调控序列通常结合几个,几十个,甚至几百个调控因子(包括转录因子,染色质调控蛋白,组蛋白,RNA分子)以及他们形成的三维结构。
用来分离纯化单个调控序列的传统的方法面临的最大的挑战是无法区分结合调控序列的特异性调控因子和细胞内大量的非特异性因子
。现有的技术包括locked nucleic acids (LNAs)【1】和transcription activator-like (TAL)蛋白【2】只能用在分离纯化多拷贝的基因组重复序列,比如染色体端粒(telomere)。而其他的常规技术,比如ChIP-seq【3】和ChIA-PE【4】则依赖于单个调控因子或组蛋白修饰,而并不能纯化和分析单个调控序列所结合的多个调控因子以及三维结构。
在最新出版的这期
Cell
杂志中,来自美国西南医学中心的徐剑(Jian Xu)研究组报道了一种可以用来分离纯化单个调控序列的全新方法—
CAPTURE (CRISPR Affinity Purification in situ of Regulatory Elements)
【5】。这一方法在CRISPR/Cas9基因编辑技术的基础上做出了重大的改进。主要原理是通过改造活性缺失的dCas9,加上了可以在细胞体内被生物素标记(biotinylation)的特定序列,并结合调控序列特异性的sgRNA将dCas9靶向性的结合到想要分离纯化的单个或多个调控序列(
下图
)。这样通过streptavidin-biotin高特异性纯化方法,结合下游的分析方法包括ChIP-seq、RNA-seq、蛋白质组学(Proteomics)和染色质三维结构(Chromatin Conformation Capture)等, 研究人员就可以分析鉴定基因组内任何调控序列的组成因子以及三维结构。用这些方法,研究人员分析了人类端粒序列,血红蛋白基因的转录调控元件,和胚胎干细胞的super-enhancer的组成蛋白以及三维结构,并发现了许多新型的转录调控因子和染色质结构的调控机制。
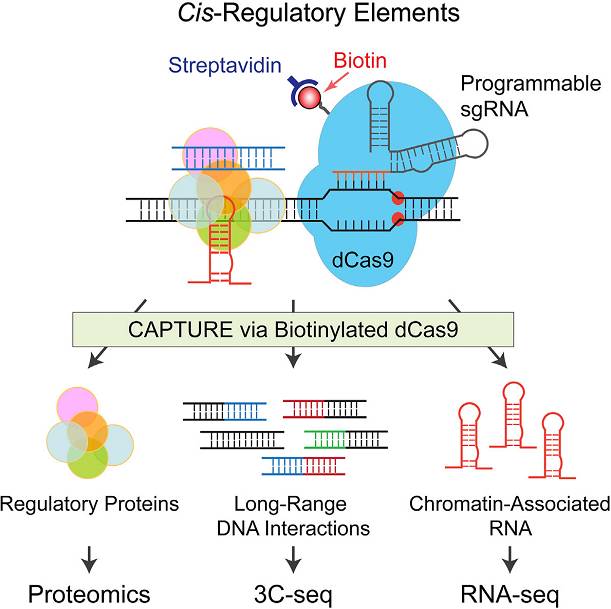
这项新技术的主要优势包括
:1、
高特异性
:streptavidin-biotin是自然界最强的非共价亲和作用,基于此方法的CAPTURE可以有效地减少或消除细胞内共纯化的非特异性蛋白;2
、高灵敏度
:此方法可以用来分析基因组内的单个调控序列;3、
高通量分析
:通过运用多个或高通量的sgRNA库,研究人员可以同时分析多个调控序列,以及他们在细胞分化或肿瘤转化过程中的变化。
已知的与人类疾病相关的DNA突变绝大部分都是非编码调控序列【6】。因此这项新技术有望帮助研究人员更全面系统地分离鉴定这些序列,并深入研究人类疾病的发病机制,从而打开了解析基因组非编码序列的潘多拉之盒。
据悉,主导了这一开创性工作的是西南医学中心的
徐剑
课题组,主要合作者包括UT-Dallas的
Michael Zhang
教授,复旦大学生物医学研究院的
周峰
课题组和中国科学院计算生物研究所的
邵振
课题组。徐剑和周峰为本文共同通讯作者。
参考文献:
1
Dejardin, J. & Kingston, R. E. Purification of proteins associated with specific genomic Loci.
Cell
136, 175-186, doi:10.1016/j.cell.2008.11.045 (2009).
2
Fujita, T. et al. Identification of telomere-associated molecules by engineered DNA-binding molecule-mediated chromatin immunoprecipitation (enChIP).
Scientific reports
3, 3171, doi:10.1038/srep03171 (2013).
3
Ren, B. et al. Genome-wide location and function of DNA binding proteins.
Science
(New York, N.Y.) 290, 2306-2309, doi:10.1126/science.290.5500.2306 (2000).
4
Fullwood, M. J. et al. An oestrogen-receptor-alpha-bound human chromatin interactome.
Nature
462, 58-64, doi:10.1038/nature08497 (2009).
5
Liu, X. et al. In situ capture of chromatin interactions by biotinylated dCas9.
Cell
In press (2017).
6
Consortium, T. E. P. An integrated encyclopedia of DNA elements in the human genome.
Nature
489, 57-74, doi:10.1038/nature11247 (2012).

徐剑
,现任美国德克萨斯西南医学中心儿童研究所助理教授。2000年本科毕业于复旦大学生化化学专业,2003年又在复旦大学获得肿瘤生物学专业硕士学位,2008年在美国加州大学洛杉矶分校获得分子生物学与干细胞生物学方向博士学位,2008-2012年为哈佛医学院 Stuart H. Orkin教授(美国科学院、艺术与科学院、医学院三院院士,HHMI研究员)实验室博后,2014年起任
德克萨斯西南医学中心儿童研究所助理教授。独立成为PI后以作为通讯作者身份在
Cell、Nature Cell Biology、Gene & Development、Cell Reports
等杂志上发表多篇高水平研究论文。

周峰
,现任复旦大学生物医学研究院研究员。2000年本科毕业于复旦大学化学系,2007年在清华大学生物科学与技术系获得博士学位,2007-2015年在哈佛医学院做博后,2015年至今
任复旦大学生物医学研究院研究员。主要从事新一代蛋白质组学相关研究,通过全蛋白定量分析对人类样品中所有的蛋白质进行性定量分析的测定,以其高灵敏度以及高覆盖率,为解决目前在疾病发病机制中所遇到的困难提供了行之有效的解决方案。目前以第一作者或通讯(共同)作者身份在包括
Cell、Nature Cell Biology、Nature Communications、Analytical Chemistry
等杂志上发表多篇论文。


BioArt,一心
关注生命科学,只为
分享更多有种、有趣、有料的信息。
关注请长按上方二维码。投稿、合作、转载授权事宜请联系微信ID:
fullbellies
或邮箱:
[email protected]
。





