目前BCS分类方法已在学术、工业和监管领域广泛建立,并且被用于BCS分类I类和III类口服固体速释(IR)制剂豁免体内BA/BE的对比研究。虽然近来在主要监管机构,特别是ICH成员国之间在协调BCS生物豁免实施的某些方面取得了重大进展,但它们之间仍然存在许多不同之处(在日本,BCS生物豁免尚未实施)。本文旨在对比FDA、EMA和WHO在BCS生物豁免指南要求上的异同之处,以便读者更好的理解BCS生物豁免的科学精髓。
①两种速释(IR)药物制剂/产品由于具有高溶解度和快速溶解特性,在胃肠道内的表现类似于口服溶液;
②一旦API溶解,在胃肠道(GIT)中就不会发生沉淀;
③两种IR制剂在肠道内的所有条件下具有相同的体内溶出曲线,即它们应具有相同的吸收速率和程度。
①2000年FDA发布了第一个用于BCS分类I类的速释(IR)固体口服制剂BE豁免的指南《Waiver of In Vivo Bioavailability and Bioequivalence Studies for Immediate-Release Solid Oral Dosage Forms Based on a Biopharmaceutics Classification System》;
②2001年EMA发布了第一个用于BCS分类I类的速释(IR)固体口服制剂BE豁免的指南《Guideline on the Investigation of Bioequivalence 2001》
③之后, WHO和EMA发布了对于BCS分类I类和III类药物BE豁免的指南《Guideline on the Investigation of Bioequivalence 2010》和《WHO technical report series, No. 992 annex 7. Multisource (Generic) pharmaceutical products: guidelines on registration requirements to establish interchangeability 2015》。
④2015年5月,美国FDA修订了BCS指南《Waiver of In Vivo Bioavailability and Bioequivalence Studies for Immediate-Release Solid Oral Dosage Forms Based on a Biopharmaceutics Classification System》,将BE豁免范围扩大到BCS分类III类药物。
⑤2015年7月,美国FDA发布了一份新的工业指南草案《Dissolution Testing and Specification Criteria for Immediate-Release Solid Oral Dosage Forms Containing Biopharmaceutics Classification System Class 1 and 3 Drugs Guidance for Industry》,为体外溶出度测试提供了建议,并提供了含有BCS I类和III类药物的速释固体口服剂型的规范标准。
其他:为了倡导BCS生物豁免的应用,FDA发布了单品种BE和产品专用指南。国际药学联合会(FIP)出版了44本专著。
FDA、EMA和WHO在BCS生物豁免要求上的对比
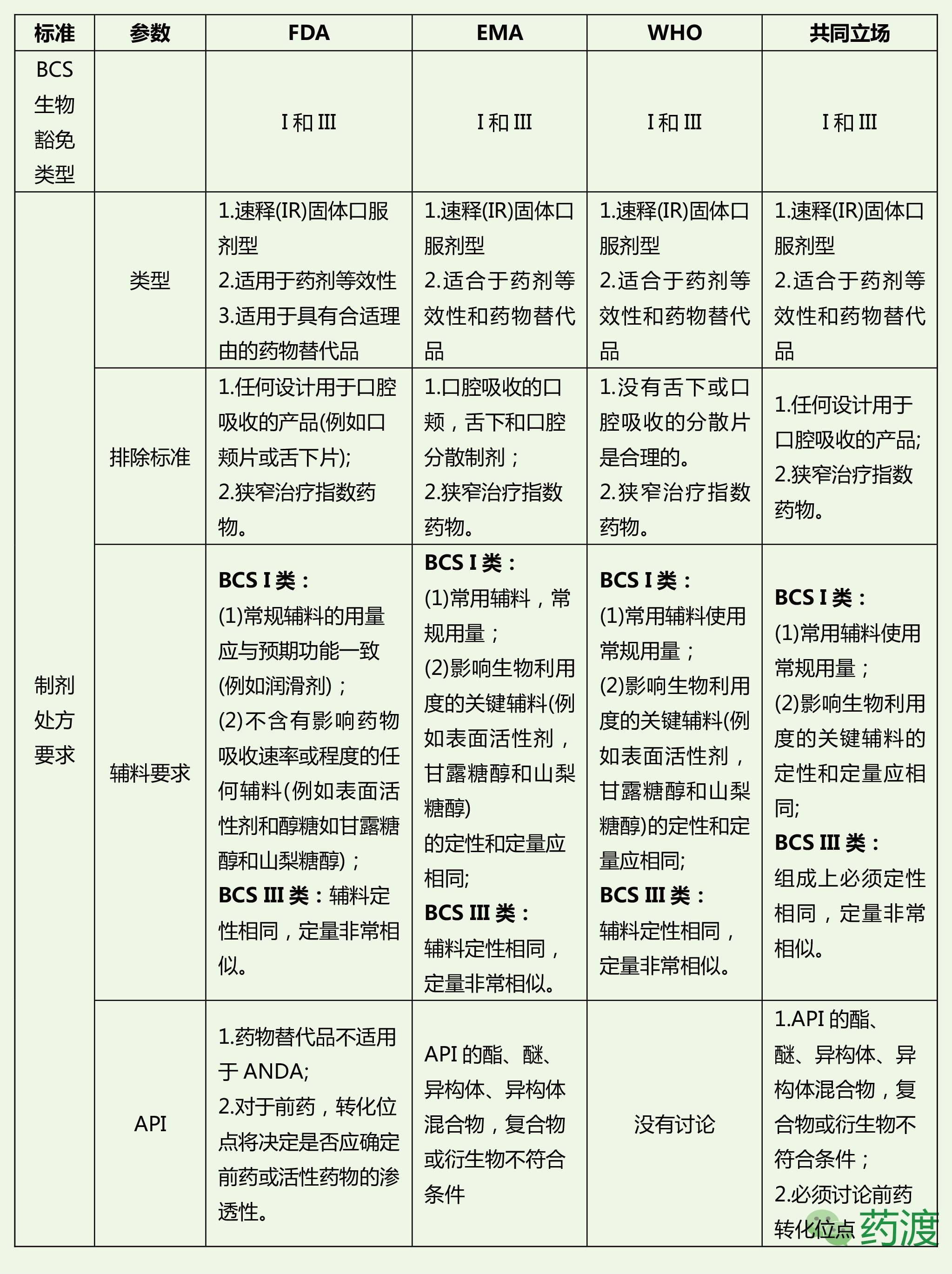

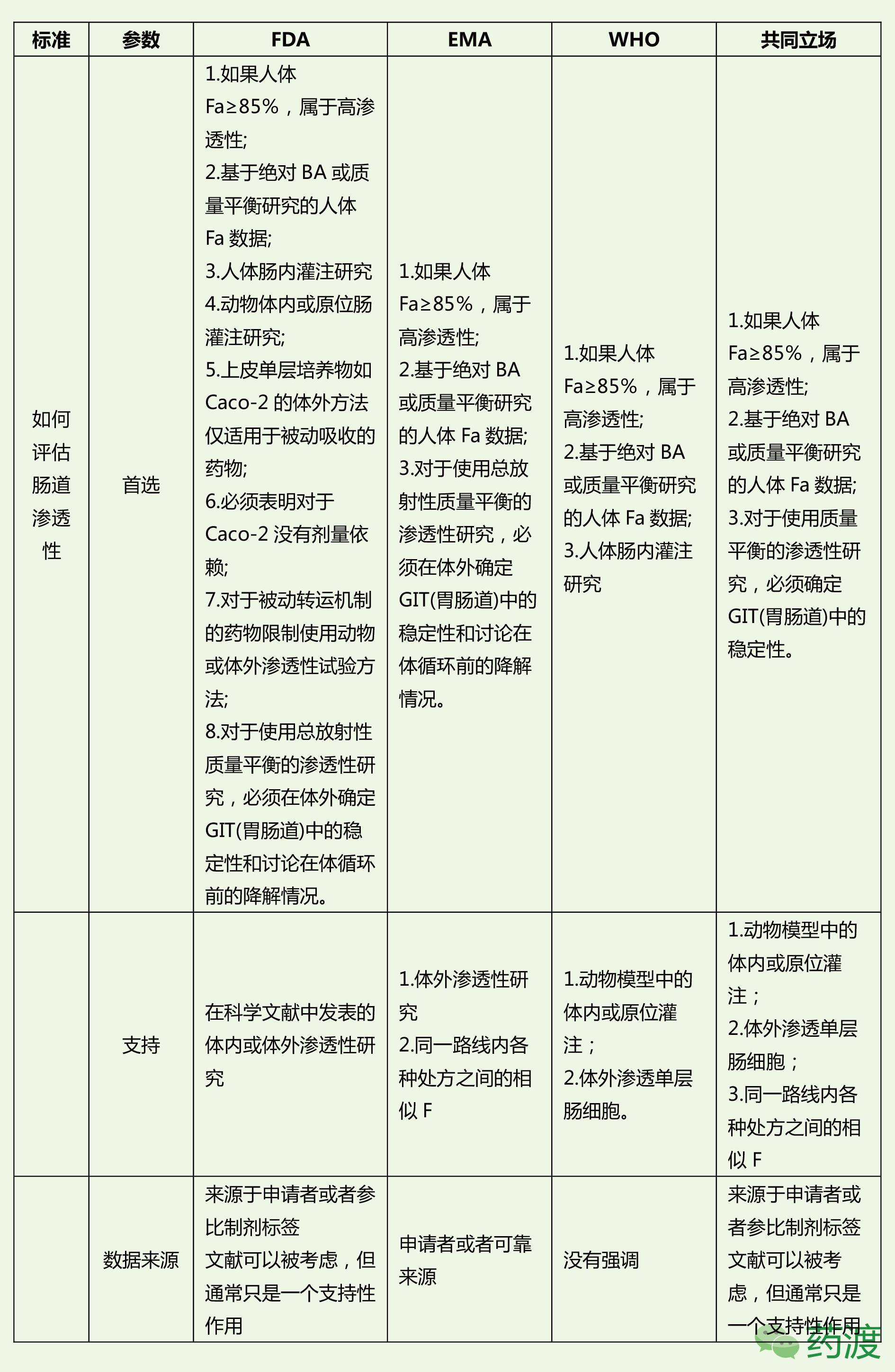
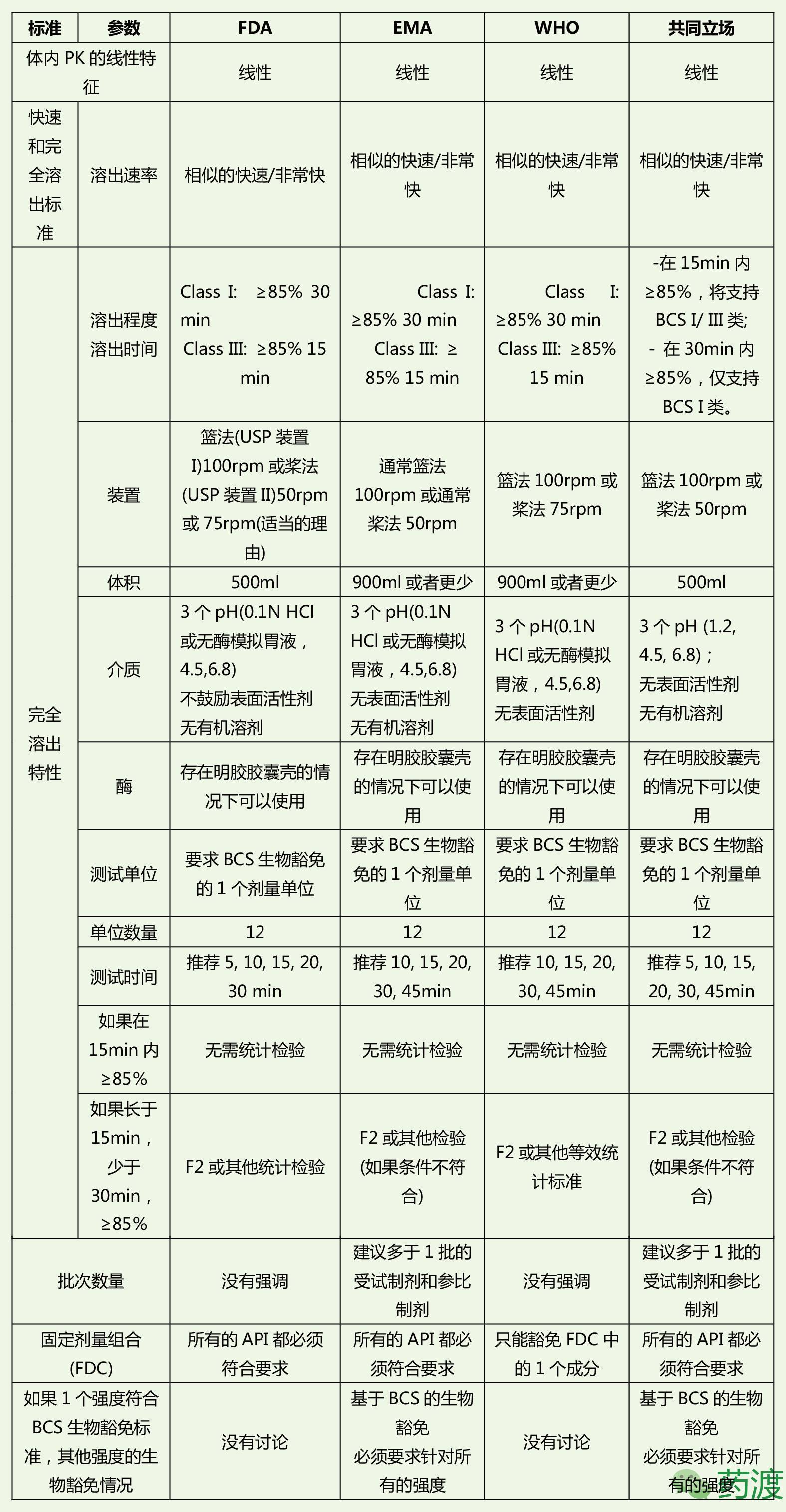
综上,我们可以看出FDA、EMA和WHO对于BCS生物豁免的指南要求尽管存在的局部的不同之处,但整体上要求基本趋于一致。我国CFDA也在2016年5月发布了《人体生物等效性试验豁免指导原则》2016年第87号,因此我们在对于BCS生物豁免的考虑时应该“求同存异”,“求同”就是应该严格基于科学精髓,考虑因素和角度要客观全面,“存异”就是在遇到指南要求不一致时,应该全面尝试和对比,再仔细分析,增加BCS生物豁免成功性。
参考文献
1. Barbara M. Davit, Isadore Kanfer, Yu Chung Tsang and Jean-Michel Cardot. BCS Biowaivers: Similarities and Differences Among EMA, FDA, and WHO Requirements The AAPS Journal, Vol. 18, No.3, 2016 DOI: 10.1208/s12248-016-9877-2
2. US Food and Drug Administration. Draft guidance for industry, waiver of in vivo bioavailability and bioequivalence studies for immediate-release solid oral dosage forms based on a biopharmaceutics classification system. 2015.
http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM070246.pdf.Accessed 3 Dec 2015.
3. US Food and Drug Administration. Draft guidance for industry, dissolution testing and specification criteria for immediate release solid oral dosage forms containing BCS class 1 and class 3 drugs.2015.
http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/UCM456594.pdf.Accessed 3 Dec 2015.
4. European Medicines Agency. EMA/CHMP/736403/2014 Rev 2, compilation of individual product-specific guidance on demonstration of bioequivalence. 2015.
http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2015/07/WC500189274.pdf. Accessed 3 Dec 2015.
5. World Health Organization. WHO technical report series, No.992 annex 7. Multisource (Generic) pharmaceutical products:guidelines on registration requirements to establish interchangeability. 2015. http://apps.who.int/medicinedocs/documents/s21898en/s21898en.pdf.Accessed 3 Dec 2015.
声明:
本文由药渡头条投稿作者撰写,观点仅代表作者本人,不代表药渡头条立场,欢迎交流补充。联系方式:010-82826195 转8048
如需转载,请务必注明文章作者和来源
投稿详情请点击“5-6月 | 王牌写手获奖名单”