

摘 要:
乙肝病毒是一种能导致机体产生急性或慢性乙型肝炎(乙肝)的嗜肝性
DNA
病毒。乙肝现已成为全球性公共卫生疾病,易恶化发展为肝硬化、肝衰竭,甚至肝癌,严重威胁着人类的健康。中药及其活性成分发挥着重要的抗乙肝病毒活性,对中药抗乙肝病毒活性及其作用机制进行综述,以期为今后抗乙肝病毒研究提供一定的参考。
乙肝病毒是一种能导致机体产生急性或慢性乙型肝炎(乙肝)的嗜肝性
DNA
病毒。目前全球约有
3.5%
的人口感染慢性乙肝,慢性乙肝如未得到及时治疗,极易发展为肝硬化、肝衰竭,甚至肝癌,严重威胁人类的健康
[1]
。目前,临床常用的抗乙肝病毒药物主要有
2
类,即核苷(酸)类似物和干扰素。前者包括恩替卡韦、拉米夫定等药物,它们在长期用药过程中易导致机体产生耐药性且停药后会出现严重的反跳现象;而后者适应证窄、不良反应明显、需注射给药且价格昂贵
[2]
。因此,迫切需要开发出一些新型的抗乙肝病毒药物用于当前乙肝的治疗。
中药及其活性成分以其独特的优势发挥着重要的抗乙肝病毒作用,具有广阔的应用前景。笔者查阅了近
5
年中药抗乙肝病毒的相关文献,对中药抗乙肝病毒活性及作用机制的研究进展进行综述,旨
在为今后抗乙肝病毒中药的研究提供参考。
1
单味中药活性成分抗乙肝病毒作用
1.1
茵陈
茵陈来源于菊科植物滨蒿
Artemisia scopariaWaldst
. et Kit.
或茵陈蒿
Artemisia capillaris
Thunb.
,具有清利湿热、利胆退黄的功效
[3]
,其抗乙肝病毒活性成分主要有葡萄糖苷、倍半萜、绿原酸、对羟基苯乙酮、烯炔等。
Geng
课题组在肝癌
HepG2.2.15
细胞上考察了多种茵陈提取物的抗乙肝病毒活性,发现
3
种葡萄糖苷对乙肝病毒
DNA
的复制、乙肝病毒表面抗原(
HBsAg
)及乙肝病毒
e
抗原(
HBeAg
)的分泌均有很强的抑制活性,半数抑制浓度(
IC
50
)均小于
3.00 μmol/L
;桉烷倍半萜对乙肝病毒
DNA
的复制、
HBsAg
和
HBeAg
的分泌均具有较强的抑制活性,
IC
50
分别为
12.01
、
15.02
、
9.00 μmol/L
;绿原酸及其类似物、对羟基苯乙酮、烯炔等对乙肝病毒
DNA
的复制具有较强的抑制活性,
IC
50
均小于
15.00 μmol/L
,而对
HBsAg
、
HBeAg
的分泌具有轻度的抑制活性
[4-8]
。上述茵陈提取物体外抗乙肝病毒活性显著,为进一步的机制研究和抗乙肝病毒药物研发奠定基础。
1.2
虎杖
虎杖采自于蓼科植物虎杖
Polygonum cuspidatum
Sieb. et Zucc.
,具有利湿退黄、清热解毒、散瘀止痛等功效
[3]
,其包含的抗乙肝病毒活性成分主要有槲皮素、白黎芦醇等。
Cheng
等
[9]
将槲皮素作用于
HepG2.2.15
细胞和
pCH-9/3091
(包含
1.1
倍乙肝病毒全基因组)转染的
Huh7
细胞后,
HBsAg
、
HBeAg
的分泌及乙肝病毒
DNA
的复制均受到明显的抑制,且此抑制活性在与拉米夫定、阿德福韦、恩替卡韦等合用时得到增强,作用机制可能与槲皮素下调热休克蛋白(
heat shock protein
,
Hsp
)
40
、
Hsp70
、
Hsp90-β
的表达,抑制乙肝病毒的转录有关。
Parvez
等
[10]
用槲皮素持续处理
HepG2.2.15
细胞
5 d
后,培养上清中
HBsAg
、
HBeAg
的分泌受到明显抑制,但继续处理则会造成细胞过度生长和死亡;分子对接结果显示,槲皮素与乙肝病毒聚合酶(
polymerase
,
Pol
)有较强的结合活性。
Park
等
[11]
用白黎芦醇处理能稳定表达乙肝病毒
x
蛋白(
hepatitis B virus x protein
,
HBx
)的
Huh7-HBx
细胞后,丝苏氨酸蛋白激酶(
ser-ine-threonine protein kinase
,
Akt
)信号转导受到干扰,细胞周期蛋白
D1
(
cyclin D1
)表达水平降低,使细胞增殖受到抑制;体内
Huh7-HBx
细胞异种移植小鼠模型也证实了白藜芦醇对肿瘤生长的抑制活性,提示白藜芦醇具有降低慢性乙肝病毒感染患者发生肝癌风险的潜在作用。然而,
Shi
等
[12]
报道,白黎芦醇可激活
Sirt1-PGC-1α-PPARα
信号轴,从而增强乙肝病毒核心启动子活性,进而促进乙肝病毒转录和复制,导致乙肝症状加重。文献报道白黎芦醇对乙肝病毒影响存在的两面性使得其能否成为抗乙肝病毒的活性化合物还有待进一步研究。
1.3
丹参
丹参来源于唇形科植物丹参
Salvia miltiorrhiza
Bge.
的干燥根和根茎,具有良好的保肝护肝功效
[3]
。丹参素、迷迭香酸、紫草酸等为丹参主要的抗乙肝病毒活性成分。段树鹏等
[13]
研究发现
HepG2.2.15
细胞经丹参素处理后,乙肝病毒逆转录酶活性降低,使乙肝病毒
DNA
的复制受到直接的抑制作用,
HBsAg
、
HBeAg
的表达也随之受到抑制。
Tsukamoto
等
[14]
报道迷迭香酸对
Hep38.7-Tet
细胞和乙肝病毒感染的人原代肝细胞培养上清中乙肝病毒
DNA
的分泌具有显著的抑制作用,对其中
HBsAg
的分泌具有轻度的抑制作用,机制可能与干扰乙肝病毒前基因组
RNA
(
pregenomicRNA
,
pgRNA
)与
Pol
的结合有关。此外,笔者研究发现丹参中多酚类化合物紫草酸作用于
HepG2.2.15
细胞后,明显抑制乙肝病毒
DNA
的复制,其机制可能是紫草酸通过上调溶酶体膜相关蛋
白
1/2
(
lysosome-associated membrane proteintype1/2
,
LAMP1/2
)、组织蛋白酶
D
(
cathepsin D
,
Cath-D
)的表达使得溶酶体的酸化功能增强以及通过抑制
PI3K/Akt/ mTOR
细胞信号通路来促进自噬体的形成,进而诱导肝细胞发生完整的自噬以干扰乙肝病毒复制。
1.4
苦参
苦参为豆科植物苦参
Sophora flavescens
Ait.
的干燥根
[3]
,其抗乙肝病毒活性成分主要包括苦参碱、氧化苦参碱、槐定碱等苦参碱型生物碱及苦参多糖等。冯静等
[15]
研究发现苦参碱对
HepG2.2.15
细胞中乙肝病毒
DNA
复制具有较强的抑制作用,机制可能与抑制
Pol
的活性有关;此外,它与拉米夫定合用能增强后者抗乙肝病毒的效果。张轩等
[16]
和
Sang
等
[17]
分别发现氧化苦参碱能明显抑制
HepG2.2.15
细胞培养上清和水动力注射
pAAV-HBV 1.2
小鼠血清中
HBsAg
、
HBeAg
的分泌及乙肝病毒
DNA
的复
制。
Chen
等
[18]
报道槐定碱处理
HepG2.2.15
细胞
72h
后,
HBsAg
、
HBeAg
的分泌及乙肝病毒
DNA
的复制均受到明显的抑制,且抑制活性优于苦参碱和氧化苦参碱。
Yang
等
[19]
研究发现苦参多糖显著抑制
HepG 2.2.15
细胞
HBsAg
、
HBeAg
的分泌,机制可能与调控干扰素(
interferon
,
IFN
)
-γ
、白介素(
interleukin
,
IL
)
-6
和肿瘤坏死因子(
tumornecrosis factor
,
TNF
)
-α
等炎性细胞因子的分泌有关。
1.5
其他单味中药活性提取物
除上述单味中药提取物外,近年来还有一大批中药提取物被发现具有抗乙肝病毒活性,为抗乙肝病毒药物的开发提供了巨大的潜在活性化合物库。
Parvez
等
[20]
研究发现芦荟提取物芦荟大黄素抑制
HepG2.2.15
细胞
HBsAg
、
HBeAg
分泌及乙肝病毒的复制,作用机制可能与其抑制
Pol
活性有关;同时,研究结果显示芦荟大黄素对于乙肝病毒的抑制活性与拉米夫定相当,这可能与其活化细胞色素
P450
有关。笔者研究发现原儿茶酸通过激活
ERK1/2
信号通路介导的肝细胞核因子(
hepatocytenuclear factor
,
HNF
)
-4α
和
-1α
下调作用抑制乙肝病毒
X
启动子、核心启动子和前
S1
启动子,从而影响乙肝病毒的转录和复制
[21]
;同时,原儿茶酸与拉米夫定联合应用能够显著增强两者对于乙肝病毒
DNA
、
HBsAg
、
HBeAg
等的分泌的抑制作用,且使
两者的作用时间延长,同时起到良好的保肝作用
[22]
。
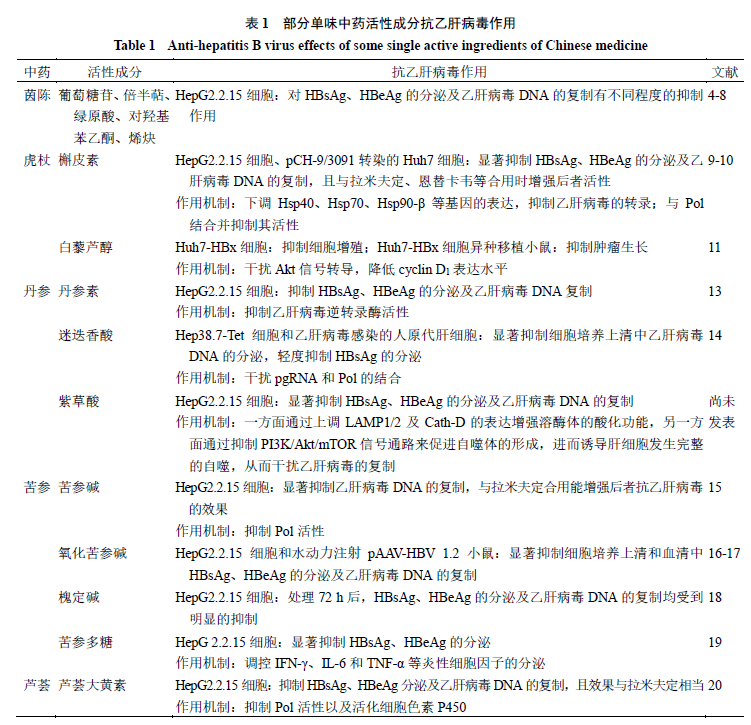
茵陈、虎杖、丹参、苦参等单味中药中的有效成分及提取物被报道具有抗乙肝病毒活性,见表
1
。
2
中药复方抗乙肝病毒作用
2.1
复方叶下珠
复方叶下珠是以叶下珠、黄芪、三七、甘草等组成的中药复方。
Li
等
[23]
报道复方叶下珠处理能稳定表达
HBx
的
HepG2-HBx
细胞和
HepG2-HBx
细胞移植小鼠后,
HepG2-HBx
细胞增殖、迁移、克隆形成及小鼠肿瘤的生长均受到了显著的抑制作用,其机制可能与
HBx-SHH
信号轴的失活有关,提示复方叶下珠具有降低乙肝向肝癌恶化的治疗潜力。
Tong
等
[24]
选择
102
例合并乙肝肝硬化再生或发育不良结节的乙肝患者作为研究对象,发现复方叶下珠能够在一定程度上抑制乙肝病毒
DNA
的复制,能预防或延缓乙肝病毒患者向肝癌方向恶化。谭本仁等
[25]
研究发现,复方叶下珠滴丸对
HepG2.2.15
细胞培养上清和
HBsAg
阳性患者血清培养液中
HBsAg
、
HBeAg
和乙肝病毒
DNA
复制均有一定程度的抑制作用。
2.2
小柴胡汤
小柴胡汤源于《伤寒杂论》,由柴胡、黄芩、人参、半夏、甘草、生姜、大枣
7
味中药组成
[26]
。李洁霞
[27]
报道小柴胡汤联合阿德福韦对乙肝患者有较好的疗效,且作用优于单独使用阿德福韦。陈少芳等
[28]
给临床慢性乙肝肝郁脾虚证患者应用加味小柴胡汤
7 d
后,取含药血清处理
HepG2.2.15
细胞,上清中
HBsAg
的分泌受到明显抑制。此外,万石川
[29]
研究发现加味小柴胡汤能够显著抑制
HepG2.2.15
细胞
HBsAg
、
HBeAg
的分泌,机制与其抑制
JAK2-STAT3
信号通路有关。
2.3
补肾复方
补肾复方是由黄芪、女贞子、淫羊藿、猫爪草、胡黄连、青皮
6
味中药组成的中药验方。
Ji
等
[30]
报道,在对恩替卡韦具有部分病毒学应答的患者中,
HBeAg
阳性乙肝患者在应用补肾复方联合恩替卡韦治疗后效果明显优于单独使用恩替卡韦,这可能与调节性
T
细胞(
regulatoryT cells
,
Treg
)比例的降低和树突细胞上细胞程序性死亡配体
1
(
programmed death-L1
,
PD-L1
)水平的下调相关。
Li
等
[31]
研究发现补肾复方能够降低
HBeAg
阳性乙肝患者血清中丙氨酸氨基转移酶(
alanineaminotransferase
,
ALT
)和乙肝病毒
DNA
的水平,对伴有
ALT
水平轻度升高的乙肝病毒患者有较良好的疗效,机制与其降低
CD4
+
CD25
+
T
细胞比率以及上调
CD4
+
T
细胞中
IFN-γ
表达水平的有关。同时,
Li
等
[32]
还发现了针对于单独应用恩替卡韦疗效不佳的乙肝患者,补肾复方联合恩替卡韦使用能改善
HBsAg
和
HBeAg
清除率等指标,提示补肾复方可作为恩替卡韦有效的补充药物。
2.4
扶正化瘀胶囊
扶正化瘀胶囊由丹参、桃仁、发酵虫草菌粉、松花粉、绞胶蓝、五味子
6
味中药组成。
Wang
等
[33]
报
道扶正化瘀胶囊作为辅助治疗药物配合常规的抗乙肝病毒治疗方法,能更有效地调节乙肝病毒相关性肝硬化患者
ALT
、天冬氨酸氨基转移酶(
aspartate aminotransferase
,
AST
)、
III
型前胶原(
PCIII
)、透明质酸(
hyaluronic acid
,
HA
),层粘连蛋白(
laminin
,
LN
)等水平并提高乙肝病毒
DNA
转换率,且无严重的不良反应。
Wu
等
[34]
收集慢性乙肝并发肝硬化的患者外周血
CD4
+
T
细胞
CD8
+
T
细胞及自然杀伤细胞,与人肝星状细胞(
hepatic stellate cell
,
HSC
)系
LX-2
细胞体外共培养,并用刀豆蛋白
A
诱导慢性肝损伤,检测发现扶正化瘀胶囊显著提高自然杀伤细胞的比例、诱导
LX-2
细胞凋亡和坏死,下调
α-
平滑肌肌动蛋白和
Ⅰ
型前胶原的表达,提示扶正化瘀胶囊通过调节
T
淋巴细胞亚群的比例和功能来间接抑制
HSC
的增殖及活化,并促进
HSC
的凋亡和坏死,从而有助于阻断纤维化进程。
2.5
其他
除了上述中药复方之外,近年来随着对抗乙肝中药的深入研究,还有一大批中药复方的抗乙肝活性被报道。
Kim
等
[35]
研究发现由茵陈、地榆、姜黄组成的中药复方
KCT-01
能显著抑制
HepG2.2.15
细胞中
HBsAg
、
HBeAg
和病毒颗粒的分泌和
pgRNA
的合成,而不影响细胞活力;同时,能抑制乙肝病毒复制模型小鼠血清病毒粒子的产生及炎性细胞因子的合成,并降低小鼠肝细胞共价闭合环状
DNA
(
covalentlyclosed circular DNA
,
cccDNA
)水平;此外,
KCT-01
与恩替卡韦合用能增强后者体内、外抗乙肝病毒活性。
Zhang
等
[36]
报道温肾处方能够提高具有高基线
ALT
水平和肾阳虚证的慢性乙肝患者
HBeAg
血清学转换、乙肝病毒
DNA
转阴率及
ALT
正常化,且无严重不良反应。
Zhao
等
[37]
发现簕草石复方提取物可抑制鸭乙肝病毒感染鸭乙肝模型
DHBsAg
、
DHBeAg
和鸭乙肝病毒复制,且可降低
ALT
和
AST
水平,并改善鸭肝组织病变;同时,簕草石复方提取物也能抑制
HepG2.2.15
细胞
HBsAg
和
HBeAg
的分泌。
诸多中药复方被报道具有抗乙肝病毒活性,常见如表
2
所示。

3
中药抗乙肝病毒作用机制
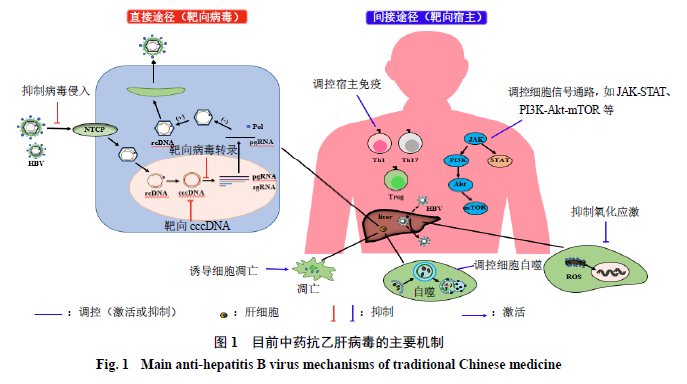
目前中药抗乙肝病毒的作用机制主要涉及靶向病毒的直接途径和靶向宿主的间接途径
2
个方面,见图
1
。已报道中药的抗乙肝病毒主要机制分为直接途径(靶向病毒)和间接途径(靶向宿主)
2
大类。前者主要包括抑制乙肝病毒的侵入(如
EGCG
、水飞蓟宾、原花色素等)、靶向乙肝病毒
cccDNA
(如安石榴苷、姜黄素等)和抑制乙肝病毒转录(如柴胡皂苷
C
、黄芩苷、木犀草素等)等机制;后者主要包括调控乙肝病毒诱导的细胞自噬(如
EGCG
、腐殖酸等)、调控宿主免疫功能(如补肾祛毒汤、氧化苦参碱等)、诱导宿主细胞凋亡(如苦参素等)、抑制氧化应激(如
2,7-
二氯荧光素、木犀草素
-7-
O
-
葡萄糖苷等)和调控
JAK-STAT
、
PI3K-Akt-mTOR
等细胞信号通路(如甜菜碱、板蓝根多糖、双氢青蒿素等)等机制。
3.1
直接途径
3.1.1
抑制乙肝病毒的侵入
乙肝病毒吸附进入肝细胞是乙肝病毒生命周期中的初始环节。乙肝病毒感染进入肝细胞需要宿主肝细胞膜上钠
-
牛磺胆酸共转运多肽(
Na
+
-taurocholate cotransporting poly- peptide
,
NTCP
)和网格蛋白的参与
[38-39]
。因此,
NTCP
和网格蛋白常被作为研究乙肝病毒侵入抑制剂的靶点。
Huang
等
[40]
应用乙肝病毒感染的
Hus-E/2
细胞和转染
HA-NTCP
表达质粒的
Huh7
细胞,发现表没食子儿茶素没食子酸酯(
EGCG
)诱导
NTCP
从胞膜向胞质转移,继而促进溶酶体对
NTCP
的降解,从而抑制乙肝病毒侵入肝细胞,这可能与
EGCG
影响网格蛋白介导的
NTCP
内吞作用有关。
Umetsu
等
[41]
研究发现乳蓟提取物水飞蓟宾减少
HepG2-NTCP-C4
细胞中转铁蛋白的摄取,并抑制网格蛋白介导的内吞作用,进而抑制乙肝病毒侵入细胞。
Tsukuda
等
[42]
报道原花色素及其类似物抑制乙肝病毒大型表面蛋白的前
S1
结构域与
NTCP
的结合,抑制乙肝病毒进入肝细胞,降低乙肝病毒感染性,且其对各种基因型的乙肝病毒都有抑制活性。
3.1.2
靶向乙肝病毒
cccDNA
乙肝病毒
cccDNA
的持续稳定存在是慢性乙肝患者难以治愈的主要原因之一。因此,
cccDNA
是研究抗乙肝病毒药物的重要靶点
[43-45]
。
Liu
等
[46]
建立以细胞为基础的
cccDNA
积累和稳定性实验,发现安石榴苷等
3
种可水解鞣酸能够通过抑制
cccDNA
形成、促进
cccDNA
降解降低
cccDNA
水平而起到抗乙肝病毒效果。
Wei
等
[47]
研究发现,从姜黄等姜科、天南星科植物中提取出的姜黄素能够显著降低
cccDNA
结合的组蛋白
H3
和
H4
的乙酰化水平,破坏
cccDNA
稳态,提示其可作为开发靶向
cccDNA
的抗乙肝病毒潜在化合物。
3.1.3
抑制乙肝病毒转录
高抗原负载是引发慢性乙肝患者肝损害的一个重要原因,通过抑制
cccDNA
转录出各种病毒
RNA
,从而减少乙肝病毒
HBsAg
、
HBcAg
、
HBx
等的表达,能够有效地缓解慢性乙肝患者体内的肝细胞损伤
[48]
。
Pan
等
[49]
研究发现柴胡皂苷
C
通过刺激
IL-6
表达来下调
HNF-1α
和
HNF-4α
水平,从而抑制乙肝病毒
pgRNA
的合成,且其对野生型和耐药性乙肝病毒均有效果。
Huang
等
[50]
报道黄芩苷亦可通过下调
HNF-1α
和
-4α
的表
达来发挥抑制乙肝病毒转录及复制的作用。
Bai
等
[51]
研究表明木犀草素能激活
ERK
信号转导从而抑制
HNF-4α
的表达及其与乙肝病毒启动子的结合,进而干扰乙肝病毒的转录和复制。
3.2
间接途径
3.2.1
调控乙肝病毒诱导的细胞自噬
细胞自噬对于乙肝病毒感染的作用具有两面性:在慢性乙肝病毒感染早期,乙肝病毒可以通过诱导宿主细胞发生不完全自噬激活自身复制;而在慢性乙肝病毒感染恶化成肝癌后,细胞自噬的激活又可以通过诱导细胞死亡及增强抗肿瘤免疫反应减缓肿瘤的进一步恶化














