肝癌(HCC)
是全球第四大常见癌症,死亡率位居第三,且多数患者确诊时已无法接受根治性治疗。传统放射性栓塞(TARE)虽能通过高剂量辐射杀伤肿瘤,但存在放射性肺炎等副作用,且现有微球材料因密度高、稳定性差等问题限制了临床应用。此外,单一疗法难以彻底抑制肿瘤复发。
因此,如何在
降低辐射剂量的同时增强疗效,并解决微球材料的生物相容性与功能性缺陷
,成为肝癌治疗亟待突破的难题。
鉴于此,来自
苏州大学的张于娟,靳勇以及王广林团队
联合开发了一种
基于聚多巴胺(PDA)涂层的双重功能放射性微球(
131
I-PDA@PVA MSs)
,
实现了肝癌的放射性栓塞与光热疗法的协同治疗。相关研究以
“Dual Functional Radioactive Gel-Microspheres for Combinatorial Radioembolization and Photothermal Therapy of Hepatocellular Carcinoma”
为题发表在
《Advanced Healthcare Materials》
上。

以下是对本论文创新点的简要概述:
(1)双重功能微球设计——放射与光热协同增效:
研究团队通过将放射性碘(
131
I)标记于PDA涂层,赋予商用PVA凝胶微球双重功能:一方面通过栓塞阻断肿瘤血供并释放β/γ射线杀伤癌细胞;另一方面利用PDA的光热效应,在近红外激光照射下局部升温,增强肿瘤细胞对辐射的敏感性。二者协同作用显著提升了抑瘤效果,同时降低辐射剂量需求。
(2)高稳定性与生物相容性——突破微球材料瓶颈:
与传统玻璃或树脂微球相比,PVA凝胶微球密度低、弹性佳,能顺利通过微导管实现远端栓塞。PDA涂层进一步提高了微球的放射标记稳定性(体内7天无泄漏),且压缩实验表明其形变恢复能力强,避免了栓塞过程中的碎裂风险。细胞实验证实微球对正常组织无明显毒性,生物安全性优异。
(3)临床转化潜力——可视化与精准控温:
131
I的γ射线特性支持SPECT/CT实时成像,可精准监测微球分布与辐射剂量;光热升温(局部ΔT>20℃)通过红外热像仪实时反馈,实现治疗过程的可视化调控。这种“诊疗一体化”设计为肝癌个性化治疗提供了新思路。
该研究不仅为肝癌治疗提供了一种高效低毒的双重功能微球,更为多模态协同疗法的临床转化奠定了重要基础。
1. 双重功能放射性微球的制备与性能验证
研究团队基于商用PVA凝胶微球(CalliSpheres),通过多巴胺自聚合形成聚多巴胺(PDA)涂层,并利用碘化法标记放射性碘(
131
I),成功制备出兼具放射性栓塞与光热治疗能力的双功能微球(
131
I-PDA@PVA MSs)。实验表明,该微球表面光滑、尺寸均一(直径约157.9 μm),且PDA涂层显著提升了微球的弹性与抗压能力,在50%形变后仍能恢复原状。通过红外光谱分析,验证了PDA成功包覆于PVA表面。放射性标记稳定性测试显示,微球在体内7天内无显著放射性泄漏,体外血清环境中稳定性达76.5%,为后续治疗提供了可靠载体。
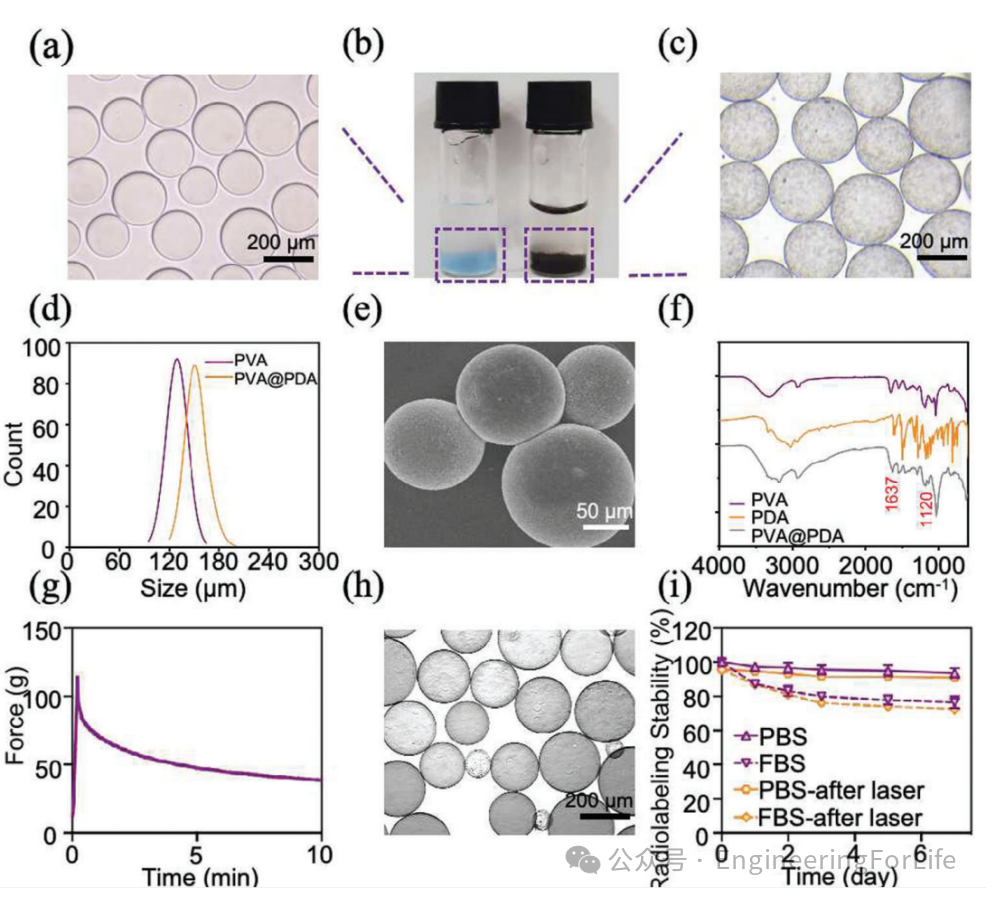
图1 微球形
貌表征与稳定性分析
2. 光热转换性能的系统优化
研究通过调控多巴胺浓度(0.25–8 mg/mL)和激光参数(0.5–2 W/cm²),系统评估了PDA@PVA微球的光热性能。结果显示,微球在808 nm近红外激光照射下,温度提升与多巴胺浓度和激光功率呈正相关,最高升温达35℃(10 mg/mL微球,1.5 W/cm²),光热转换效率达47.2%。此外,微球在多次激光开关循环中表现出优异的稳定性,验证了其适用于多次重复治疗的需求。这一特性为后续联合放射性栓塞与光热疗法提供了关键技术支持。
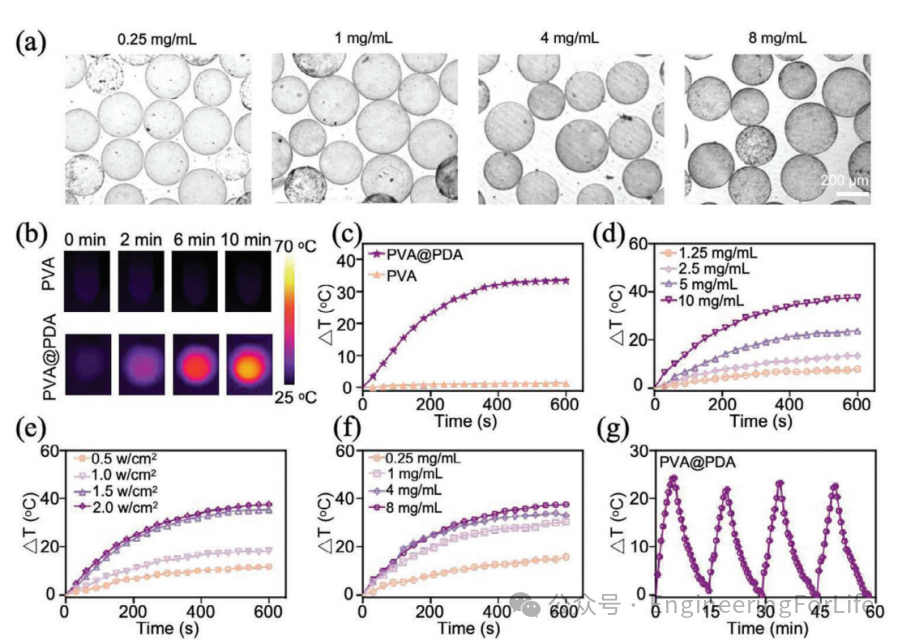
图2 多巴胺浓度与光热性能关联研究
3. 体外联合治疗的协同增效机制
在细胞实验中,
131
I-PDA@PVA MSs微球联合光热治疗显著抑制了VX2肝癌细胞活性(存活率仅10%),并诱导了更高水平的DNA损伤(γ-H2AX焦点密度增加)。流式细胞术分析发现,联合治疗组细胞周期阻滞于G2/M期的比例(34.2%)显著高于单一疗法(23.5%–25.1%),表明光热效应通过增强肿瘤细胞对辐射的敏感性,实现了协同增效。同时,微球对正常细胞(HUVEC)无显著毒性,证实其生物安全性。
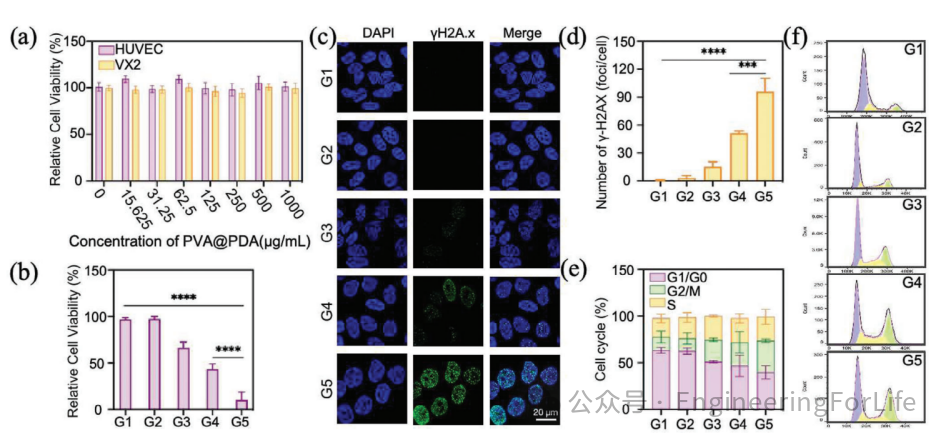
图3 细胞活力与协同治疗机制验证
4. 体内治疗的高效性与安全性验证
在兔VX2肝癌模型中,经肝动脉栓塞的
131
I-PDA@PVA MSs微球通过SPECT/CT成像精准定位于肿瘤区域(16.0% ID/g),且近红外激光照射后局部升温超20℃,实现了“诊疗一体化”。CT扫描显示,联合治疗组肿瘤体积抑制率显著优于单一疗法,且组织学分析(H&E和TUNEL染色)证实了肿瘤广泛坏死与凋亡。安全性评估中,主要器官(心、肝、肺等)未出现明显病理损伤,表明该疗法兼具高效性与安全性。
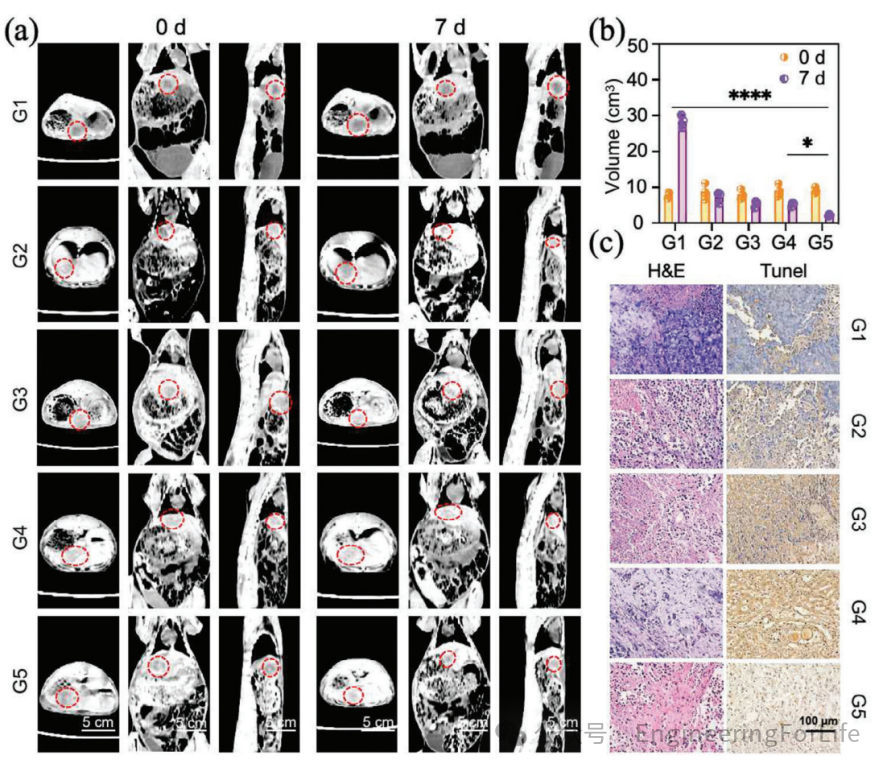
图4 体内肿瘤抑制与组织学疗效评估
综上所述,本研究
通过创新性设计
131
I-PDA@PVA MSs微球,成功将放射性栓塞与光热疗法结合
,在兔VX2肝癌模型中实现了肿瘤生长抑制率显著提升(联合治疗组存活率仅10%),且未引发明显器官损伤。
未来,或将
进一步优化微球的靶向性与光热穿透深度
,例如引入磁性材料实现非侵入性磁热协同,或开发可降解微球以减少长期滞留风险。此外,如何简化光热疗法的临床操作(如光纤植入)并提升患者接受度,仍是后续研究的重点。这一成果为肝癌治疗开辟了多模态精准治疗的新路径,有望推动介入放射学与纳米医学的深度融合。
参考资料:
https://doi.org/10.1002/adhm.202401057
来源:
EngineeringForLife
声明:仅代表作者个人观点,用于研究用途,作者水平有限,如有不科学之处,请在下方留言指正!





