F1:
外泌体的分泌在趋化过程中,促进细胞有方向的移动
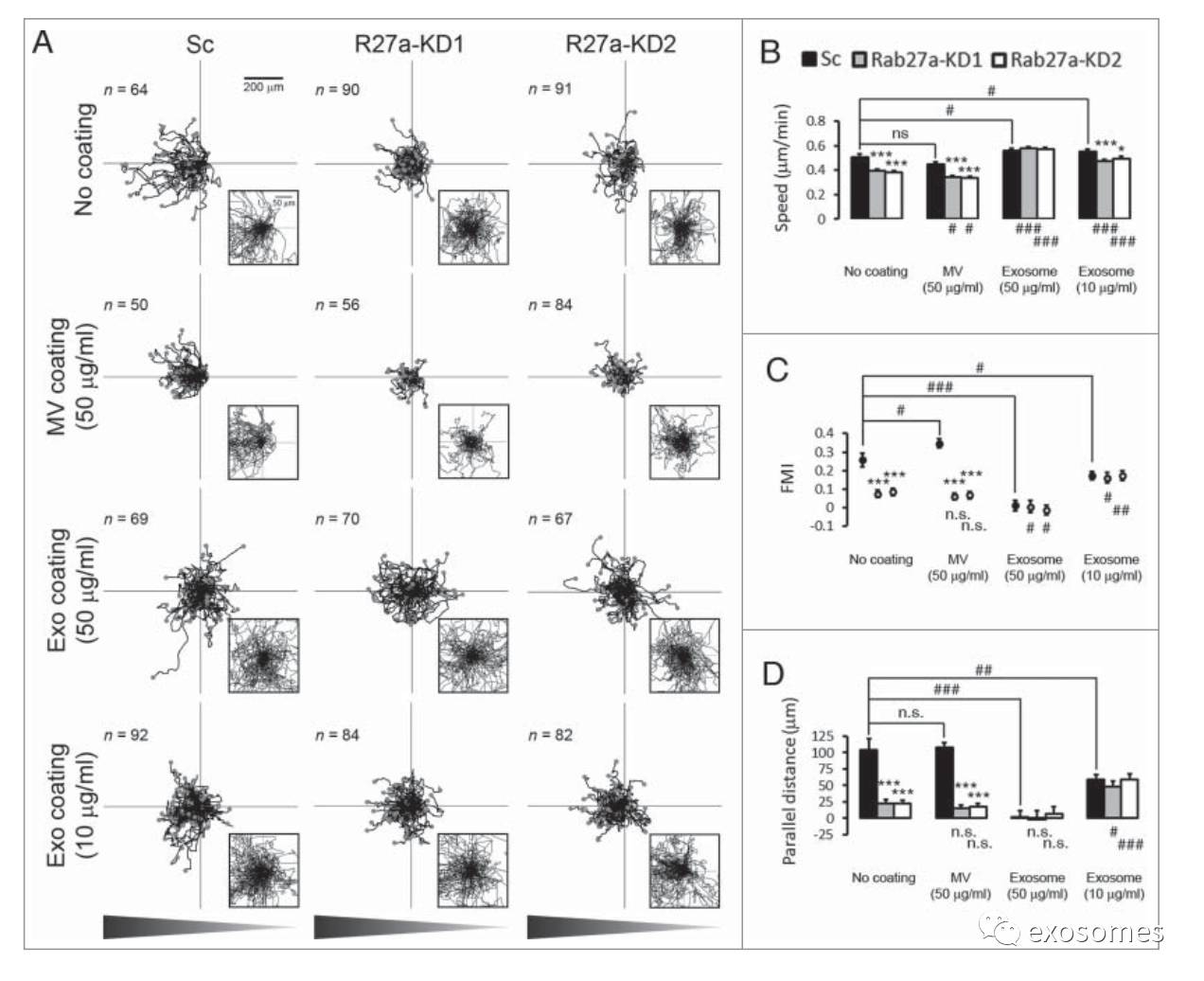
为了检测外泌体是否影响肿瘤细胞对趋化梯度的反应性,我们利用商业化的通过扩散可以产生稳定趋化梯度的趋化性孔板构建对照组和敲除Rab27a调控因子的HT1080纤维肉瘤细胞(敲除株1,2)。黏附5小时,加入20-0%梯度的缺乏外泌体血清让细胞迁移生长12小时。通过定时迁移分析证实对照组细胞朝着梯度定向迁移(F1A)。相反,Rab27a敲除株整体在迁移速度和定向运动方面均存在缺陷(F1A、B、C)。由于迁移速度的缺陷,大部分Rab27a敲除株细胞在风向频率图中的轨迹在低功率视图中呈现出过分重叠的现象(F1A)。每一个风向频率图中央部分显示大部分敲除株细胞的轨迹不存在定向运动,而对照组细胞轨迹对梯度有明显倾斜(F1A)。前进迁移指数(FMI)和特异性平行距离定量测定细胞朝着引诱物运动并且确证了Rab27a敲除株细胞对引诱物存在缺陷(F1C、D)。
F2
:细胞外囊泡的特点:使用超速离心从条件培养基中分离的外泌体和细胞外囊泡,使用密度梯度离心将外泌体进一步纯化。
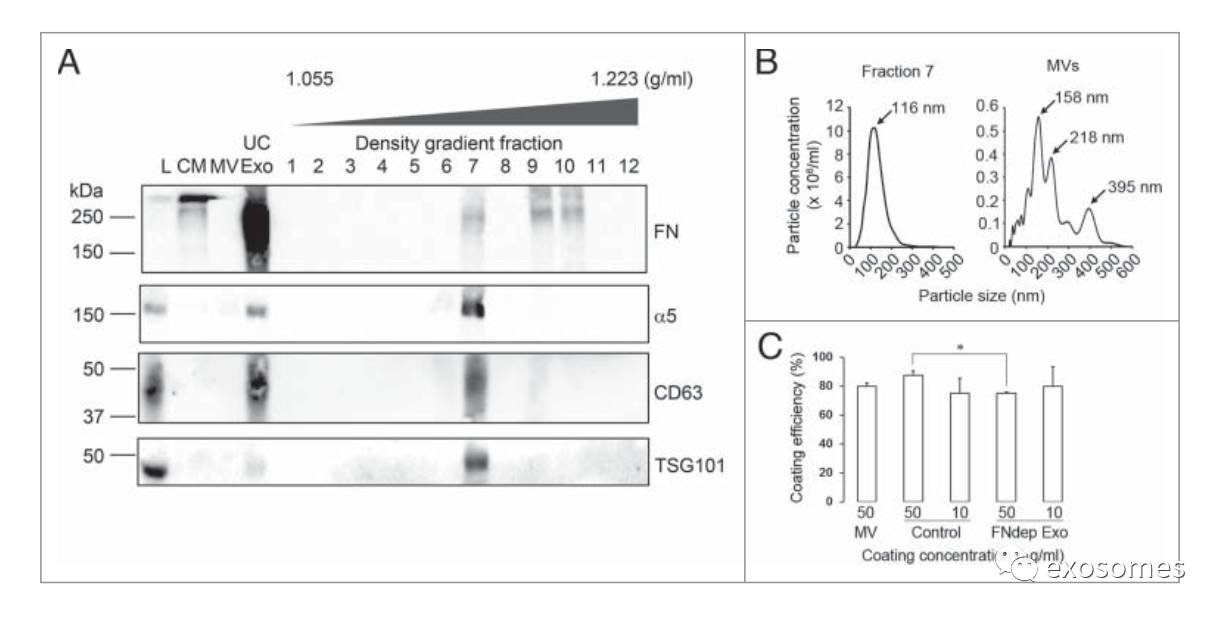
我们先前发现无论用纤维蛋白(FN)还是纯化的外泌体包被组织培养皿,均可以补救Rab27a敲除株或Hrs缺陷株在随意运动方面的缺陷。我们进一步发现携带FN的外泌体可促进细胞黏附,可以解释抑制外泌体分泌的细胞在迁移速度方面的缺陷。我们采用了相似的方法来探究来自趋化性肿瘤细胞的EVs及其中的物质所起的作用。通过一系列离心(超速离心)将外泌体从HT1080纤维肉瘤细胞的条件培养基中分离。按如前所描述将超速离心得到的外泌体(
UC-Exo
)通过沉积作用纯化
为
Optiprep
浓度梯度的外泌体
(DG-Exo)
。结果与我们先前发表的一致,WB分析阐明了HT1080
UC-Exo
和
DG-Exo
均携带有FN,而MVs上不存在(F2A)。FN在三个浓度梯度组分中均有发现:组分7、9、10。组分7包括外泌体标签CD63、TSG101和FN偶联受体亚单元、整合素α5。相反,组分9、10比7更密集,且不包含外泌体标签,意味着这些组分中的FN是纤维丝状和或聚集的,与外泌体并无关系。对浓度梯度外泌体7进行纳米微粒追踪分析显示,有116nm直径峰的外泌体呈现出预期的径谱,因此组分7被用做所有与外泌体相关的实验(F2B)。类似地,多囊泡显示出比预期更大的径谱,并有158nm、218nm、395nm多个直径峰。
为了测量在实验条件下预备囊泡的黏附率,我们使用纳米微粒追踪实验对96孔板包被前后的多囊泡和外泌体进行计数。数据说明近80%囊泡(多囊泡和外泌体)黏附在组织培养基表面(F2C)。预包被50ug/ml多囊泡的趋化性孔板并不影响迁移的任何方面,除过对照组轻度增加的FMI(F1A-D)。通过对比,包被50ug/ml外泌体的趋化性孔板完全补救了Rab27a敲除株在运动速度方面的缺陷,并且对照组的速度也轻度升高(F1B)。有趣的是,包被外泌体不仅没有补救Rab27a敲除株定向运动的缺陷而且消除了对照组细胞的趋化性(F1A)。因此,在这种条件下Rab27a敲除株和对照组的FMI和平行距离测试接近于零,意味着两者对化学引诱物没有任何偏向(F1C、D)。外泌体被一致地包被在孔板上,数据显示外泌体携带了一种能增强方向性移动的组分,当其以一种无极性的方式存在时可以改变细胞在浓度梯度中方向性。
为了判断高浓度的外泌体表面是否饱和以及是否影响细胞反应,我们也进行了低浓度(10ug/ml)外泌体检测。低浓度下对照组细胞迁移速度轻度升高,并且几乎补救了Rab27a敲除株在速度方面的缺陷。比起未包被组,与50ug/ml外泌体包被类似,10ug/ml外泌体包被降低了对照组FMI和平行距离,尽管程度较小。而包被10ug/ml外泌体也可轻度增加Rab27a敲除株的趋化性,使得FMI和平行距离升高并高于对照组的值。因此对于两种包被浓度,外泌体升高敲除株细胞的迁移速度并且与对照组和敲除株的反应相同。然而与未包被对照组相比,10ug/ml组可降低对照组的趋化性但增加敲除株的趋化性。与未包被敲除株对照组FMI相比,50ug/ml和10ug/ml包被组Rab27a敲除株1、2FMI在统计学意义上分别显著降低和升高。这些数据暗示当外泌体分泌时携带一种促进细胞定向迁移的物质,而以相同的方式存在(如包被)时能够消除细胞定向迁移的能力。
F3
:在趋化中,纤连蛋白促进速度,但并对细胞迁移没有方向性。
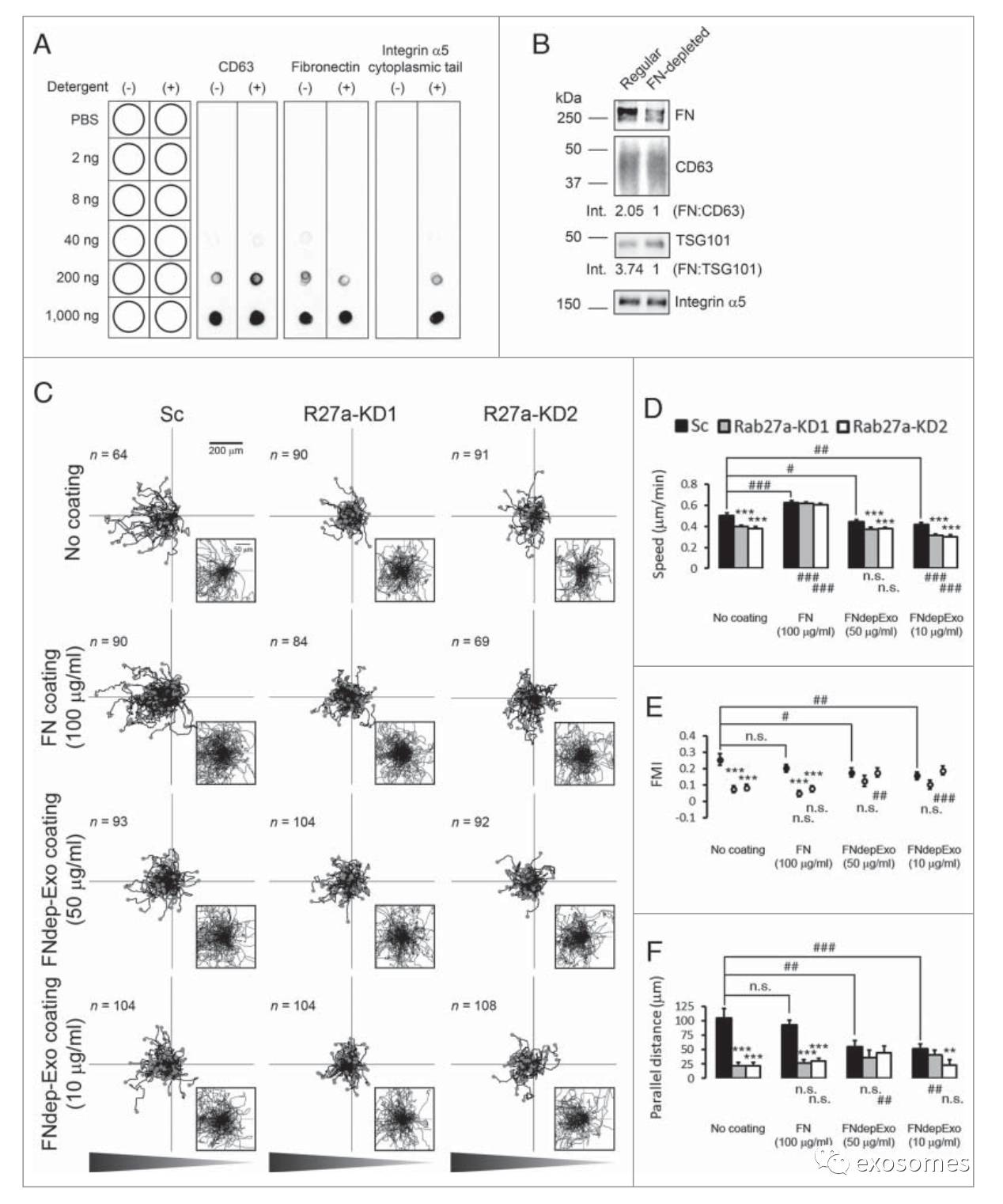
我们先前证实FN是控制HT1080细胞迁移速度的一个关键性外泌体物质,并且通过结合整合素可特异性定位到外泌体。为了证实FN如如预期所想位于外泌体表面,用0.1%吐温-20透化EVs,使用斑点杂交实验区分来自管腔内的EVs表面蛋白。四跨膜蛋白CD63是一种特征明显的外泌体表面蛋白,因此被用作阳性对照。对大细胞外圈使用抗体,CD63在无去垢剂和包含去垢剂条件下均被检测到(F3A)。类似地,FN也在无去垢剂和包含去垢剂条件下均被检测到则说明FN被键合在外泌体表面(F3A)。同样,整合素α5胞质尾区在含有去垢剂的的条件下被检测到而在无去垢剂条件下未检测到,这说明α5具有预期的拓扑学,外泌体腔内和腔外的胞质尾区应可以结合FN(F3A)。
为了检测FN作为外泌体物质是否影响定向迁移,在缺乏FN培养液中培养10天细胞并且收集FN被耗尽的外泌体(F3B)。检测这些外泌体是否可以补救细胞的迁移速度和或趋化性。不像常规外泌体包被,包被无FN的外泌体对照组的迁移速度在高浓度和低浓度(50ug/ml和10ug/ml)下均轻度降低(F3D)。与我们的发现一致,携带FN的外泌体促进细胞迁移速度,但对Rab27a敲除株的速度缺陷没有补救作用。对照组外泌体包被条件下,包被缺乏FN的外泌体削弱对照组细胞向引诱物的定向迁移,尽管在50ug/ml下但这种效应并不如对照组的抑制作用那么强烈。在缺乏FN存在的外泌体包被组,敲除株细胞趋化性大体上仍被抑制,与对照组趋化性相似(F3E、F)。这些数据暗示外泌体FN的存在或缺失主要影响细胞迁移速度而不影响方向性。
为了进一步检测在化学引诱物梯度中FN是否影响迁移的定向性,我们用高浓度(100ug/ml)的FN统一包被趋化性实验中的孔板。正如预期所料,此次包被补救了Rab27a敲除株在速度方面的缺陷,而并没有补救趋化性缺陷(F3C-F)。此外,包被FN的对照组对趋化性梯度仍能继续识别和迁移,意味着FN不可能是消除趋化性的外泌体组分。总而言之,这些数据阐明了外泌体对细胞迁移的速度和方向至关重要,而FN对黏附形成和整体迁移速度是非常关键的组分,另一组分或其他多组分必须主要调控定向迁移反应。
F4
:在癌症细胞趋化时,对于外泌体分泌功能的假设模型。
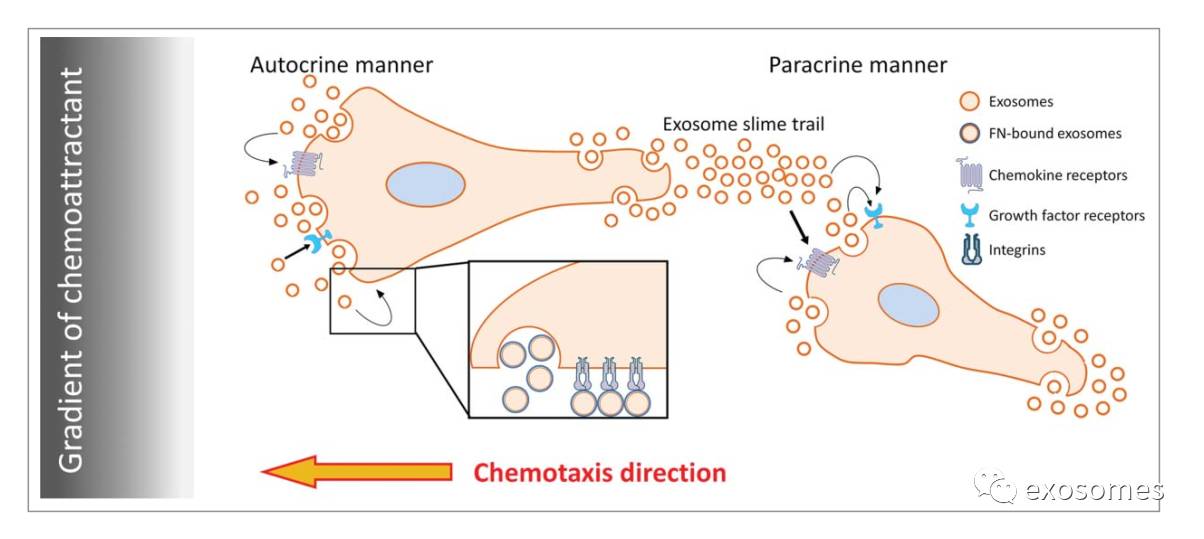
过去十年中关于外泌体和多囊泡的研究迅速增加。尽管一些实验已报道了生物起源的分子机制、组分分类、外泌体分泌,但外泌体调控细胞行为的分子机制仍未阐明。我们先前的研究表明,在体内外泌体的分泌促进细胞迁移速度,定向迁移以及肿瘤细胞迁移的持续性。然而在没有方向性诱因的体外实验中仅对于探究外泌体在促进细胞迁移速度中起作用。在这个研究中,我们发现Rab27a敲除株肿瘤细胞对缺乏外泌体的血清梯度无趋化性。另外,我们发现使用外泌体统一包被孔板表面而不是多囊泡或FN,可阻碍对照组细胞的趋化性。这些数据暗示原位自分泌的外泌体对趋化性反应发挥作用,并且包含方向性诱因。任何检测细胞原位外泌体浓度差异的实验很可能被高浓度的外泌体抑制。外泌体包含大量影响细胞运动多个方面的生长因子、趋化因子、ECM蛋白、受体和蛋白酶。我们先前证实了FN作为外泌体的组分可促进HT1080细胞的迁移速度。在这个报道中我们确证、发现并且进一步观察到FN在控制细胞定向性迁移中并不起主要作用。相反可能是肿瘤细胞外泌体携带的其他分子如趋化因子、脂质介质或其他分子调控肿瘤细胞的趋化性。热应激肿瘤细胞包含趋化因子的外泌体作为树突细胞的引诱物而被了解。Majumdar报道称中性粒细胞分泌的外泌体合成并携带化学引诱物白三烯B4(LTB4).外泌体上的LTB4增强中性粒细胞对自分泌和旁分泌的fMLP的趋化性。尽管我们并不确定外泌体中的组分是否驱使纤维肉瘤细胞HT1080的自分泌趋化性,但我们的数据与先前的发现完全一致,这就意味着外泌体中的多个组分共同增强细胞迁移的不同方面未来的研究应进一步阐明这些物质。(F4)我们也期待在其他肿瘤细胞型中,其他ECM组分也能够有和FN相似的促进迁移速度而不影响趋化性的作用,这个重要假设未来有待检测。总之,我们推断外泌体的自分泌对细胞运动、促进细胞黏附和定向迁移有至关重要的作用。