
本文原载于《
中华眼科杂志》2017年第3期
LGR4 (leucine-rich repeat domain-containing G protein-coupled receptor 4)是G蛋白偶联受体家族成员之一,在包括眼在内的多种器官发育中发挥重要作用,与多种人类疾病的发生密切相关。本文将对LGR4介导的信号通路及其在眼发育过程中的功能和分子机制进行总结。
一、LGR4介导的信号通路
G蛋白偶联受体是哺乳动物体内最大的跨膜蛋白家族,参与机体众多的生理过程
[1]
。该类受体均具有相似结构,为7个跨膜蛋白多肽链
[2]
,可将细胞外信号传入细胞内,发挥生物学作用。G蛋白偶联受体的配体种类多样,包括激素、神经传导物质、趋化因子、离子等
[3]
。许多药物是以G蛋白偶联受体作为直接或间接靶向标志而发挥作用
[1]
。
LGRs (leucine-rich repeat domain-containing G protein-coupled receptors)是G蛋白偶联受体家族中高度保守的一类蛋白,其特征为胞外N末端富含9~18个亮氨酸重复序列
[4]
。该类受体可以分为3个大类。第1类为经典的糖蛋白激素受体,包括促黄体生成激素受体、促卵泡激素受体和促甲状腺激素受体。第2类受体包括LGR4-6,具有高度同源性,在很长一段时间内均未发现其胞外配体,因此其被称为孤儿受体。近几年,数种配体被发现可以活化LGR4-6,激活下游的Wnt信号通路和经典的G蛋白偶联受体通路。第3类受体即耻骨松弛激素受体LGR7和LGR8
[5]
。
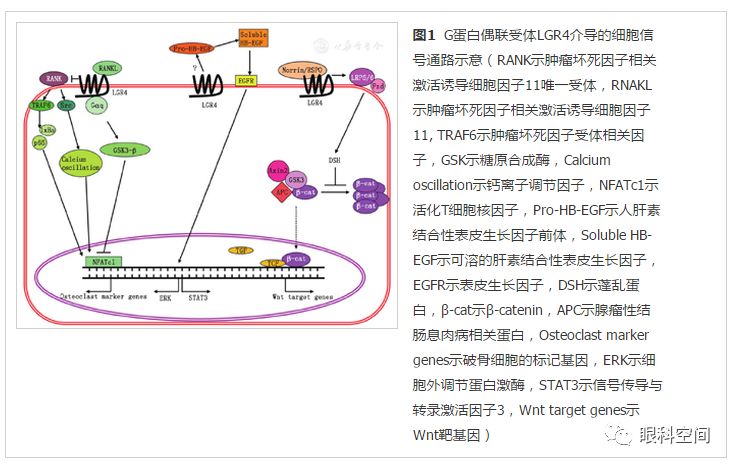
LGR4是具有17个富含亮氨酸重复序列和7个跨膜结构的大分子蛋白,与不同的配体结合后,可以激活不同的下游信号通路。目前研究发现LGR4介导的信号通路主要有3条(图1):(1) Wnt/β-catenin信号通路:与R-spondin或Norrin结合后,激活Wnt信号通路。分泌型蛋白R-spondins被证明是LGR4的内源性配体之一
[6,7]
。LGR4与R-spondin结合,抑制肿瘤抑制因子ZNRF3和环指蛋白43表达,增强Wnt与受体Frizzled和辅助受体脂蛋白受体相关蛋白5/6结合,活化下游Dishevelled,使糖原合成酶激酶3磷酸化,导致糖原合成酶激酶3/Axin/腺瘤性结肠息肉病相关蛋白/β-catenin复合物解离,β-catenin在胞内积聚,入核后激活下游转录因子发挥生物学作用
[8]
。Glinka等
[9]
提出在体外LGR4可作为R-spondin受体调控Wnt/β-catenin和Wnt介导的平面细胞极化信号通路。 (2)与肿瘤坏死因子相关激活诱导细胞因子11 (tumor necrosis factor related activation-induced cytokine,RNAKL)结合后,激活G蛋白偶联受体通路。LGR4可以通过与RNAKL结合,活化Gαq和糖原合成酶3-β来抑制活化T细胞核因子1蛋白(nuclear factor of activated T-cells, cytoplasmic 1 ,NFATc1)的核转录。另一方面LGR4可以与RNAKL唯一受体(RANK)竞争结合RNAKL,从而抑制RANK下游的信号通路而抑制NFATc1的核转录。 (3)激活上皮生长因子受体(epidermal growth factor receptor,EGFR)信号通路。Wang等
[10]
在研究小鼠眼睑发育过程时发现,LGR4可以通过活化人肝素结合性表皮生长因子(human heparin-binding epidermal growth factor-like growth factor,HB-EGF)激活EGFR信号通路,在眼睑上皮细胞的迁移和增殖中发挥作用。此外,LGR4还可以通过经典的环磷酸腺苷信号通路调控盐皮质激素
[11]
、雄性生殖系统中的雌激素受体α
[12]
、骨形成及血细胞发育中的转录激活因子4 (activating transcription factor 4,ATF4 )
[13,14]
以及眼发育中的Pitx2 (Paired-like homeodomain transcription factor 2)因子
[5]
等,但目前还未找到LGR4激活这些通路的胞外配体。通过调控这些信号通路,LGR4在小鼠和人类的发育以及正常生理过程中发挥着非常重要的作用。
二、LGR4在发育中的作用
小鼠与人类的LGR4表达存在明显差异。在成年小鼠中,LGR4主要在肝脏表达,其次是肾脏,在肌肉、心脏和大脑中呈现中等水平表达,在睾丸和肺内表达量较低
[15]
。在初生小鼠中,LGR4在肾脏、肾上腺、胃、脊柱、肋骨、大脑、鼻腔、心脏及肠道中呈现中等水平表达,在肝脏、肺及脾脏中呈现低水平表达,在骨骼肌和胰腺中无表达。在成年人类中,LGR4在胰腺中的表达量最高,在肝脏、心脏及肌肉中呈现中等水平表达,在大脑和肾脏中表达量较低
[15]
。
LGR4
-/-
小鼠60%在胚胎发育期死亡,出生后40%死于围产期
[16]
。LGR4
-/-
小鼠胚胎发育迟缓,体重低主要因肝脏和肾脏的重量不足,同时伴有一系列生长发育异常,包括:(1)红细胞生成障碍,表现为妊娠中期小鼠个体小于野生型小鼠,肉眼观察胚胎颜色比野生型苍白且无血色,血细胞生成异常
[14]
;(2)骨发育异常,胚胎成骨细胞分化障碍,破骨细胞功能增强
[17]
,影响胚胎骨的发育,导致成年后骨密度降低
[13]
;(3)胆囊和胆囊管缺如,胆道癌的发生率增加
[18]
,但不影响正常的肝胆管和肝内胆管发育
[19]
;(4)体内电解质平衡紊乱,LGR4可以调节盐皮质激素受体的表达,这使得LGR4在调节体内电解质平衡中发挥一定作用
[11]
;(5)生殖系统损伤,LGR4
-/-
雌雄小鼠均表现出生殖系统损伤,这与LGR4
-/-
小鼠低出生率相关
[12,20,21,22,23]
;(6)肠道发育异常,炎性反应性肠病的发生率增加
[24]
,胃癌的淋巴转移
[25]
也被证明与LGR4的表达异常有关;(7)毛囊发育异常
[26]
,乳腺导管的分化和延长出现异常
[27]
等。
三、LGR4在小鼠眼发育及相关疾病中的作用
在眼发育过程中,LGR4的表达呈现出精细的时空调节模式。在小鼠胚胎第12.5天,LGR4主要在视杯与表面外胚层之间的一层间叶细胞中表达。到了小鼠胚胎第16.5天,可以在视杯的尖端和间质中检测到高浓度的LGR4表达,这部分组织随后将发育成虹膜和睫状体,但在角膜、视网膜、晶状体中含量较低。到出生后,小鼠的睫状体、虹膜基质、晶状体及角膜上皮细胞层持续高表达LGR4,在角膜基质细胞及上皮下细胞中LGR4表达量降低
[28]
。成年小鼠在晶状体上皮细胞、神经节、内核层、虹膜基质及外睫状体细胞层中表达LGR4
[5]
。
对基因敲除小鼠进行研究,发现小鼠敲除LGR4基因后会表现出不同程度的眼部发育异常,包括小眼畸形
[5]
、角膜炎性反应、角膜囊肿、角膜血管翳、角膜局部混浊并伴随角膜新生血管、白内障等,且在雄性小鼠中发病率较高
[5]
。LGR4可以通过环磷腺苷效应元件结合蛋白信号通路调节Pitx2的表达,而Pitx2在眼的发育中具有重要作用。Pitx2表达异常会出现Axenfeld-Rieger综合征和眼前节发育不良等眼部发育异常性疾病
[5]
。因此,LGR4在眼的发育过程中起着重要的作用。
(一)LGR4与眼睑发育及相关疾病
眼睑的发育是一个动态过程。小鼠眼睑发育开始于胚胎第11.5天,由角膜周围逐渐向眼中心延伸,在胚胎第15.5~16.5天,眼睑完全融合,融合的眼睑可以作为保护层,维持眼的正常发育,在出生后第12~14天眼睑睁开。多种细胞因子作用下的细胞增殖、分化和迁移等过程,在眼睑的发育中发挥重要作用。眼睑发育不良将导致出生眼睑闭合不全,即出生时上下眼睑无法完全闭合,部分眼球暴露,出现角膜炎性反应。相关研究发现敲除LGR4基因后小鼠在胚胎发育过程中眼睑无法融合,导致出生后眼睑闭合不全
[29]
,说明LGR4在眼睑发育中起着非常重要的作用。
在小鼠胚胎第14~16天,眼睑顶端基部上皮细胞和间质表达LGR4。LGR4
-/-
小鼠在胚胎第12.5天,眼睑形态与正常小鼠相似,但眼睑上皮细胞增殖速率降低;在胚胎第14.5天,可以观察到眼睑上皮细胞丝状伪足减少
[29]
;到了胚胎第15.5天,眼睑向角膜中心迁移的速率减慢
[30]
。在眼睑发育过程中,正常小鼠在胚胎第15.5天时可以明显检测到EGFR磷酸化,同时期的LGR4
-/-
小鼠眼睑内的EGFR磷酸化水平明显降低,但两者的总EGFR蛋白水平差异不大
[29]
。
后续的体外实验研究发现,敲除LGR4基因后角质细胞中EGFR的磷酸化水平下降了1.6~2.0倍,但EGFR总水平基本不变。LGR4
-/-
角质细胞HB-EGF分泌的量明显下降,并且EGFR、细胞外调节蛋白激酶及信号传导与转录激活因子3的磷酸化水平也明显下降,同时细胞的增殖和迁移能力下降。在LGR4
-/-
角质细胞培养基中增加HB-EGF的量,EGFR、细胞外调节蛋白激酶信号传导与转录激活因子3的磷酸化水平以及细胞的增殖和迁移能力恢复。由此说明,LGR4是通过调节HB-EGF的表达以激活EGFR信号通路,从而影响眼睑上皮细胞的增殖和迁移,在眼睑的发育中发挥作用
[10]
。
(二)LGR4与角膜发育及相关疾病
在LGR4
-/-
小鼠中,角膜损伤非常常见。在LGR4
-/-
小鼠的眼发育早期阶段,角膜上皮细胞的增殖和分化明显减慢,出现角膜上皮发育不良,并伴有角膜炎性反应、角膜囊肿、角膜血管翳等
[5]
。在维持角膜正常生理功能方面起重要作用的角膜外基质蛋白,如胶原蛋白Ⅰ、胶原蛋白Ⅴ、双糖链蛋白聚糖、骨诱导因子重组蛋白、角蛋白、光蛋白聚糖等
[31]
,表达量明显下降,导致角膜透明度降低,角膜细胞生理功能和角膜结构异常
[32]
。
敲除LGR4基因后,对眼前节发育至关重要的一个转录因子Pitx2的表达量明显下降,导致两个维持胶原蛋白稳定的主要酶Plod1和Plod2的表达量下降,从而影响角膜的正常发育
[5]
。此外,敲除LGR4基因后,眼睑发育异常以致无法闭合,不能在眼表起到保护层的作用,从而无法很好地维持角膜的正常发育。
(三)LGR4与虹膜发育及相关疾病
青光眼是一种以不可逆性视神经损伤、视野缺损为特征的致盲性眼病,最常见的病因是各种原因导致的房水循环障碍,使眼压升高
[33]
,如前房角狭窄甚至关闭、小梁硬化等。LGR4
-/-
小鼠会出现虹膜发育不良,在虹膜发育早期,平滑肌激动蛋白表达量明显减少,导致虹膜平滑肌发育障碍,虹膜收缩功能异常,睫状体变小,弹性减弱,致使小梁网被压缩,梁样结构减少,部分虹膜角膜角较窄的小鼠会出现前房角完全关闭的状态。42%LGR4
-/-
小鼠在出生6个月时可以检测到视网膜内核层神经节细胞减少和外核层损伤,这说明敲除LGR4基因导致的虹膜发育不良与早期发病的青光眼有关
[5]
。















