

在过去的十几年间中国的药物研发正以一个新生儿的姿态迅速发展, 特别是在生物药领域, 多个中国本土的生物制药公司已在全球范围内展露头角。今年Wall Street Journal 就曾发表文章就这一变化进行了报道。在中国制药蓬勃发展的同时我们也应该看到, 很多制药公司的成功是基于生物技术的改造和创新。我们自身的研发经验和能力, 特别是新靶点的发现和开发还是初期的。一个直接后果就是我们的新药开发的靶点相对集中并单一。目前国内关于PD-1和PD-L1的开发占据了绝大部分中国生物药的市场, 其他的也多是几个经典的靶点,例如CD20, HER2, VEGF等。那么下一个药物研发的明星靶点在哪里呢? 我们是否准备好去迎接下一个挑战了呢?
新药开发从靶点确定到成功上市需要至少10到15年的时间,总花费超过一亿美元。靶点的来源是多道渠的,可以是科研机构的最新研究成果, 药厂内部研发以及临床开发。笔者根据个人的经验大致介绍一下目前大药厂比较通用的前期开发流程,特别是前期的靶点确定和验证。笔者想指出的是不论是大的老牌药厂,还是小的创新公司,目前药物研发现状都不是太乐观。表一是2006 – 2014 年几大药厂的科研投入和产出的一个概况(表一)。本文旨在总结现有的通用模式。希望大家见仁见智,为未来的药物研发找到新的有效之路, 特别是在靶点评估的认知上和宏观机制的建立上有所突破。
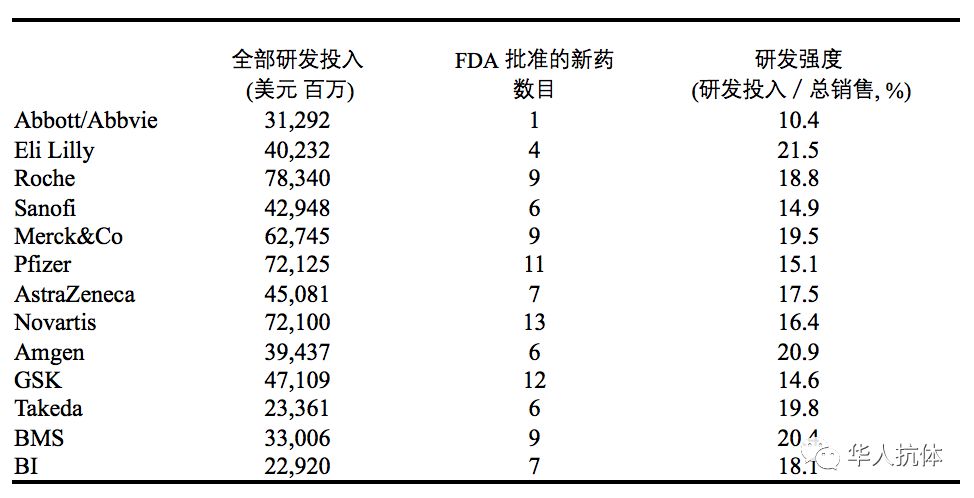
表一 跨国制药公司研发效率(2006年–2014年)
总体来说,药物发现和开发有以下几个关键步骤(图一)。最初的四步是通常认为的早期药物发现阶段,一般需要6到7年时间。一旦项目转入临床实验,则是进入了开发阶段。这也就是通常所说的“临床前”和“临床”开发。
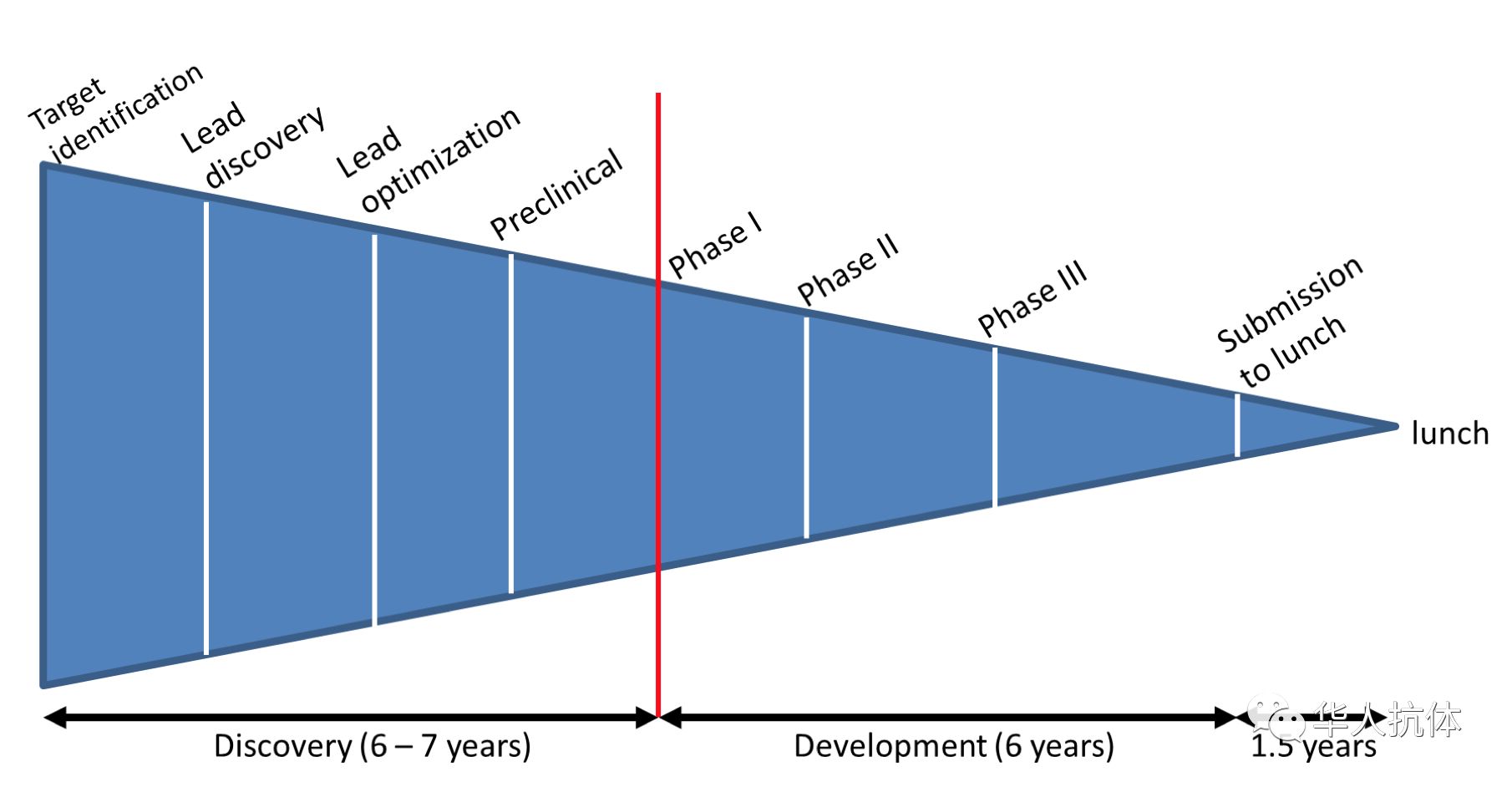
图一 从最初的靶点识别到最终产品上市之间药物发现和开发的不同阶段
临床前和临床实验部分通常是由不同的功能部门来负责,也会有不同的团队负责人。这有时候会导致一个不理想的实际情况,那就是两个部门之间缺乏有效和及时的沟通。很多情况下,在早期药物研发的过程当中,临床实验和商业发展策略都不能被充分考虑到。我用两个不太理想的例子来开始这个话题。
示例1
:
一种细胞表面受体因其对血管疾病,特别是动脉粥样硬化的发病机制的贡献而获得很好的支持。有了强有力的临床前实验支持,一个新的寻找阻止受体激活的拮抗性抗体的项目开始了。项目开始三年之后,一个亲和力高,表现良好的抗体被成功的发现和优化了。该项目被提名转入下一步发展,即临床一期。但是,针对动脉粥样硬化的临床实验一般不受开发团队的欢迎。因为这些临床实验是巨大,漫长和昂贵的。所以临床团队要求一个更精确选择的患者亚群来更有效和成功地开展临床实验。最后,这个项目被推迟一年,以便找到和评估合适的疾病适应症来启动临床实验。
示例2
:
这个例子是与专利和竞争有关的。在一个大公司的内部研究中发现一种新颖的血清蛋白在体重和胃口调节中发挥重要作用。马上大量的资源就投入进来,积极推动这个项目的发展。大概一年之后,一个小公司注册了一项专利,作用于同一个靶点。在那个时刻非常明确,这个小公司的研究至少领先三年。内部的努力仍然继续进行,开发团队也并未立即考虑应对专利问题。研发团队采取这样的方式一方面是因为缺少与商业产权智能部门的沟通,另一方面也是因为过高的信心。两年之后,内部的候选药物被筛选出来。此时团队也发现因各种原因的影响,和小公司的商业谈判是不可避免的。与小公司的商业讨论和谈判此时才进入正式日程,整个谈判过程进行了一年多。为了达成最后的协议,大公司必须同意的一个前提条件是: 小公司的候选药物必须作为主导化合物而其内部研发的产品只能作为备选。在这个具体例子中,如果专利问题能够在一开始就得到重视和解决,那么内部研发的策略一定会相应的有所调整。这些调整可能帮助节省几年的前期开发时间和资源。在旁观者看来,这似乎是研发团队应该采取的一个显示易见的前期战略调整。但很遗憾的是,这种非理想状况还是很普遍的。试问中国现在在做P D-1和 PD-L1的公司有多少把专利问题放在重要地位并有相应应对措施了呢?
那么在发现药物靶点的过程中,我们具体应该考虑些什么呢?在接下来的部分,我将聚焦新靶点评估的五个方面。如果每个方面积两分,加起来就形成了“
十分规则
”(图2)。总分越高,靶点越理想。

图二. 评估靶点的十分规则
1. 未满足的医疗需求
。未满足的医疗需求意味着:1)没有可用药或者现有的治疗方案在疗效或者安全性方面存在很大的局限性;2)合理的市场规模。即使一个靶点已经被成功用于一种适应症,通过寻找可能起作用的另外的适应症来扩大其治疗领域可能也是很有必要的,专业术语我们称之为“共同机制潜力”。这允许扩大药物的治疗范围,或者如果在发展的后期阶段对预期的适应症产生困难,则可以改变目标。
在考虑是否有未满足的医疗需求时,目标患者人群应当越早考虑越好。此外,患者人群应当尽可能具体。就像上面第一个例子中,准确的患者人群为设计临床实验提供了一条清晰路径。准确的患者人群对于发现新的未满足的医疗需求也很有帮助。以心脏衰竭为例,低收缩分率心衰竭(HFrEF,收缩衰竭) 的患者有多种选择。然而,正常收缩分率心衰竭(HFpEF,舒张功能衰竭)的患者没有有效的治疗方法。因此,针对HFpEF的靶点应该得到两分,而HFrEF的目标只能得到0.5-1分。在实践中,咨询转化医学(translational medicine, TM)领域的专家是非常有价值的。 TM专家经常接受过医学培训,具有治疗病人的经验,同时具有研究背景。他们的意见可以有效地弥合临床前研究和医疗需求之间的差距。
2. 竞争/同类最优
。在这个练习中,应该分析确定患者人群当前的治疗方案。确定标准护理的局限性,并考虑提案靶点与护理的相互作用。其他公司现有的,包括临床前和临床试验的任何活动都需要进行总结和评估 。对“自由实施”(FTO)的早期分析可确保在不侵犯他人的有效知识产权的情况下开展某些特定研究,例如开发目标调节物的检测方法。
一个新颖的靶点意味着有机会提交一份新的专利,从而产生知识产权。只有公司拥有针对靶点的调节物商业使用的专有权,才能实现全部投资回报。如果我们没有由专利保护的候选药物,我们就无法保护自己,对抗竞争对手。由于许多靶点最初是在科学文献中确定的,所以在证实程度和基于给定靶点的竞争之间通常存在直接的相关性。一些公司在选择靶点时不愿意承担风险,而更愿意接受较大的竞争,而其他公司则愿意接受更多的科学风险来减少竞争,希望开发新型的药物。无论采取哪种做法,竞争越少,靶点在竞争类别中得到两分的可能性就越大。
3. 靶点评估
。对于中止的药物开发产品和失败的临床试验的分析表明,大多数化合物由于不符合疗效终点而失败。 2008年至2010年失败的II期临床试验中有51%是因为因疗效不足(参考文献 1)。此外,2007 到2010年间,所有治疗领域的失败有67%归因于 III期临床试验缺乏疗效(参考文献2)。因此,预测性临床前模型中的靶点验证和新的候选药效评估是药物发现成功的关键。具有强烈确定性的理想药物靶点应具有以下性质:1)疾病调控和/或在疾病的病理生理学中具有证实的证据; 2)在生理条件下对靶点调控的响应最小; 3)靶点表达不是均匀分布的,而是具体的和发病区相关的; 4)基于表型数据的有利副作用概况,例如k.o.小鼠或基因突变数据库。
3a. 靶点评估的可重复性
当药物靶点是基于使用体外或体内临床前模型的文献报道而提出时,可重复性需要认真考量。拜耳公司审查了67份报告,安进公司也试图重复 53份文献中的数据。两者都发现60-70%的文献报道的数据缺乏可重复性(参考文献3和4)。内部的靶点识别工作也有不能被重复的现象。因此,缺乏重现性应当被合理衡量 。不同机构报告的相同观察结论,往往有助于减少一些风险。内部重复关键的报道结果是必要的。
3b. 靶点评估的可转化性
如果靶点在临床前模型中被证实是有效的,那么可转化性需要被充分了解。缺乏疗效导致II期临床试验的高失败率,其中许多失败是由于临床前模型无法如实地展现人体中该疾病的通路所致。有些模型承诺对人类的情况具有高度的预测性,而其他许多模型则显示出巨大的差异。此外,一些疾病仅限于较高级的灵长类动物,只能使用临床前的非人类灵长类动物模型来模拟。
与临床前模型相比,人类基因学研究具有明显的优势:实验是根据人体样品进行的,所得到的观察结果本质上与人类疾病直接相关。任何具有人类基因支持的靶点,相对其它支持数据的靶点,可被认为是更准确和有效的,即使其背后的机制尚未被很好地理解。评估中此类靶点也应得到相对的高分,如果不是满分两分的话。人类基因学的最新进展使全基因组关联研究(GWAS)能够识别出许多具有复杂遗传性的疾病的基因突变。这些研究成功揭示了已知和新型的治疗靶点。孟德尔随机化研究能够评估生物标志物与人类疾病之间的因果关系。功能丧失研究能够鉴定携带功能丧失等位基因的个体并测试与表型的关联(疾病终点或生物标志物)。这些功能丧失突变导致药物靶点终生失活,模拟药物抑制剂。因此,这些突变可以用来推断潜在的临床疗效和与药物相关的潜在副作用。
如果没有人类基因学证据,一般而言药理学验证比临床前研究更为可信。正在进行的临床试验中的药物治疗或阳性结果为靶点提供了强烈的药理学支持。只要有可能,这些工具化合物应纳入新候选药物的体内研究。举例来说,癌症中的新药靶点不仅应该通过检测其在转基因或基因敲除小鼠对肿瘤重量的影响来验证,还应当评估这种效果是否在进行抗癌药物的治疗时仍然能观察到。这也是一个靶点调控物在临床上必须面对的情况。
有些靶点有大量的临床前数据发表,看起来十分有吸引力。但是笔者以为,如果没有任何人类基因或临床数据的前提下,此类靶点的评估分不应高过一分。实际上很多临床二期失败的靶点正是这类靶点。对于此类靶点,早期研发和验证中应集中精力去尽早的产生人类相关的数据支持。
3c. 靶点评估的靶点调控动力学
理解靶点调控的动力学对于靶点验证是必要的。例如,突变BRAF是黑色素瘤治疗的有效目标。然而,威罗菲尼片(Vemurafenib)治疗BRAF突变结肠直肠癌(CRC)意外地不如黑素瘤那样有效。事实上,在CRC中EGFR-RAS-CRAF快速重新激活p-ERK产生了对BRAF抑制的固有抗性。为了进一步调控动态反馈回路,与EGFR抑制剂联合阻断p-ERK再激活可能是CRC治疗的一种有效方法。靶点动力学在癌症治疗中尤其重要,因为癌细胞对选择性压力的适应是肿瘤生长所固有的。了解疾病生物学背景中同时发生的基因/通路的复杂性,可以加强有效药物靶点的选择并且可以通过联用方法获得临床疗效。
3d. 靶点评估中针对潜在不良事件的早期评估
由于多效性,相同的靶点可能在不同的器官系统或在发育和成年期的不同时间点具有不同的功能。因此,察看整个人体中目标靶点的表达水平是有帮助的。虽然有一些例外情况,但可以认为,当药物必须全身给药时,表达范围越广,发生不良事件的风险就越高。靶点在代表患病与健康对照的样品中的差异表达,是有助于早期评估假定的与靶点相关不良事件的另一个参数。举例来说,质子泵抑制剂用于治疗胃逆流疾病有极高的耐受性,很大程度上这是因为其胃分子靶点(胃H + / K + ATP酶)仅在胃粘膜中的表达。但是,这些描述性标准的相对重要性因具体适应症而异。例如, 与不太具有破坏性的疾病(如过敏或炎症)相比,危及生命的癌症,靶点相关不良反应的耐受性要高得多。
3e. 靶点评估的工具和数据库
有很多资源/数据库能为靶点评估提供有用信息。下面是一些示例:
蛋白质结构和功能
1.
Uniprot: http://www.uniprot.org/
2.
Protein Data Bank: http://www.rcsb.org/pdb/home/home.do
3.
ExPASy: http://www.expasy.org/
基因、通路、病理学和生物学
1.
BioGPS: http://biogps.org/#goto=welcome
4.
GeneCards (human gene database): http://www.genecards.org/
5.
GTEx Portal: https://gtexportal.org/home/
6.
MGI (Mouse genome informatics): http://www.informatics.jax.org/
7.
The human protein atlas: http://www.proteinatlas.org/
8.
Expression Atlas: https://www.ebi.ac.uk/gxa/home/
9.
Drug Bank: https://www.drugbank.ca/
10.
TTD (Therapeutic Target Database): https://db.idrblab.org/ttd/drug/d0a7wo
竞争、临床实验和商业智能
1.
Cortellis: https://cortellis.thomsonreuterslifesciences.com/ngg/ (fee-based)
2.
Parmaprojects: https://novartis-pipeline.citeline.com/CpAccount.aspx (fee-based)
3.
GlobalData: www.globaldata.com/healthcare/research-areas/pharmaceutical (fee-based)
4.
DrugPatentWatch: www.DrugPatentWatch.com (fee-based, patent-focused)
5.
Tarius: www.tarius.com (fee-based, regulatory)
6.
United States Patent and Trademark Office: https://www.uspto.gov/
7.
Clinical trials: https://clinicaltrials.gov/
8.
FirstWord Pharma: https://www.firstwordpharma.com/sso/authenticate
Cortellis和Pharmaprojects是收费的生物制药商业智能数据库。Pharmaprojects提供从实验室到患者的全球医药研发管线的逐步跟踪,包括公司发展趋势,全球发展状况和每个目标靶点的治疗类别状况。 Pharmaprojects还链接到Trialtrove,Trialpredict和Sitetrove数据库的临床试验情报。 Cortellis提供三个模块的信息:1)竞争情报 (Competitive Intelligence),包括管线,交易,财务,预测和公司简介; 2)临床试验情报 (Clinical Trials Intelligence),包括试验设计,终点,联合治疗和不良事件; 3)监管情报 (Regulatory Intelligence),有助于跟踪监管变化,了解提交途径和当地规则,比较各国的监管要求,进行上市前后药物监测。如果可以访问,上面列出的其他更聚焦的数据库也值得一看 。
4. 可开发性
。有很多蛋白质靶点已经成为成功的小分子或生物药的靶点。酶,受体,离子通道,转运蛋白和转录因子是小分子抑制剂或激活剂的典型类别。跨膜或细胞表面受体,细胞外蛋白质或蛋白质复合物,底物和代谢物通常是生物制剂(包括抗体,抗体 - 药物偶联物(ADC)和重组蛋白质)的靶点。受体构成了最大的一类药物靶点,约占人类药物靶点的45%。 G蛋白偶联受体(GPCR)代表了约35%的药物靶点。由于ATP结合位点在整个激酶组中是非常保守的,所以开发高度特异性的激酶抑制剂仍然是困难的。近年来,除去已经发现的药物靶点类别,使用新型药物(如RNA和改造细胞)可以考虑以前不可药用的蛋白质类别。通过创新的方法,可药用的空间可以从蛋白质进一步扩大到其他类别,如核酸。
5. 开发的时间和策略















