利用免疫效应细胞治疗癌症方面近几年来已取得了很多惊人成就。用CARs定向改变T细胞以医治血癌取得了显著的临床效果,有关使用CARs改良NK细胞的研究还维持在临床前的阶段。在本篇综述中,我们的主要内容是针对于NK细胞的改良,尤其运用临床前的数据,证明基因改良后的NK细胞在识别并靶向杀死细胞的高效率性堪比T细胞的效率。我们旨在讨论引入CARs为主要的NK细胞和其他NK细胞系提供靶向抗体,定向改良NK细胞的挑战性、临床前以及早期临床研究中支持以CARs改良过的NK细胞的效率的证据。CAR-NK细胞作为一种细胞免疫对于恶性肿瘤的状况改善有着广阔前景。NK细胞可以提供“现成”的产物,不需要为病人订做,而CAR-T细胞是为病人订做的治疗方式。通过嵌合抗原受体CAR的表达,来更直接的使用改良后的NK细胞毒性对抗恶性肿瘤,加速了对癌症治疗的进程。
改造免疫效应细胞以治疗癌症在过去的几年里取得了巨大的进步,嵌合抗原受体(CARs)被广泛用作重定向自体T细胞,可特异性针对淋巴白血病和淋巴瘤,且具有显著的临床结果。已被报道的重大突破即急性淋巴细胞性白血病(ALL),据报道在单次靶向CD19的CAR-T细胞进行化疗之后,尽管有些病例中其细胞存活时间不长,总缓解率可达90%。(即使是在重度预处理的儿童和成年人中)早期试验CD19-CAR-T细胞的良好成果使得目前有很多人努力争取让这门治疗技术得到更广泛的使用。
尽管如此,CAR-T细胞还是具有一些实际应用上的限制。为个人产生的自体移植的CAR-T细胞很难处理,也很难运用到广泛的临床层面。制作CAR-T细胞一般需要好几周,这就使得它无法治疗一些会迅速发展的疾病。但是,要从重度预处理的病人体内收集足够允许成功临床运用的淋巴细胞(通常是淋巴细胞)也并非会总是成功。同种异体的“现成的”产物可以克服这个不足,虽然,通过原生α-Β T细胞受体(TCR)的异体T细胞(即使和人体白细胞抗原[HLA]匹配)具有移植抗宿主病(GVHD)的重大风险。
NK细胞是高细胞毒性免疫因子,通过非特定的方式杀死他们的靶细胞。NK细胞没有造成GVHD的潜质,也提供了制作“现成的“同种异体的可用于免疫临床治疗的可能性,此外,正如报道所说,因为改造后的NK细胞仍会保留原本具有的抗体,当CAR-T细胞的特异性靶向抗原数量减少的时候,NK细胞仍具备通过其机制抗癌的能力,这在理论上可以降低癌症复发的概率,CAR靶向抗原减少时的产生的耐药性也可以得到减缓。因此,NK细胞的这种内在特性使得NK细胞成为可帮助免疫治疗的候选之一。通过基因改造引入抗原靶点来增加NK细胞的抗肿瘤翻译是一个在癌症免疫肿瘤学领域可深入研究的课题。
在本篇综述中,我们针对NK细胞工程的最新进展,特别是关于NK细胞在基因改造后可能和T细胞一样可以有效识别并杀死目标的临床前证据进行描述。我们旨在讨论引入CARs为主要的NK细胞和其他NK细胞系提供靶向抗体,定向改良NK细胞的挑战性、临床前以及早期临床研究中支持以CARs改良过的NK细胞的效率的证据。
NK细胞是一种运用毒性快速对抗癌症以及病毒感染细胞的无需抗原预先致敏的先天免疫因子,于是便有了“自然杀手“这一称号。NK细胞调节的细胞毒性发生在无限白细胞抗原的情况下(HLA),这也是癌症免疫疗法中的理想情况,尽管NK细胞在遇到并识别人类白细胞抗原(HLA)蛋白后具有细胞毒性,这也被称为获得“许可”或NK细胞的学习过程。NK细胞的特点是不表达CD3/TCR复合物、缺少CD16和CD56膜抗原的表达。大多数NK细胞存在于外周血、肝脏、脾脏和骨髓中,在淋巴结中相对存在较少。
NK细胞的功能包括细胞脱粒、细胞因子的释放、细胞毒性,由可识别细胞上配体的抑制受体、异二聚体C型凝集素受体[NKG2A]和激活受体(特别是自然杀伤受体[NCRs]NKp ] NKp46, NKp30, NKp44,以及C型凝集素激活受体 NKG2D7)接收到的信号之间的平衡来调控。这些受体也因此需要机制防止自己被无意识的激活进而对抗正常组织,即“自我耐受性”。 HLA类蛋白和KIRs(iKIRs)相结合传递抑制信号,进而使NK细胞的效应反应的过程被阻断。通过一个所谓的“丢失自我”的假设概念,当成熟的NK细胞转变为缺乏HLA的细胞,这个过程会发生在病毒或恶性转化过程中,其表面的抑制性受体没有被激活。在这个情况下,NK细胞也没有收到抑制性信号。同时,在病毒或恶性转化过程中会发生细胞应激和DNA受损,细胞应激激活NK细胞受体,使NK细胞杀死靶细胞。NK细胞可以通过分泌含穿孔素和颗粒酶,表达TNF家族因子来杀死肿瘤细胞,比如FasL和肿瘤坏死因子相关凋亡诱导配体(TRAIL),两者通过各自受体的相互作用诱导肿瘤凋亡。此外,依赖抗体的细胞介导的细胞毒作用(ADCC)是通过与Fc受体CD16来调节的,这可以触发NK细胞脱粒以对抗膜抗体靶细胞。缺少CD56的NK细胞高表达CD16,而高表达CD56的NK细胞低表达或不表达CD16
(Fig.1)
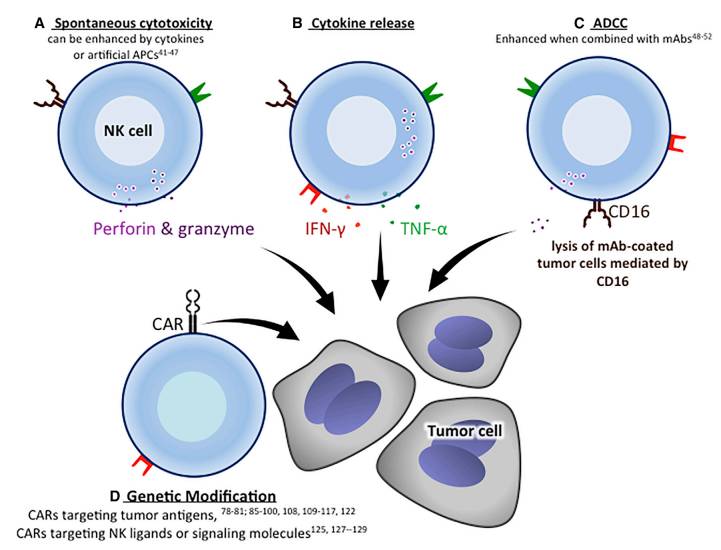
NK细胞的快速杀伤能力和广泛的细胞毒性使NK细胞具有致敏作用,使其可以被用作过继治疗。在体外,NK细胞通过细胞毒性可对抗多种血液恶性肿瘤,其中有AML、ALL、MM(急性髓细胞白血病,急性淋巴细胞性白血病,多发性骨髓瘤)以及一些固体肿瘤,其中有神经母细胞瘤,卵巢癌、结肠癌、肾细胞癌(肾癌)和胃癌。然而,许多肿瘤都有其避免被NK细胞杀伤的策略。举个例子,一些白血病和淋巴瘤细胞表达维持HLA蛋白的高表达,从而避免他们被NK细胞攻击,或者缺少激活NK细胞受体的信号配体。因此,许多团队探索可提高NK细胞活性的策略,包括使用细胞因子和人工抗原呈递细胞(APCs)蛋白共刺激作为以促进增殖。在细胞因子进一步的孵化中,特别是IL-2,IL-5,NK细胞获得了溶解新鲜的和培养的肿瘤靶点的能力,这些靶点通常对于NK细胞的溶解作用是不敏感的。
另一个策略是于单克隆抗体联合治疗以提高ADCC。NK细胞有许多来源,这也可从多个团队的证明中得知。尽管扩增、活化的自体NK细胞的过继治疗在临床试验中安全、具有耐受性,但其疗效依然有限。这可能和HLA的自体抑制有关。来自同种异体源的NK细胞为免疫治疗提供了一个有希望的选择。活跃的NK细胞具有的最有前景的特征是他们具有在不导致GVHG的情况下促进移植对抗白血病、肿瘤Gvl、GvT),以及采用预处理和移植后设定的过继运输同等位基因的NK细胞的临床研究。过继转移同种异体NK细胞在血癌和固体肿瘤中是安全的,尽管他们的临床活动比较温和。许多团队,包括作者,正在探索通过基因改造进一步提高NK细胞杀死肿瘤能力的策略。
CARs可用于改造可通过体白细胞抗原在肿瘤表面识别抗原并杀死其目标的免疫效应细胞。CARs是胞外抗原结合区域,通常是来源于单克隆抗体和细胞内信号域的单链可变片段(scFv),一般是TCR的CD3ζ链。CARs在临床上被用于直接、特异的改造T细胞,关于CAR-T细胞的研究也。不管怎样,靶向CD19的CAR-T细胞有着迅速的反应和持续的对于淋巴系统恶性肿瘤的缓解作用,特别是急性淋巴细胞性白血病(ALL),这也激发了在临床对进一步研究和优化CAR-NK细胞的热情。
相比CAR-T细胞,使用CAR-NK细胞有着其他的优点。比如说,过继治疗时采用自体和同种异体的NK细胞在体内的持久性是有限的。缺乏克隆增殖的NK细胞以及免疫介导的对NK细胞的排斥作用使得在几天内或者几周内不大可能出现释放综合征(CRS)。。而且,尽管一部分病在接受了CAR-T细胞之后没有出现GVHD
(移植抗宿主病)
,大部分CAR-T细胞研究还是使用了同种异体的T细胞。因为同种异体的T细胞(即使是可和人体白细胞抗原结合的)通过原生
α-Β T
细胞受会造成移植抗宿主病。而NK细胞不会引起GVHD(移植抗宿主病),这一点已经通过患有血癌及固体恶性肿瘤患者的单倍体和脐带血(CB)NK细胞的融合得到了证明。因此,NK细胞提供了生产现成同种异体的可立即用于临床使用的产品的机会。此外,比起CAR-T细胞,CAR-NK细胞可以通过他们识别和靶向肿瘤细胞的天然受体保留其潜力,相比T细胞,NK细胞靶向CAR的抗原下调更少。有一种潜在的提高NK细胞能力的方式,即捐赠和KIR受体不匹配的CAR-NK细胞,或是基于单倍体B KIR基因含量的细胞,两者都有利于同种异体细胞的转移。
以前不愿意使用NK进行CAR改良治疗的原因很大程度上是因为不确定它的迁移和渗透肿瘤组织的能力,以及对于CAR-T细胞还不够有信心。这样的想法也和NK细胞在体内的持续性时间有限相关,持续时间短虽然保证了NK细胞的安全性,但也限制了它的功效。此外,现在有关基因改良NK细胞的技术还不够成熟,T细胞利用腺病毒传导的成功也对比出了不同水平下NK细胞传染的低可行性。但是,最近有关病毒性传导和电穿孔的技术,又重燃了对NK细胞基因修饰的热情。也许现在最大的挑战并不是发展合适的CAR疗法,暂且不论效应细胞的来源,最大的挑战应该是很难找到合适的免疫靶抗原。理想的免疫靶抗原应该是能被所用肿瘤细胞表达的而正常组织不表达或极少表达的,这样才会使其仅仅针对于肿瘤细胞发生作用。
NK细胞主要来自于外周血、脐带血(CB)、或造血干细胞祖细胞(HSCPs),NK细胞系被成功的修饰并表达CARs以对抗靶细胞,其中很多使用了CAR-T细胞,CAR-NK细胞在体内或体外杀死肿瘤靶细胞时都是高效率的,尽管迄今还没有关于使用CAR-NK细胞治疗的临床数据的相关报道。
NK细胞过继治疗的研究可以从几个不同的来源来研究.80而自体NK细胞可以在体外可重复产生,它们在对抗自体肿瘤时活性有限,可能不是很容易通过改造细胞表达CAR来克服这一缺陷的. 同种异体NK细胞可以从健康的捐赠者的PB中产生或从CB中扩大出来。
无论来源如何,扩大的、活化的CB或PB衍生的NK细胞都有许多特征,使它们成为基因修饰的有用的效应物。扩大,活化的NK细胞通常表达一系列活化受体,包括CD16,NKG2D和NCR(NKp44 NKp46),尽管捐助者的捐助者的变化。这些活化的NK细胞配备着KIR和 “杀人执照”
。它们在体内扩增和持久力,虽然不如转移T细胞,却与血液系统恶性肿瘤的抗肿瘤活性等试验存在明显联系,如AML。此外,体外扩增原代人NK细胞能比T细胞产生不同光谱的细胞因子,包括:干扰素(IFN)-γ,IL-3其中G、细胞和粒细胞巨噬细胞集落刺激因子(GM-CSF),这可能与CRS的低风险相关。如上所述,与
CAR
修饰的NK细胞,绝大多数仍停留在经验的基础上,结合CAR改装初级人类NK细胞将对一些血液和实体肿瘤抗原,如CD19、CD20、GD2,和HER-2重新靶向治疗。
许多CAR-NK细胞最初的临床前的研究主要集中针对带有抗CD19和CD20-CARs恶性B细胞肿瘤。虽然淋巴细胞缺失后再输注cd19-car-t细胞导致患者CD19+肿瘤复发或恶性剧烈反应,但是伴有BL复发的患者反应则不强烈。
因此,制定针对BL中的CD20的第二代靶向CD20 NK-CAR蛋白,并利用mRNA转染产生。这抗-CD20-4-1BB-CD3ΖCAR被用于基因修饰来自健康献血者中的PB NK细胞,,其在基于K-562饲养细胞系的存在下被激活,并表达IL-15和4-1BB配体(K562-MBIL15-41BBL)。在CAR mRNA转染仅仅16小时后,50%–95%的扩增的PB NK细胞表达CAR蛋白,并且相比于只用利妥昔单表现出显着增强的体外对抗利妥昔单敏感和耐药的BL细胞的细胞毒活性。,同时延长Raji移植小鼠生存。非病毒转染、电穿孔技术介导的表达可以产生强大的CAR介导的杀死,这些CAR蛋白的短暂活性特性会很可能决定在临床上需要重复注射治疗。
我们组最近开发出一种新的方法来产生
CAR-CD19+ NK
细胞的,我们认为解决了所有上述限制。我们用逆转录病毒载体(IC9 /CAR。19、IL15)来修饰CB来源的NK细胞,这样(1)与CAR CD19基因重组
重新特异性的靶向CD19;(2)异位产生细胞因子IL-15这对NK细胞的存活和扩增至关重要。(3)表达自杀基因,诱导caspase-9(ic9)药理活性,必要时可消除转导的细胞。这些基因修饰使工程NK细胞维持足够数量,并在异种移植小鼠模型中保持强大的有效杀灭B细胞白血病或淋巴瘤细胞的功能。
尽管如此从初级NK细胞报告中必须考虑到捐赠者,修饰细胞的转染方法(病毒或非病毒转染)以及不同的扩增方式对于内在固有的NK细胞功能的很大的差异性。而多数临床前报告由于它们广泛的转染效率,效率范围从1%-90%,在原代NK细胞利用逆转录病毒或慢病毒载体进行转染。慢病毒转导蛋白相对于逆转录病毒具有独特的优势。它不需要活性的分离的细胞株,这使得转染原代以及非激活的细胞成为可能。(尽管在非扩张NK原发性细胞被使用的很少)。尽管逆转录或病毒载体是被用来通过讲外源基因整合到宿主细胞基因组上确保转基因持久性表达,一些非病毒的转染方法也给一一研究出来。这些方法包括电穿孔,使得CAR编码的mRNA通过细胞膜上的微孔转染进去。使得CAR蛋白瞬时表达。然而考虑到电转与单纯的慢病毒转染使得PB或CB诱导的NK细胞显著的低转染率(在同一报道中分别<10%和<30%),逆转录病毒转导蛋白可能更适用于用来对原发性或CB NK细胞进行修饰。针对这一问题可能解决的办法是在引发诱导干细胞(iPSCs)以及随后的成熟NK细胞分化过程中,接下来讨论了其他来源的NK细胞的情况。表一总结了迄今为止利用原代CAR NK细胞的临床前试验研究。
尽管支持使用扩增的,活化的CAR-NK细胞取得了令人鼓舞的数据,大多数发表的研究报告利用NK细胞系表达CAR蛋白。虽然存在几个NK细胞系(NKG,YT,NK-YS、HANK-1、YTS细胞、NKL细胞),研究最广泛的是NK-92,一个人类NK样细胞系最初是从一个非霍奇金淋巴瘤(NHL)病人那里建立的。NK-92细胞缺乏几乎所有KIRs抑制子除了KIR2DL4。在NK-92中缺乏的KIRs细胞可能至少部分地解释了它们在体外针对广谱肿瘤靶点的显著活性。
8
有希望的体外实验结果使得NK-92细胞早期被用于超过40种人类恶性肿瘤。然而,尽管重复注射的NK-92细胞比较安全,效果仍然有限;因此,许多团队正在探索利用CAR改装以提高这些细胞的抗肿瘤活性的使用。
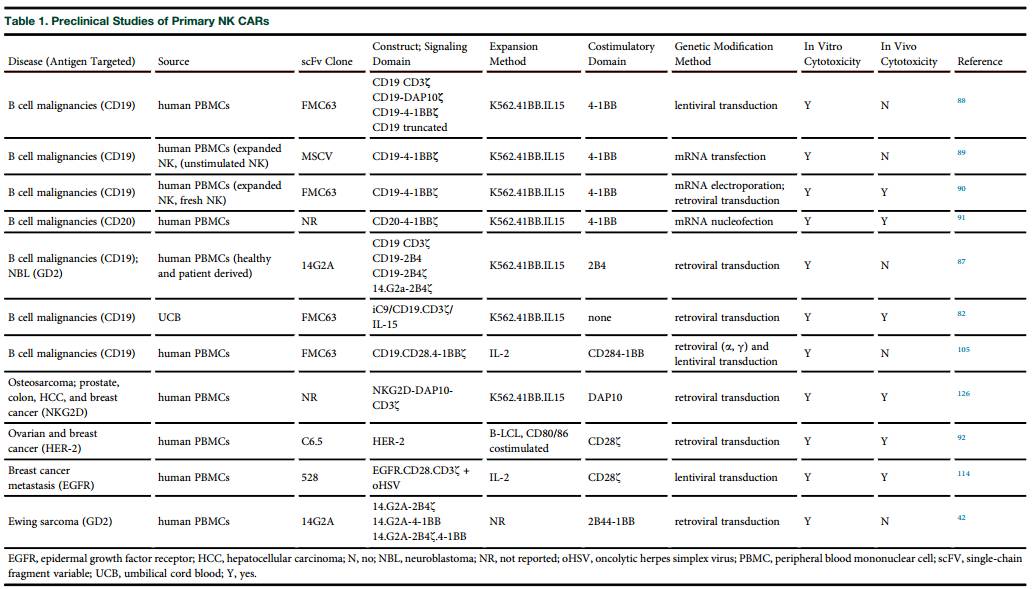
基因改造有许多理论上的优势。NK-92细胞系优于原代NK细胞。其是一个已建立好的具有依据标准冷冻保存细胞库的操作方法能成功复制和扩增的同质细胞系的特征。是一个能持续扩增的细胞系并且具有“无限”的数量,使NK细胞在CAR治疗中拥有足够的代数与有用的数量。近年来,一些团体,修饰了NK-92细胞表达不同的CARs来针对血液和实体恶性肿瘤,包括CD19和CD20的B细胞白血病/淋巴瘤,CD38和CS-1多发性骨髓瘤、和HER-2上皮肿瘤、 CAR修饰的NK-92细胞也可以通过瘤内注射,使它们能够传播到肿瘤部位。并发挥他们的作用是通过类似疫苗的机制。此外,转导效率在原发性NK细胞中有很大差异,当转导NK-92时,CAR的表达与其转染效率有更一致相关性,这大部分归因于其细胞系的同质性。转导NK-92细胞效率平均约50%,即使使用非病毒方法如电穿孔转染或核酸转染。
虽然一些研究已经证实了作为大规模扩增和使用NK-92细胞作为异基因细胞免疫疗法的安全性与可行性。 NK-92细胞有固有的缺点必须加以考虑。临床上最显著的缺点包括他们潜在的致瘤性(因为NK-92细胞来自NHL患者),多种细胞遗传学异常和潜伏感染Epstein Barr病毒(EBV)。因此,为安全起见,NK-92细胞在进入临床使用之前要经过X照射。之前多数团队认为,1000个剂量的辐射足够使得植入的NK—92细胞对体外细胞毒性的影响最小。输液前的辐射处理很可能会对它们在体内的增殖,持续能力和长期的抗肿瘤作用产生负面影响。 CAR-T细胞的效用是由其持久性决定的,同样,体内NK细胞过继输注疗效已依赖于它们在体内的扩增与持久能力。此外,我们已经在淋巴瘤小鼠模型中证明了在表达CAR的 NK细胞体内的持久性对有效的持久的抗肿瘤免疫的重要性,重复注射辐射后的NK-92细胞是可行的,可作为一种手段规避他们有限的持久性,但是这样一种方法很可能会诱发异基因细胞系抗体和细胞免疫以及每次输注后更快的排斥反应。此外,NK细胞缺乏几种典型的活化表达受体(例如,NKP44和NKP46110120),他们不表达内源性Fc受体,因此不能调控ADCC。为了克服后者的缺点,一NK-92细胞衍生表达fcrRⅢ高亲和力的变种已经被发展起来,这种高亲和变异也被证明在原代NK细胞是有用的,因为只有10%的人口自然携带这种多态性。表2总结了CAR修饰的NK细胞株的临床前研究结果。
另一种适合CAR表达的NK细胞来源是人类多能干细胞(hPSCs)。人类胚胎干细胞(胚胎干细胞)和诱导多能干细胞(iPSCs)可以无限期地保存并提供几乎无限NK细胞的供应。最近有一份实验方法针对从冷冻CB分离出人CD34 + HPSCs 再对NK细胞进行分化,然后将其修饰表达CD19-CAR蛋白。该团队还描述了无饲养层方法:利用胰岛素样生长因子1从hPSCs中收集基因修饰过的NK细胞。,这种方法有可能被用来作为一个平台来表达其他的CAR蛋白。
所有的car-nk构建到目前为止讨论是细胞内的信号转导链cd3ζ,它针对表面表达的肿瘤相关抗原的细胞.赋予特定的细胞毒作用。另一个吸引人的战略是发展car-nk细胞靶向活化的NK受体如NKG2D受体,NKG2D配体包括主要组织相容性复合体(MHC)I类链相关发展目标配体(MICA),MICB,和几个UL-16-结合蛋白(ULBPs),它们在多种肿瘤细胞和病毒感染的细胞表面高表达。因此, NKG2D CAR具有潜在识别大约90%的人类肿瘤类型的功能
.126
这种方法的其他好处是, CAR不仅识别肿瘤细胞也识别NKG2D配体表达的免疫抑制细胞,如髓源性抑制细胞(MDSCs)与调节性T细胞(Tregs)。然而,NKG2D配体也在各种生理条件下诱发的,如炎症。这引起了人们对“靶标/非肿瘤”毒性的关注。
虽然NK细胞通常表达NKG2D,但表达
NKG2D
的CAR相比于内源性NKG2D受体能大大提高他们的活性。NKG2D缺乏胞浆区的信号模体及其连接信号转导是通过DNAX激活磷酸化蛋白10(DAP10),从而招募下游信号效应蛋白和诱发细胞毒性
.
为了测试超生理激活信号是否可以提高NK介导的细胞毒性、常等。用DAP10 与NKG2D / CD3ζCAR在来源于不同的恶性肿瘤多个细胞系中共表达用来检测NK细胞活性,ALL,骨肉瘤,前列腺癌和横纹肌肉瘤中表现出最好的反应。全部这种策略的一个缺点是在一些原发性恶性血液病中激活配体存在下调或丢失,这可能会影响NKG2D介导的细胞毒作用。有趣的是,作者发现,NKG2D配体的表达和NKG2D-DAP10—cd3ζ受体介导的细胞整体水平毒性作用两者之间没有显著的相关性。